Структура в целом
Stage II Sporulation E Family Protein from Thermanaerovibrio acidaminovorans — многомембранный белок с двумя раздельными функциями. Он играет роль в переключении к полярному делению клеток во время споруляции и обладает фосфатной активностью, расположенной в C-концевой области, которая необходима для активации sigma-F путем дефосфорилирования фосфопротеина SpoIIAA-P.
Молекула белка состоит из двух полипиптидных цепей, и в биологическую единицу входят две цепи А и B, которые почти идентичны. (Теоретически — идентичны).
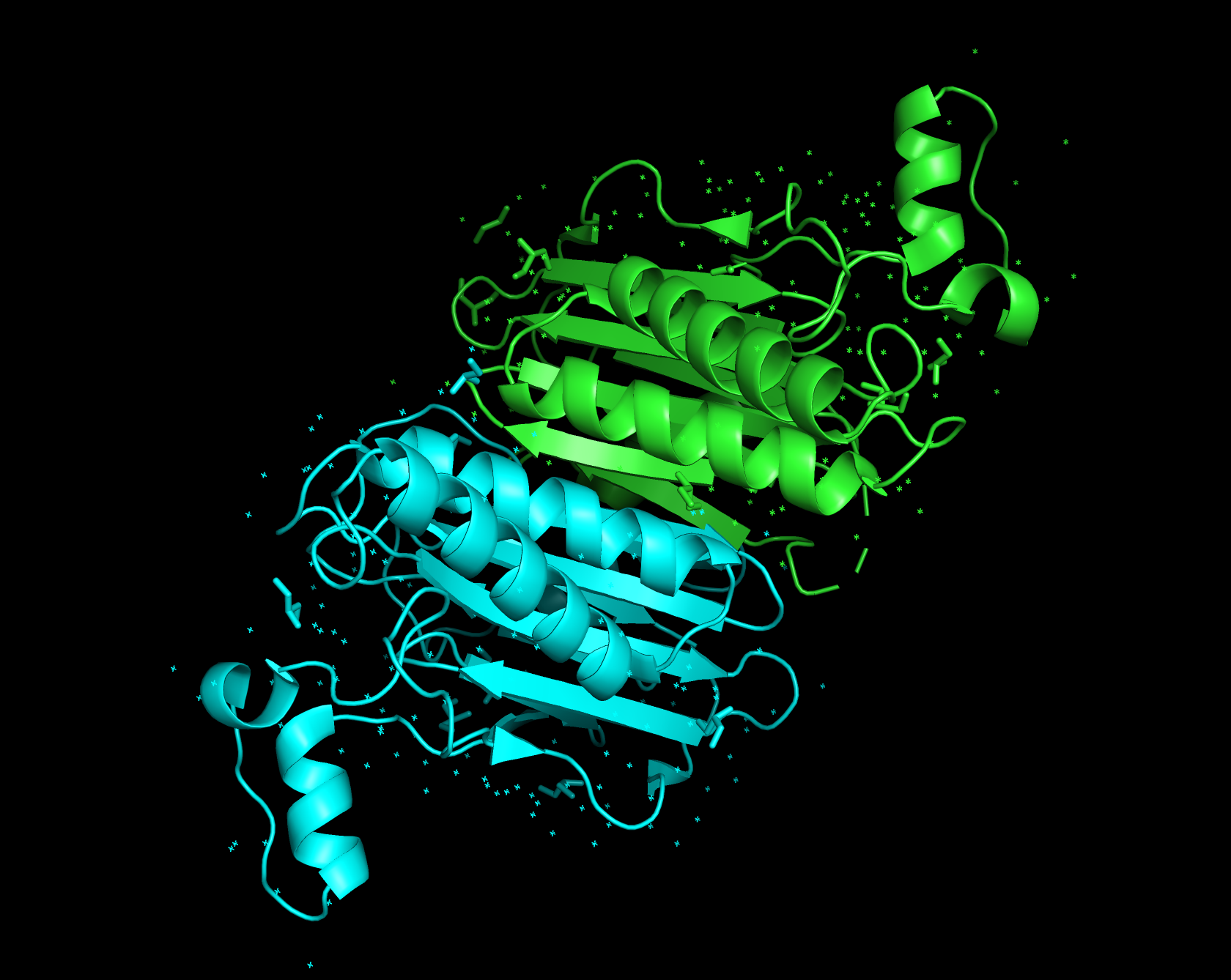
Pиc 1. Белок 3RNR
Отдельные цепи
Данный белок был обнаружен в организме Thermanaerovibrio acidaminovorans DSM 6589, а экспрессировался Escherichia coli BL21.
Данные uniprot:
Uniprot_id: D1B7C2
Название: Crystal Structure of Stage II Sporulation E Family Protein from Thermanaerovibrio acidaminovorans
Функция: данные отсутствуют
Вторичная структура молекулы белка представлена 10 α-спиралями и 22 β-тяжами. Цепи, теоретически, состоят из 422 аминокислот. Однако в ходе проведения эксперимента было получено 417 аминокислот. 5 из них отсутствовали на А цепи на позициях 166-170.
Молекула не имеет мутаций по данным UniProt.
Обнаружена одна модифицированная аминокислота - селенометионин. (В файле формата .pdb перед молекулой, которая была добавлена в структуру белка стоит слово "HETATM" - heteroatom.) Также были найдены малые молекулы: EDO, ACY, GOL
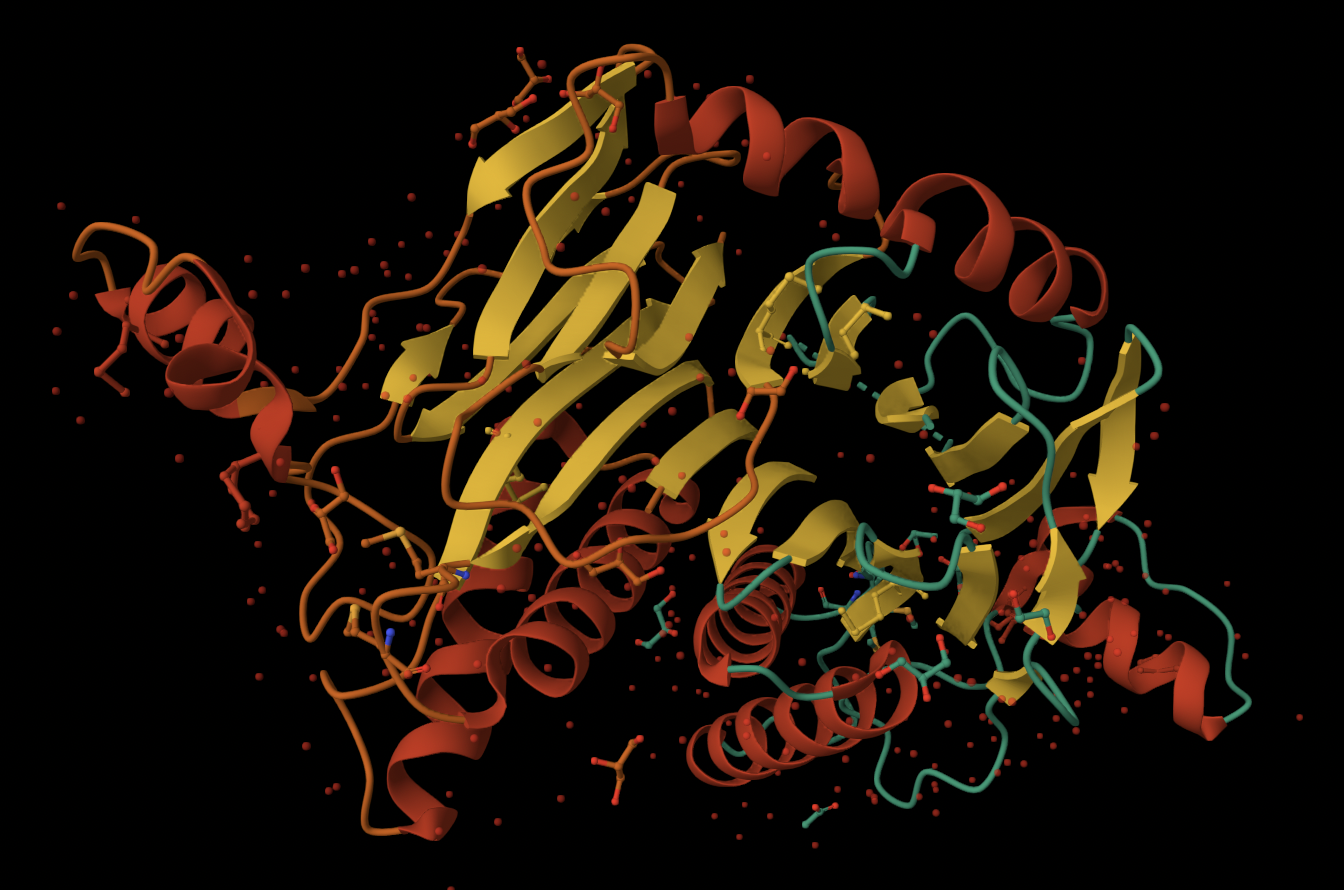
Pиc 2. α-спирали (выделены красным) и β-тяжи (выделены желтым)
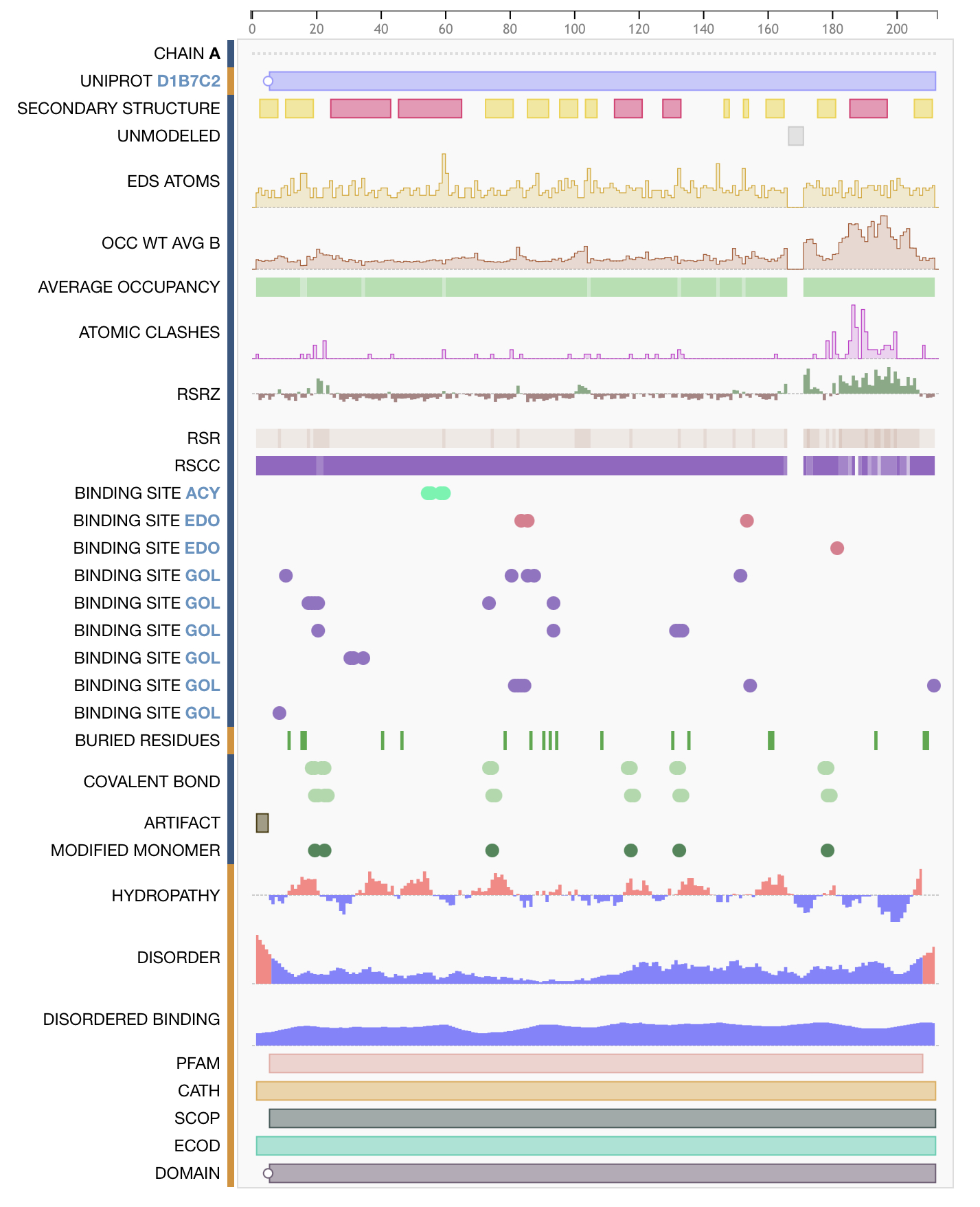
Pиc 3. Данные Uniprot
Малые молекулы
В записи структуры есть три типа малых молекул:
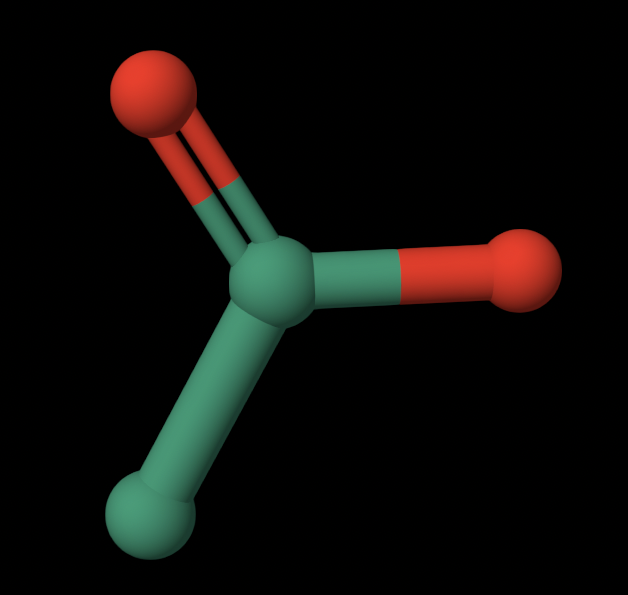
1. GOL — GLYCEROL
Расположен в активном центре
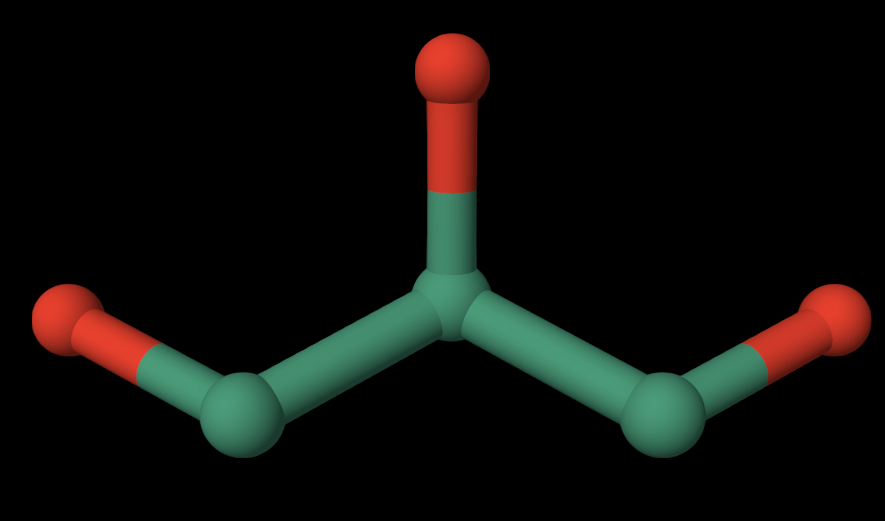
2. EDO — 1,2-ETHANEDIOL
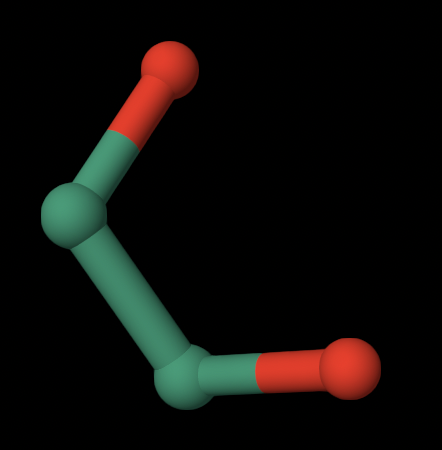
3. ACY — ACETIC ACID
Малые молекулы:
Исходя из данных о молекуле можно сделать вывод, что лиганды были добавлены искуственно в процессе получения структуры. (Аналогично, как и с молекулами модифицированной аминокислоты. Обозначение "HETATM" указывает на то, что молекулы были добавлены в ходе эксперимента. Это необходимо для того, чтобы различать гетероатомы от стандартных атомов. Они обозначаются словом "ATOM")
Функции малых молекул:
Уксусная кислота: не связана с функцией белка. Могла использоваться для регуляции pH среды (буферная система)
Глицерол и 1,2 — этандиол: Использовались для стабилизации структуры при низких температурах и для улучшения кристаллизации.
Исследование структуры молекулы белка
Взаимодействия в белке 3RNR (не завершен)
В молекуле белка представлены различные типы взаимодействий, такие как: водородные связи, ковалентные связи, различные виды стекинг-взаимодействий
Водородные связи
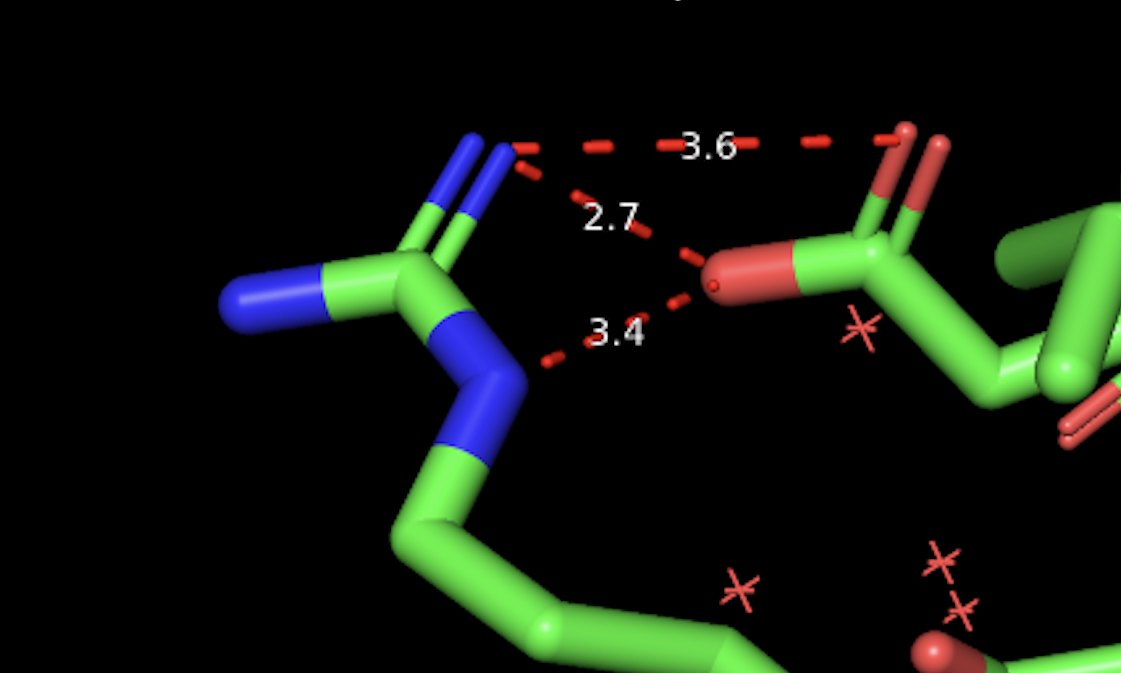
Водородные связи можно рассмотреть на примере взаимодействия между аминокислотами основной цепи и лигандами
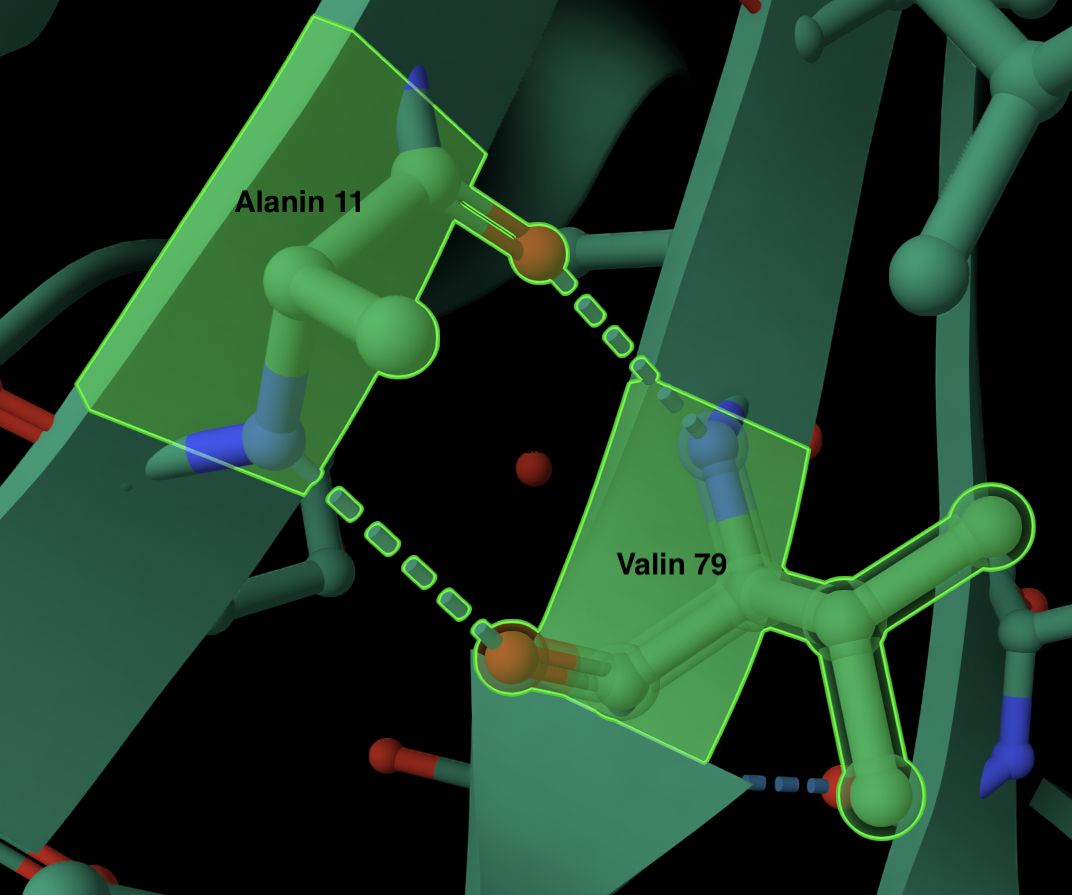
Pиc 4. Водородные связи между ALA11 и VAL179
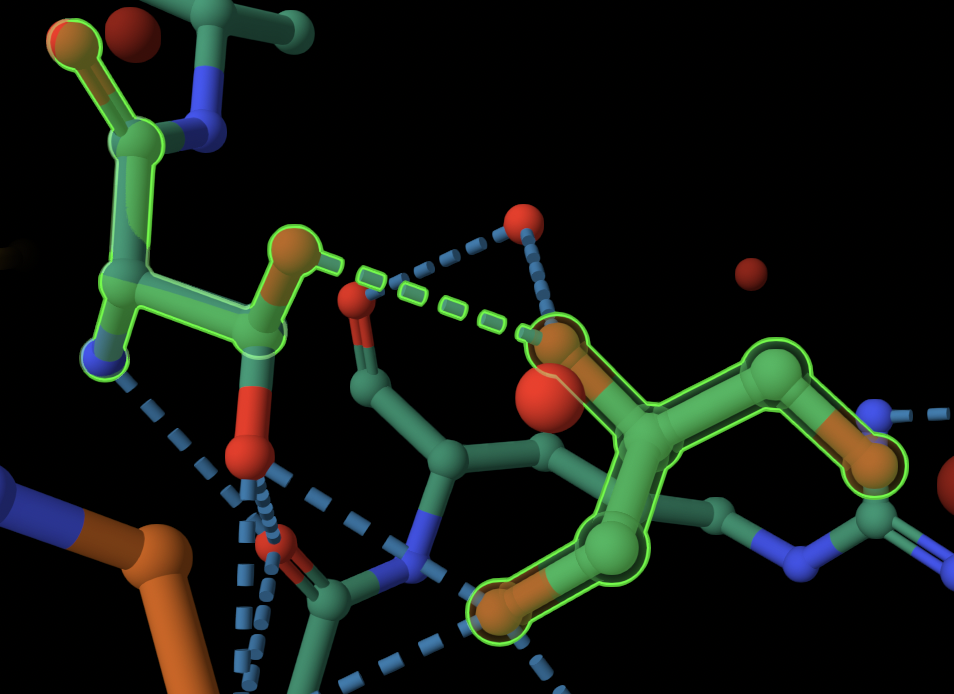
Pиc 5. Водородные связи между SER34 и GOL216
Стекинг
Стекинг - это тип взаимодйствия между ароматическими аминокислотами, при котором расположение ароматических циклов отдаленно напоминает расположение монет в стопке. Поддерживается ароматическими взаимодействиями
В данной молекуле почти нет стекинг взаимодействий. Однако нельзя утверждать что их нет. Расстояние между молекулами TRP60 и HIS58 составляет 7,79 Å, поэтому взаимодействие слабое (нормальное значение 4-6 Å)

Pиc 6. Стекинг взаимодействие между TRP60 и HIS58

Pиc 7. Карта стекинг взаимодйствий
Cation-π взаимодействие
Cation-π взаимодействие - тип взаимодействия, в котором задействованы положительно заряженный катион и π-электронная плотность в ароматических соединениях. Cation-π взаимодействия играют важную роль в структуре и функции белков, например, в стабилизации трехмерной конфигурации белков.

Pиc 8. Cation-π взаимодействие между TRP60 и ARG31
Гидрофобные взаимодействия
Гидрофобные взаимодействия — это нековалентные взаимодействия, возникающие между неполярными или малорастворимыми в воде молекулами или группами атомов.

Pиc 9. Гидрофобное взаимодействие между VAL4 и ALA177
Дисульфидные мостики
Дисульфидные мостики - это ковалентная связь между двумя атомами серы (—S—S—), входящими в состав двух остатков серосодержащей аминокислоты цистеина. В данной молекуле не наблюдается такой тип связи
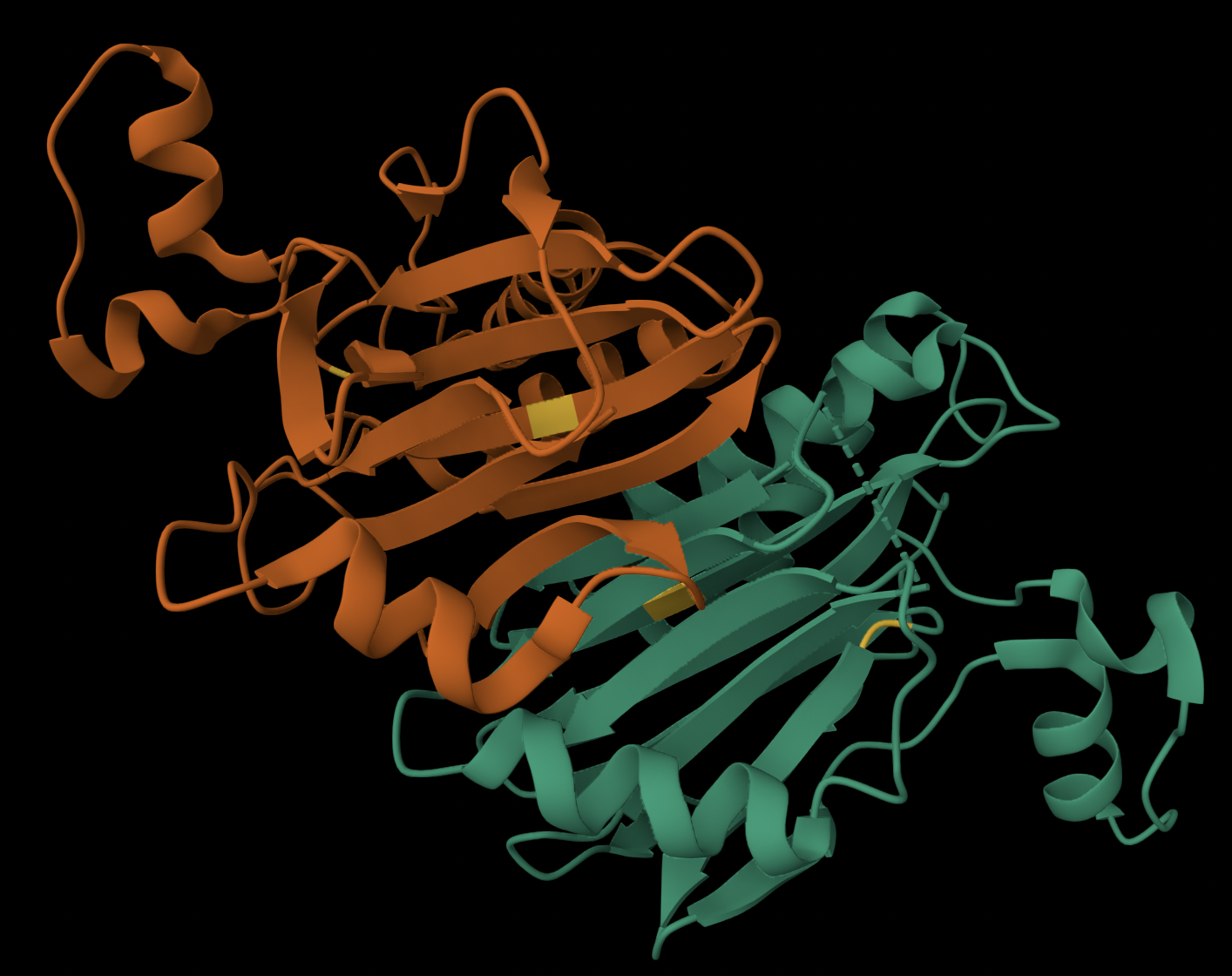
Pиc 10. Расположение Cys (Цистеины обозначены желтым цветом)
Солевые мостики
Солевой мостик - это ионная связь между COO- группами аспарагиновой или глутаминовой кислоты и NH3+ группами лизина или аргинина, по длине не превышающая 4 ангстрема.
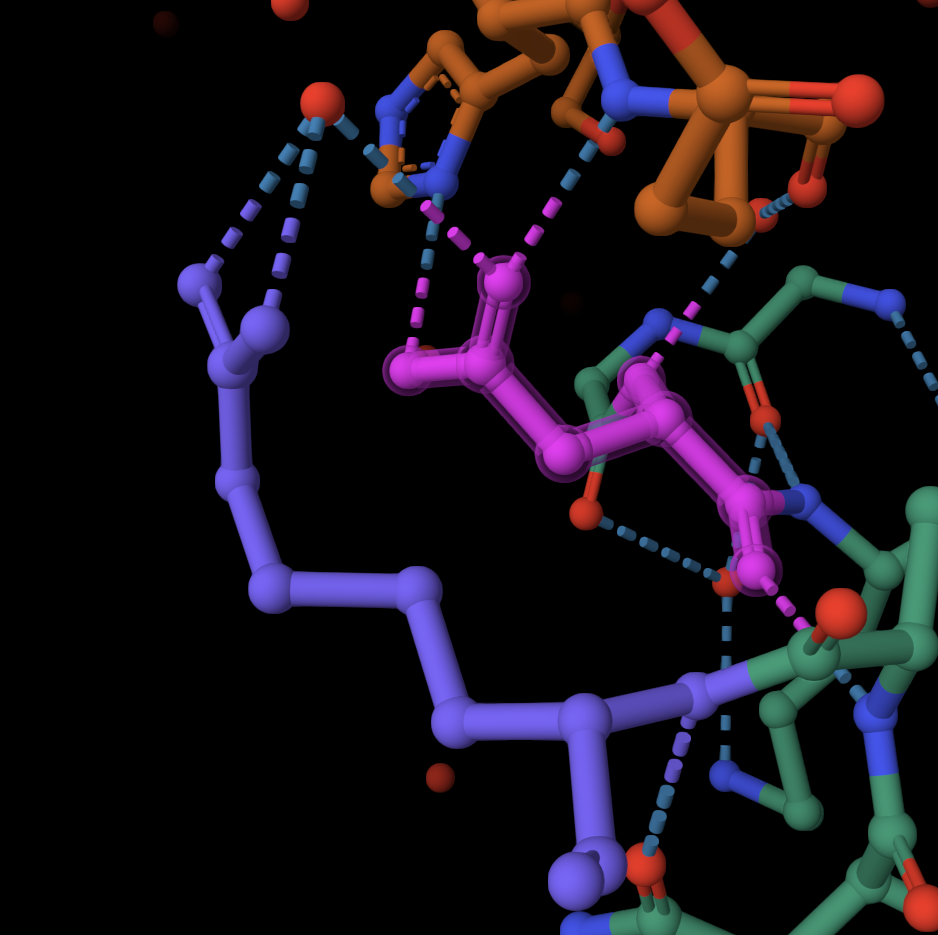
Рис 11. Солевой мостик между ASP6 и ARG79