Изображение области связывания аспарагиновой кислоты (asp427 - функциональный лиганд) c А-цепью L-аспарагиназы
На главную страницу первого семестра
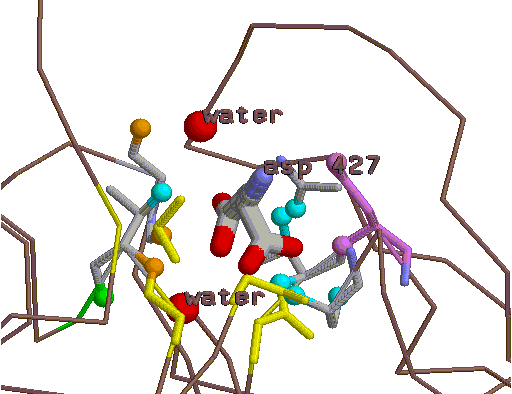 |
Так выглядит зона контакта Asp427 и цепи А. Это и последующие изображения получены с помощью программы
RasMol. В остовной модели (коричневый цвет) изображен фрагмент цепи А. В проволочной - аспарагиновая кислота 427 и
взаимодействующие с ней аминокислотные остатки, контактирующие атомы и вода (отображаются О-атомы, цвет красный)
- в шариковой.
"Разъяснения" по цветам: голубым (cyan) цветом отображены контакты через водородные связи,
желтым (yellow) - гидрофобные
взаимодействия, золотым (gold) - взаимодействия через водяные мостики. Аспарагиновая кислота 427: применена "раскраска по
атомам".
Фиалковый цвет (violet) - цвет Asp90, зеленый (green) - цвет Ile13.
О важности этих аминокислотных остатков - см. ниже "Проект генноинженерного эксперимента".
Рассматриваемые области – 5-ангстремная окрестность Asp427 и 3.5-ангстремная окрестность молекул воды, попавших в
3.5-ангстремную окрестность Asp427. |
.gif) |
Зона контакта Asp427 и цепи А: водородные связи. Голубым (cyan) цветом
изображены атомы аминокислотных остатков, образующие водородные связи с Asp427. Соответствующие подписи имеются.
Рассматриваемая область – 3.5-ангстремная окрестность Asp427 ( 3.5 ангстрем - максимальная длина водородной
связи. |
.gif) |
Зона контакта Asp427 и цепи А: гидрофобные взаимодействия.Желтым (yellow) цветом
изображены соответствующие аминокислотные остатки (подписи есть...).
Рассматриваемая область – 4.5-ангстремная окрестность Asp427. |
.gif) |
Зона контакта Asp427 и цепи А: взаимодействие через водяные мостики. Изображены
вода ( всего 2 молекулы; отображаются О-атомы в шариковой модели, цвет красный) и
взаимодействующие аминокислотные остатки - золотой цвет (gold).
Рассматриваемые области – 3.5-ангстремные окрестности двух молекул воды, попавших в
3.5-ангстремную окрестность Asp427. |
Проект генноинженерного эксперимента
Список аминокислотных остатков белка , контактирующих с молекулой аспарагиновой кислоты (цепь А – asp427)
и являющихся первыми кандидатами для мутагенеза:
водородные связи:
- атомы кислорода боковых цепей остатков Gln59, Asp90 взаимодействуют с NH2-группой аспарагиновой кислоты;
- карбоксильная группа (альфа-карбоксильная группа) аспарагиновой кислоты контактирует с атомами азота остатка Asp90
и Ser58; кислорода –ОН – группы (OG кислород) а.о. Ser58;
- бета-карбоксильная группа аспарагиновой кислоты взаимодействует с атомами азота Thr89, OG1 Thr89, OG1 Thr12.
гидрофобное взаимодействие:
- Val 27
- Gly 57
- Gly 11
- Gly 88
образование “водяных мостиков” с:
- Met 115 ( О атом Met 115 образует с бета-карбоксильной группой аспарагиновой кислоты, атомом OD2);
- Ala 114 ( O атом Ala 114 образует с бета-карбоксильной группой аспарагиновой кислоты, атомом OD1);
- Thr 12 ( N атом Thr 12 образует с бета-карбоксильной группой аспарагиновой кислоты, атомом OD1);
- Ile 13 ( N атом Ile 13 образует с бета-карбоксильной группой аспарагиновой кислоты, атомом OD1).
Как вариант замены аминокислотного остатка белка, приводящей к потере способности связывания аспарагиновой кислоты с
молекулой белка, можно предложить замену Asp90 на Gly90. Почему потеряется способность связывания?
Во-первых, данная
замена является заменой полярного остатка на неполярный (гидрофобный Gly…). Вот если производить замену на другой полярный
аминокислотный остаток, то на способность к связыванию это может (при определенных оговорках) и не повлиять…если боковые
группы заменяемых а.о. будут иметь сходные свойства. Пример: интересна работа [Palm G.J., Lubkowski J., Derst C.,
Schleper S.,Rohm K.H., Wlodawer A. (1996) FEBS Lett. 390, 211-216], в результате которой была получена
мутантная форма аспарагиназы E.coli, в молекуле которой остаток Thr89 был заменен на остаток Val. Тогда выяснили, что
первичным нуклеофилом является Thr12, а именно он был ковалентно связан с аспартатом. К чему я об этом? Дело в том,
что целью такой замены было “устранение” одного из нуклеофилов (Thr89 в данном случае) заменой на а.о., лишенный данного
свойства.
Во-вторых, Asp 90 образует с аспарагиновой кислотой 427 две водородные связи. Очевидно, что 2 связи – роскошь,
в данном случае, недоступная Gly (хотя одну образовать может...).
И еще некоторые размышления (хотя маловероятно разрушение альфа-спирали, но все же...):
аспарагиновая кислота стабилизирует альфа-спираль, а глицин ее разрушает, способствуя образованию нерегулярных участков.
С чем связана эта разница? С тем, что область допустимых углов фи,пси для глицина в “клубке” гораздо больше, чем
для аспарагиновой кислоты. Т.о. пространственный фактор может стать причиной потери способности связывания.
Замена а.о. белка на а.о., мало влияющая на способность аспарагиновой кислоты 427 связываться с цепью А:
возможный вариант – глутамин 59 на аспарагин. Вполне достойный вариант: оба аминокислотных остатка полярны, размеры
боковых радикалов приблизительно одинаковы, но главное – одинаковые доноры ( карбонильная группа).
Однако возможны проблемы, связанные с тем, что боковая цепь аспарагина короче, и может оказаться недостаточной длины
для образования аналогичной водородной связи…
Как вариант замены аминокислотного остатка, контактирующего с аспарагиновой кислотой 427, но, возможно, мало
влияющего на способность связываться с ней, - замена Ile 13 ( изолейцина 13). Такой выбор можно объяснить тем, что
взаимодействие с аспарагиновой кислотой (427) происходит посредством водяного мостика. Замена изолейцина 13 какой-либо
другой аминокислотой (лейцином, например,–самый "безобидный" вариант) будет иметь минимальные последствия, т.к. основа
– связь N-H – O – OD1.
При проектировании экспериментов были учтены мудрые советы и справедливые замечания (по работе Credit2) Андрея
Владимировича Алексеевского (ААл) - за что ему огромное спасибо!!!
©NADEZDA TUKHTUBAEVA,2005

.gif)
.gif)
.gif)