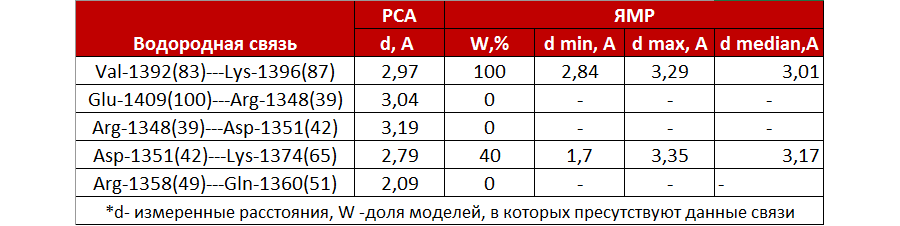
Для дальнейшего сравнения были выбраны следующие структуры: 2H3L с разрешением 1 Å, полученная методом рентгеноструктурного анализа (РСА), и 1N7T с 20 моделями, полученная методом ядерного магнитного резонанса (ЯМР). Для проверки схожести в укладке структур выравним их с помощью команды align в PyMol(Рис.1А).
Рис.1. Проверка схожести укладки структур
Темно-красным обозначена структура 2H3L, красным - 1N7T.
А: Структура из РСА и усредненная модель из ЯМР.
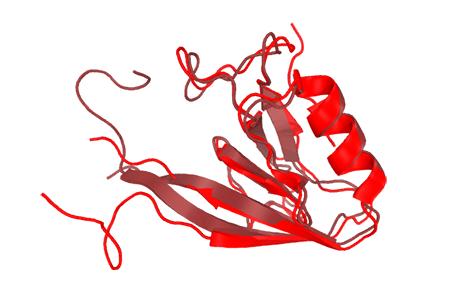
B: Показаны все модели из ЯМР эксперимента.
А: Структура из РСА и усредненная модель из ЯМР.
B: Показаны все модели из ЯМР эксперимента.
На изображении видно, что положение альфа-спиралей и бета-листов в целом совпадает. Заметно различается положение С- и N-концевых участков белка, что может служить свидетельством об их стабильности в кристалле (ведь их удалось расшифровать) и подвижности в растворе. Последний факт подтверждается путем изображения всех моделей, полученных методом ЯМР(Рис.1B).
Для сравнения выберем водородные связи на разных участках белка. Будем считать, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3,5 ангстрем. Воображаемый водород должен быть на линии донор-акцептор или отклоняться от этой линии не более чем на 70 градусов.
Были выбраны следующие водородные связи: Val-1392(83)---Lys-1396(87) в остовной части альфа-спирали, водородные связь между боковыми цепями Glu-1409(100)---Arg-1348(39)---Asp-1351(42)---Lys-1374(65), связь Arg-1358(49)---Gln-1360(51) в петле, выходящей на поверхность глобулы.
Атомы, между которыми предполагаются взаимодействия (опираясь на структуру, полученную в РСА):
Val-1392(83)---Lys-1396(87) - альфа-С=О группа Val и альфа-NH группа Lys.
Glu-1409(100)---Arg-1348(39) - NH1 Arg и OE2 Glu.
Arg-1348(39)---Asp-1351(42) - NH2 Arg и OD2 Asp.
Asp-1351(42)---Lys-1374(65) - NZ Lys и OD2 Asp.
Arg-1358(49)---Gln-1360(51) - NH1 Arg и OE1 Gln.
В скобках указан порядковый номер аминокислотного остатка в структуре, полученной методом ЯМР.
Рис.2. Сравнение водородных связей
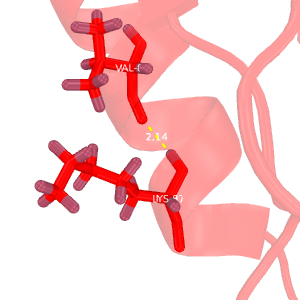
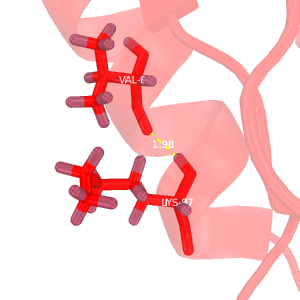
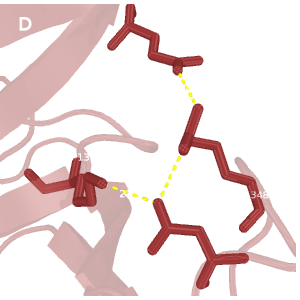
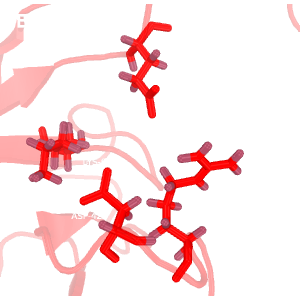
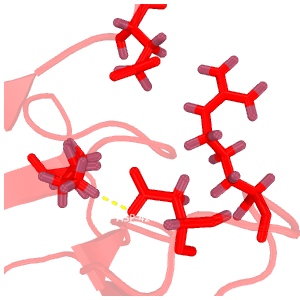
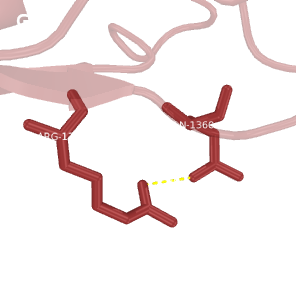
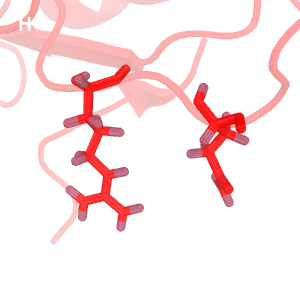
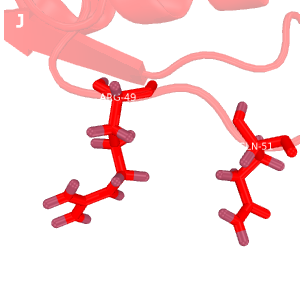
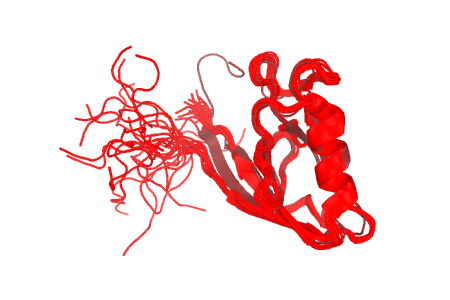
Темно-красным обозначена структура 2H3L, красным - 1N7T. На структурах, полученных методом ЯМР, водороды окрашены темнее, чем все прочие атомы.
A: водородная связь между Val-1392(83)---Lys-1396(87) альфа-спирали структуры 2H3L.
B-C: водородные связи в разных моделях ЯМР.
D: водородная связь между боковыми цепями Glu-1409(100)---Arg-1348(39)---Asp-1351(42)---Lys-1374(65); РСА.
E-F: водородные связи в разных моделях ЯМР.
G: водородная связь между Arg-1358(49)---Gln-1360(51) в петле 2H3L, выходящей на поверхность глобулы; РСА.
H-J: водородные связи в разных моделях ЯМР.
A: водородная связь между Val-1392(83)---Lys-1396(87) альфа-спирали структуры 2H3L.
B-C: водородные связи в разных моделях ЯМР.
D: водородная связь между боковыми цепями Glu-1409(100)---Arg-1348(39)---Asp-1351(42)---Lys-1374(65); РСА.
E-F: водородные связи в разных моделях ЯМР.
G: водородная связь между Arg-1358(49)---Gln-1360(51) в петле 2H3L, выходящей на поверхность глобулы; РСА.
H-J: водородные связи в разных моделях ЯМР.
Согласно рис.2A-C, водородные связи в каркасе альфа-спирали, образуемые между -NH2 и -C=O аминокислот, находящихся на 4 аминокислоты раньше в альфа-спирали, достаточно стабильны в растворе ввиду общей стабильности элементов вторичной укладки, составляющих ядро белка. Ни в одной из моделей ЯМР эти связи не потеряны. Что же касается подобного рода взаимодействий на поверхности белка, то в растворе аминокислоты, находящиеся на более-менее подвижных участках цепи, не связаны определенным положением и могут как сближаться, образуя связи, так и удаляться друг от друга (рис.2D-J, табл.1).
Таблица 1. Сравнение водородных связей