4. "Рositive inside"
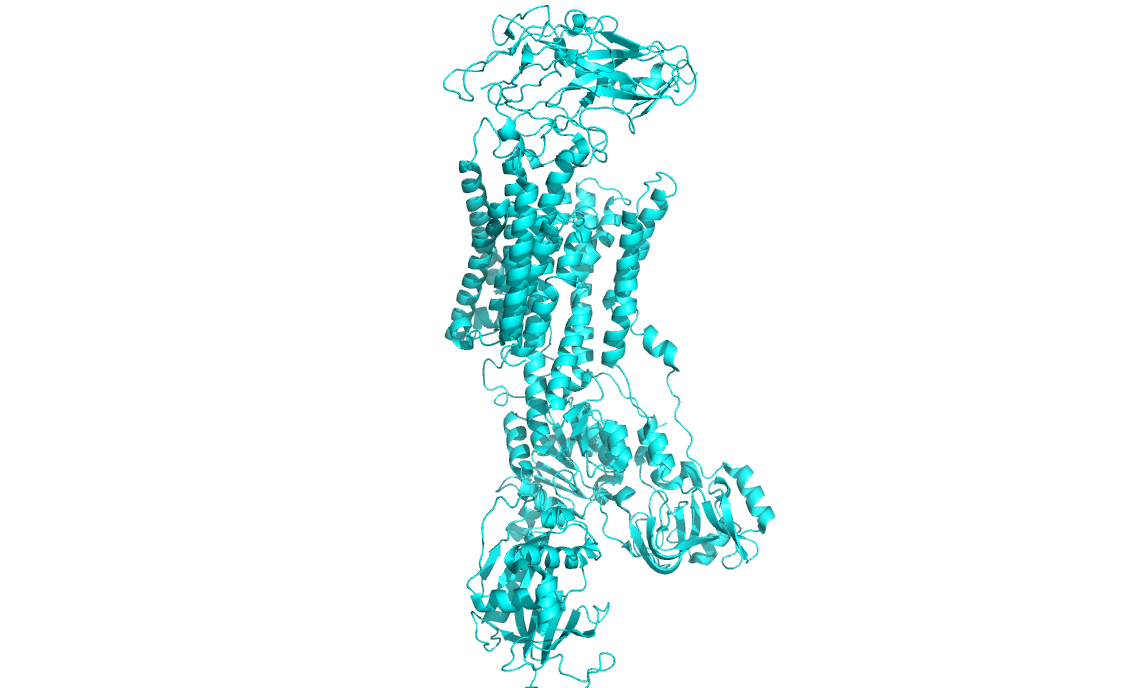
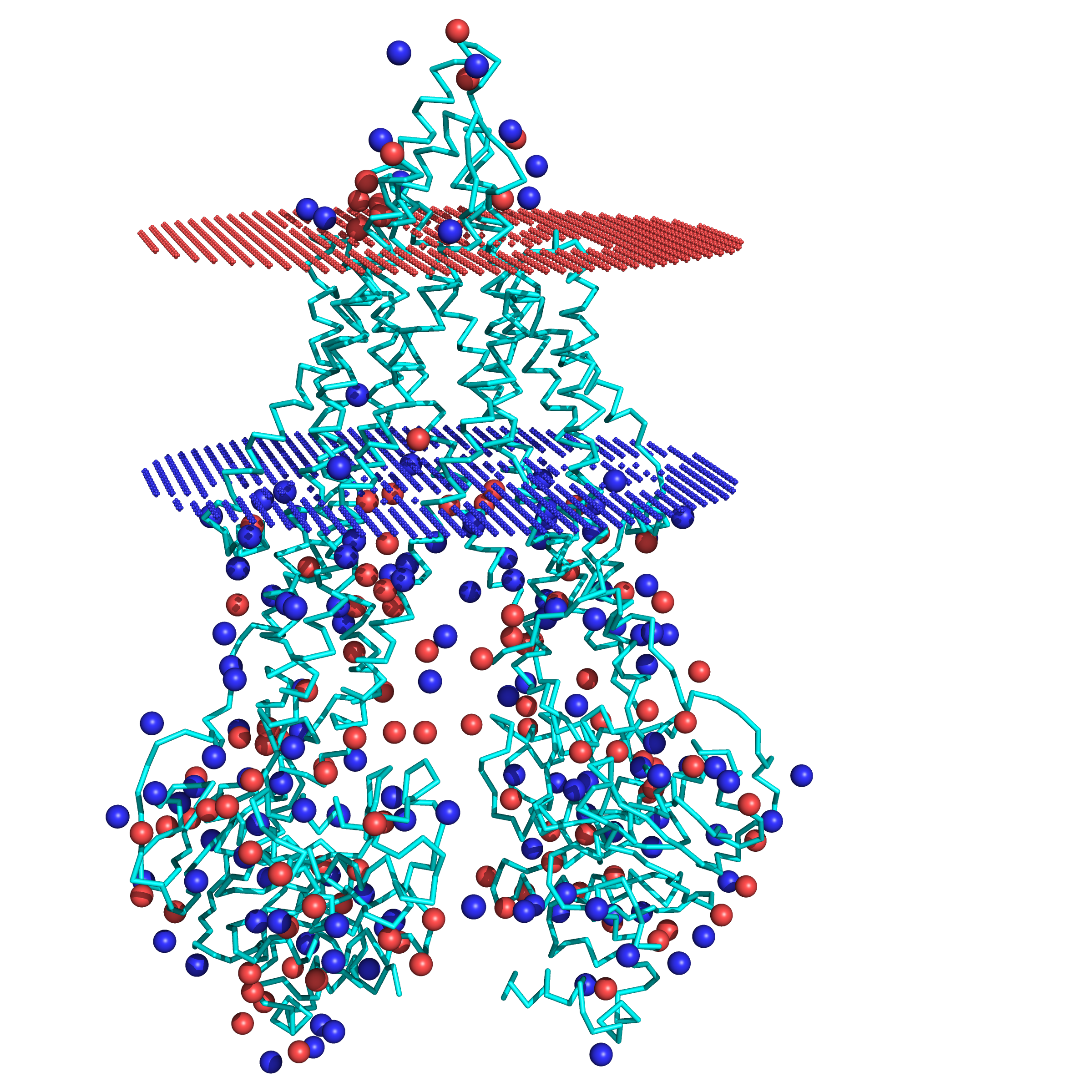
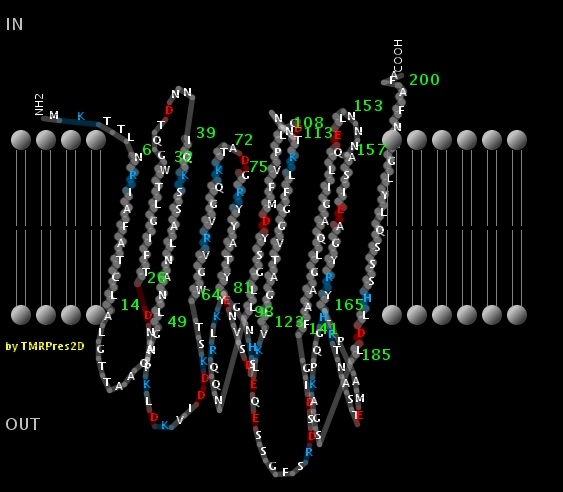
Чтобы проверить правило "positive inside" с 3D-гомологом, я выделил синим положительно заряженные атомы азота аргинина и лизина (гистидином принебрег) и
красным отрицательные кислороды аспартата и глутамата в программе Pymol. Если по рисунку кажется, что правило не выполняется, это
иллюзия. На самом деле, на внутренней стороне 810 положительных и 660 отрицательных атомов - очевино, что внутри большой плюс (особенно если еще присовокупить гистидины). На внешней стороне
- нуль: равное количество противозарядов. Заметно, что в толще мембраны вообще нет заряженных остатков.
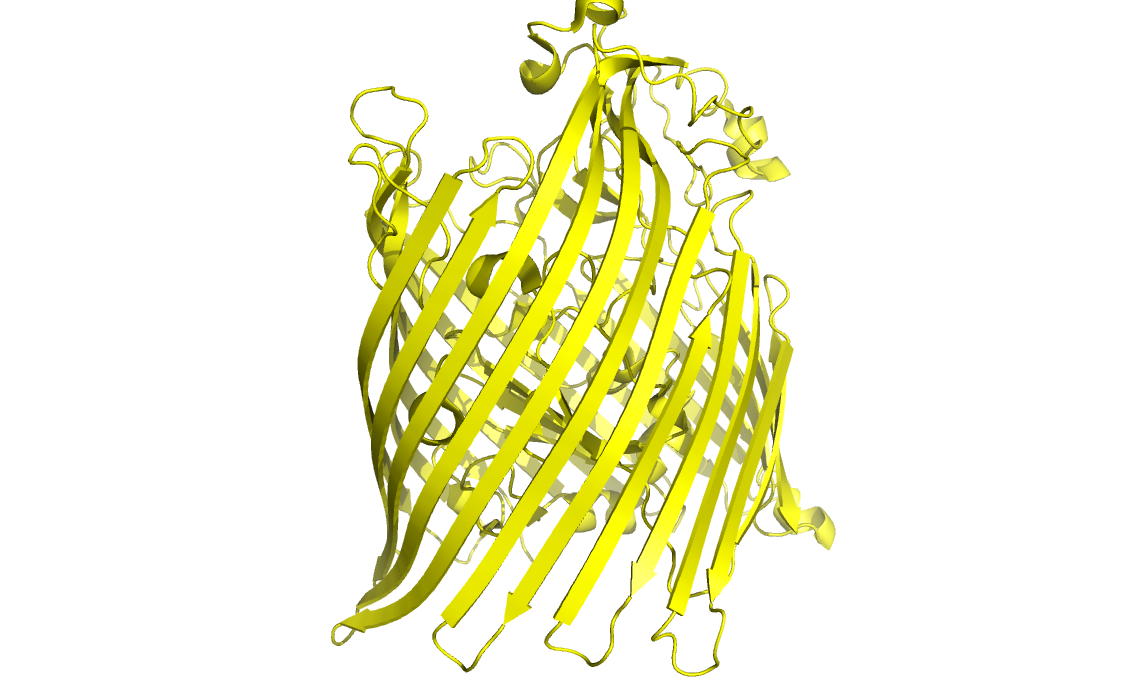
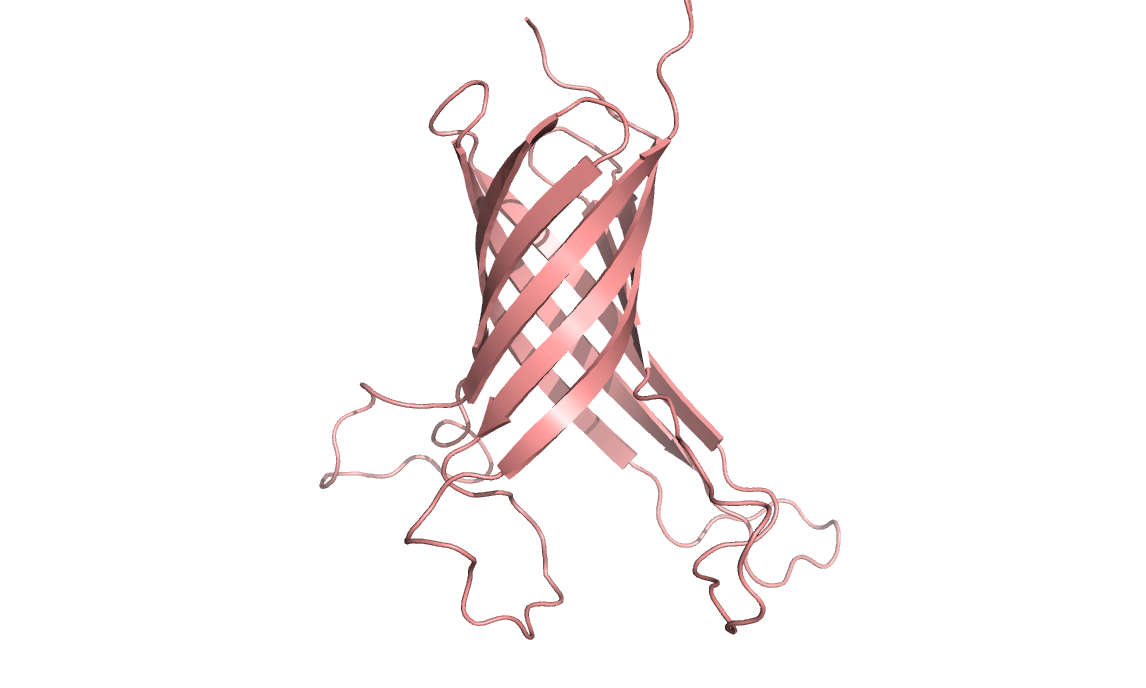
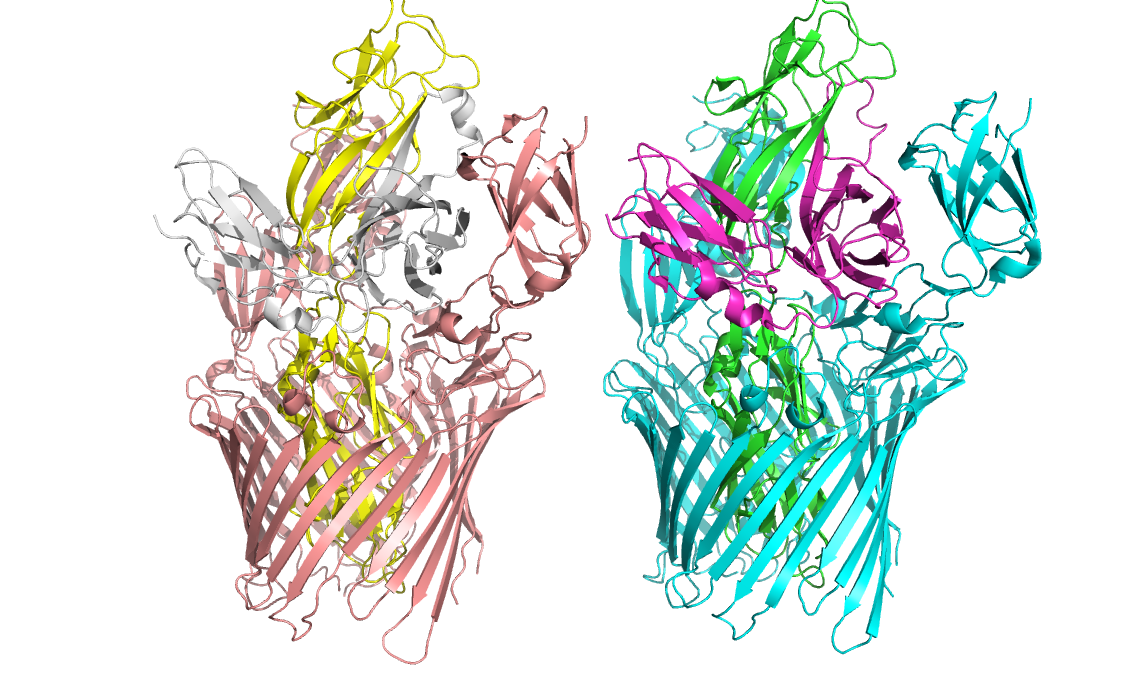
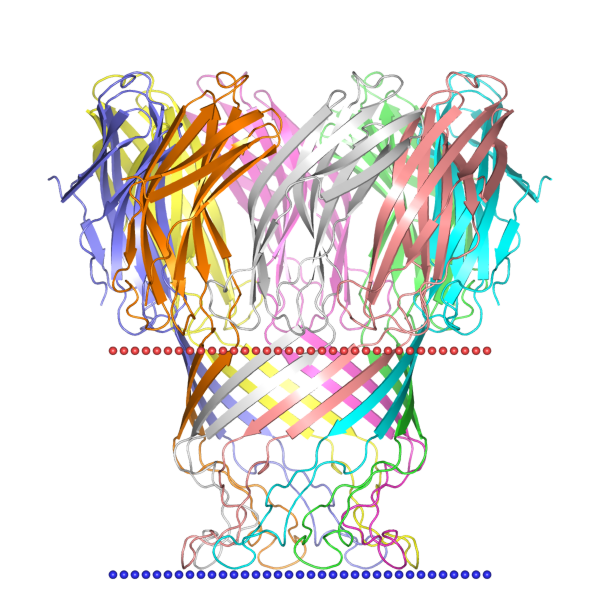
5. Транс-мембранный бета-баррель у грам-положительных бактерий
Mycobacterium smegmatis - грам-положительная бактерия
Порин MspA, 1UUN
Селективен по отношению к катионам благодаря высокой плотности отрицательного заряда на поверхности. Также транспортирует
глюкозу, серин, гидрофильные бета-лактамы и пр.
Существует два отличия от бета-баррелей грам-отрицательных бактерий:
N- и С-концевыеучастки выходят наружу,
их цепи как бы намотаны вокруг поры против часовой стрелки.
Источник
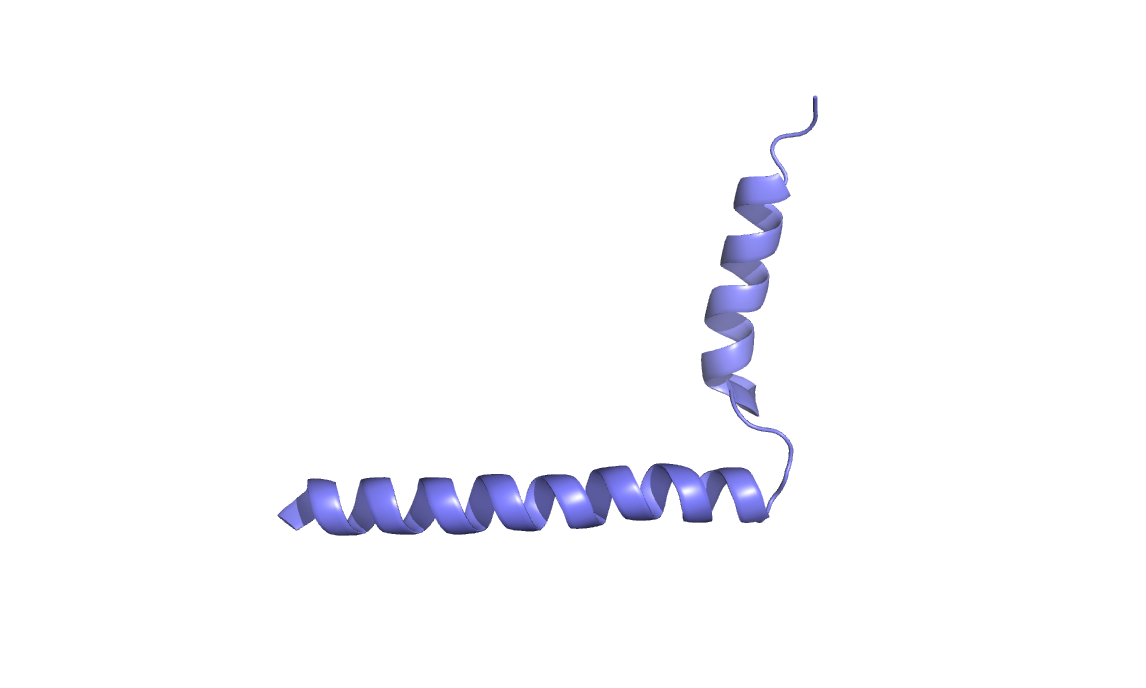
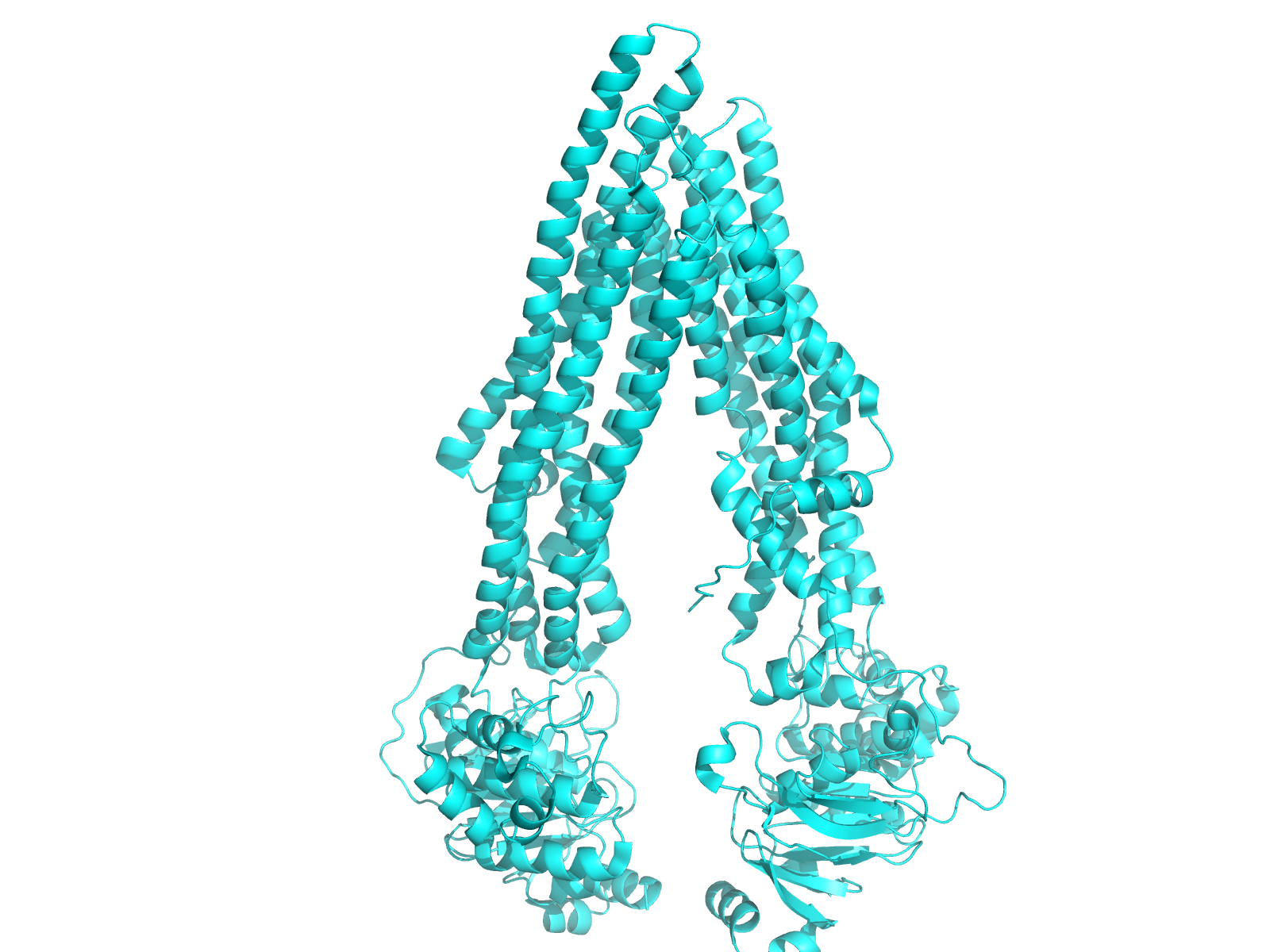
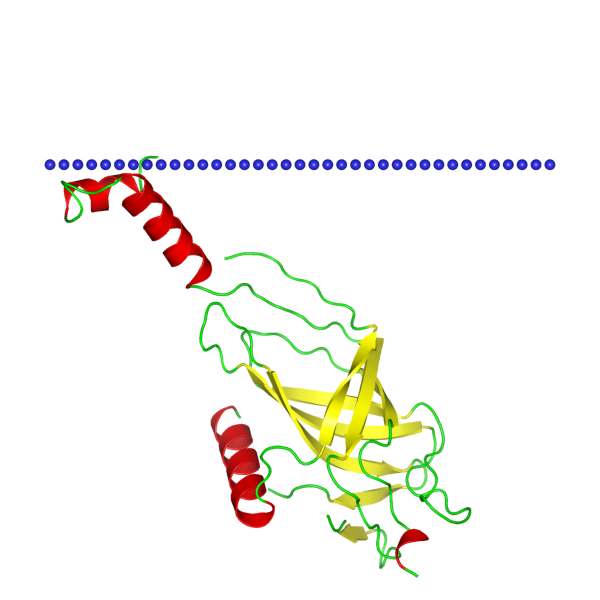
6. Альфа-спиральныйбелок во внешней мембране грам-отрицательных бактерий
Helicobacter pylori - грам-отрицательная бактерия
TrbI-подобный белок конъюгации, 2BHV
Белок, участвующий в конъюгации бактерий, при которой происходит обмен генетической информацией между двумя особями.
Источник
8. Сервисы, предсказывающие трансмембранные бета-баррели по последовательности
Я нашел сервис PRED-TMBB, который предстказывает, находится, ли данный белок во внешней мембране грам-отрицательных бактерий, а
также показывает локализацию бета-стрэндов, и все это без каких-либо эволюционных методов, остнованных на выравнивании.
Решил проверить его работу на примере белка OrpH из Pseudomonas aeruginosa (2lhf)
Гомолога нашел с помощью blast причем только по nr. Это белок из Pseudomonas mendocina (YP_001188464.1)
| Реальная структура
|
Схема для гомолога
|
Было предсказано наличие 9 стрэндов, когда их в действительности 8 (не зная структуры гомолога, я говорю "в действительности", так как судя по выравнванию структура у гомолога такая же, как и
у исходного белка). Пять стрэндов совпало с исходным.
В общем, предсказание сделано верно, хотя хотелось бы более точно.
Выравнивание с разметкой
1. Увеличить клетку до размеров дыни и сказать, с чем можно сравнить мембрану
Размер клетки в 1000 раз больше толщины мембраны. 30 сантиметров дыни поделить на 1000, получим доли миллиметра. Такую толщину имеет алюминиемая фольга, например, или - из биологии - кутикула на поверхности листа или
той же самой дыни.