Атлас аминокислот: пролин
Введение
Пролин (Proline, Pro, P, L-пирролидин-2-карбоновая кислота) - гетероциклическая аминокислота с химической формулой C₅H₉NO₂, в которую атом азота входит в составе вторичного, а не первичного, амина. Поэтому правильнее было бы её относить не к аминокислотам, а к имминокислотам [1].
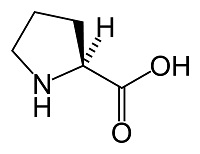
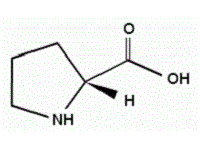
Рис.1 L-пролин Рис.2 Пролин без учёта стериохимии Рис.3 D-пролин
Пролин существует в двух оптически изомерных формах — L и D, а также в виде рацемата. Именно L-пролин — одна из двадцати протеиногенных аминокислот, но считается заменимой, так как синтезируется в организме из глутаминовой кислоты через ее полуальдегид (O=CH-CH₂-CH₂-CH(-NH₂)-COOH) [3]. Пролин входит в состав многих белков. Он является важным компонентом коллагена (составляет почти треть всех его аминокислотных остатков), необходим для нормального функционирования суставов и сухожилий. Коллаген - основной вспомогательный белок кожи, костей и соединительной ткани [1]. Считается, что пролин входит в состав белков всех организмов. В коллагене он при участии аскорбиновой кислоты окисляется в гидроксипролин. Чередующиеся остатки пролина и гидроксипролина способствуют созданию стабильной трёхспиральной структуры коллагена, придающей молекуле прочность. Также пролин входит в состав многих физиологически важных веществ, например, таких, как инсулин и грамицидин. В процессе биологического окисления пролин превращается в оксипролин являющийся его антагонистом [2].
В составе белков атом азота пролина не связан с атомом водорода, таким образом, пептидная группировка X-Pro не может быть донором водорода при формировании водородной связи. Обладая конформационно жесткой структурой, пролин очень резко изгибает пептидную цепь. Участки белков с высоким содержанием пролина часто формируют вторичную структуру полипролиновой спирали II типа, потому что пролин в белках препятствует образованию a-спиральной структуры.
Гидролиз пептидных связей, образованных пролином, осуществляется двумя ферментами: пролиназой (связь с участием -СООН пролина) и пролидазой (с участием -NH-). Реакции по атому N пространственно затруднены. Поэтому пролин, как и гидроксипролин, в отличие от других аминокислот, не образует с нингидрином пурпура Руэмана (фиолетовое окрашивание), а дает жёлтое окрашивание. Характерной для пролина цветной реакцией является реакция с изатином - появление синего окрашивания [3].
Пролин представляет собой бесцветные легко растворимые в воде кристаллы, плавящиеся при температуре около 220 °C [3].
Ричард Вильштеттер синтезировал пролин с помощью реакции натриевой соли диэтилового эфира малоновой кислоты с 1,3-дибромпропаном в 1900 году. В 1901 г. Фишер получил L-пролин и D,L-пролин из гидролизатов казеина и показал, что второй продукт идентичен синтетическому пролину, который он приготовил из фталимидопропилмалонового эфира [2].
3D изображение в шариково-стержневой модели
Основные физико-химические свойства
| Таблица 1. Физико-химические свойства [1], [3] | |
| Название по IUPAC | (2S)-pyrrolidine-2-carboxylic acid |
| Брутто-формула | C₅H₉NO₂ |
| Молярная масса | 115.13046 г/моль |
| Идентификатор в базе данных PubChem | 145742 |
| pKa1 при 25 °С | 1.99 (-COOH) |
| pKa2 при 25 °С | 10.60 (-NH-) |
| pI при 25 °С | 6.295 |
| Кодируется кодонами | CCU, CCC, CCA, CCG |
| Т. плавления L-пролина | 220-222°C |
| Т. плавления D-пролина | 215-220°C |
| Т. плавления D,L-пролина | 205 °С |
| Расстворимость в воде | 162.3 г в 100 мл при 25 °С |
| Расстворимость в этаноле | 1.55 г в 100 мл при 25 °С |
| Плохо растворим | в этаноле, ацетоне, хлороформе, бензоле |
| Не растворим | в диэтиловом эфире |
| Посмотреть спектр ЯМР | ЯМР |
Информация о белок-белковых контактах
| Таблица 2. Белок-белковые контакты | |
| Тип контакта | Нет/есть/с какими аминокислотами взаимодействует |
| Ковалентные связи | Со всеми аминокислотами, образуя остов белковой молекулы |
| Водородные связи | В спиралях атом O из Pro связывается с остовными атомами N в Mse (селенометионине), Ala, Glu, Ser и др. |
| Солевые мостики | Не образует |
| Гидрофобные ядра | С гидрофобными аминокислотами Phe, Ile, Leu, Val |
В таблице 2 приведены результаты исследования взаимодействий пролина с другими аминокислотами белка. Так как у молекулы незаряженный гидрофобный радикал, то образовывать водородные связи она способна только при участии -COOH группы, -NH- группа сильно экранирована и стерически не доступна для взаимодейстий. Ковалентные связи образуются с помощью -COOH и -NH- групп, в результате чего формируется остов и первичная структура белка. А радикал может вступать лишь в гидрофобные взаимодействия.