Визуализация электронной плотности кристалла белка пероксидазы хрена (HRP)
Выбранный белок
В качестве объекта для изучения элетронной плотности белковых кристаллов я выбрала пероксидазу хрена (Horseradish Peroxidase, HRP, EC: 1.11.1.7), так как это сравнительно небольшой белок (всего лишь 38.825 кДа), выполняющий, однако, такую важную функцию, как катализ превращения молекулы пероксида водорода в молекулу воды. Данный процесс сопрвождается окислением ароматического соединения, содержащего два фенольных кольца, что позволяет нейтрализовывать многие токсичные восстановители. Но в еще большей степени пероксидаза хрена интересна своим широким применением в биоинженерии в качестве маркера. Так, для анализа белковых полиакриламидных гелей по методу Вестерн-блота в качестве вторичных антител преимущественно используют конъюгаты с HRP, которая катализируя окисление молекул люминола в присутствии перекиси, способствует испусканию света. Также при изучении клеточных структур на уровне световой и электронной микроскопии часто применяется другой субстрат для пероксидазы: 3,3'-диаминобензидин (DAB), который в окисленном состоянии локально полимеризуется и выпадает в виде тёмно-коречневого электронно-плотного осадка.
Электронная плотность вокруг остова
Для знакомства с электронной плотностью кристалла HRP я на сайте PDBe выбрала выбрала структуру (1KZM) с разрешением 2 Å. Ниже представлены изображения электронной плотности вокруг остова полипептидной цепи
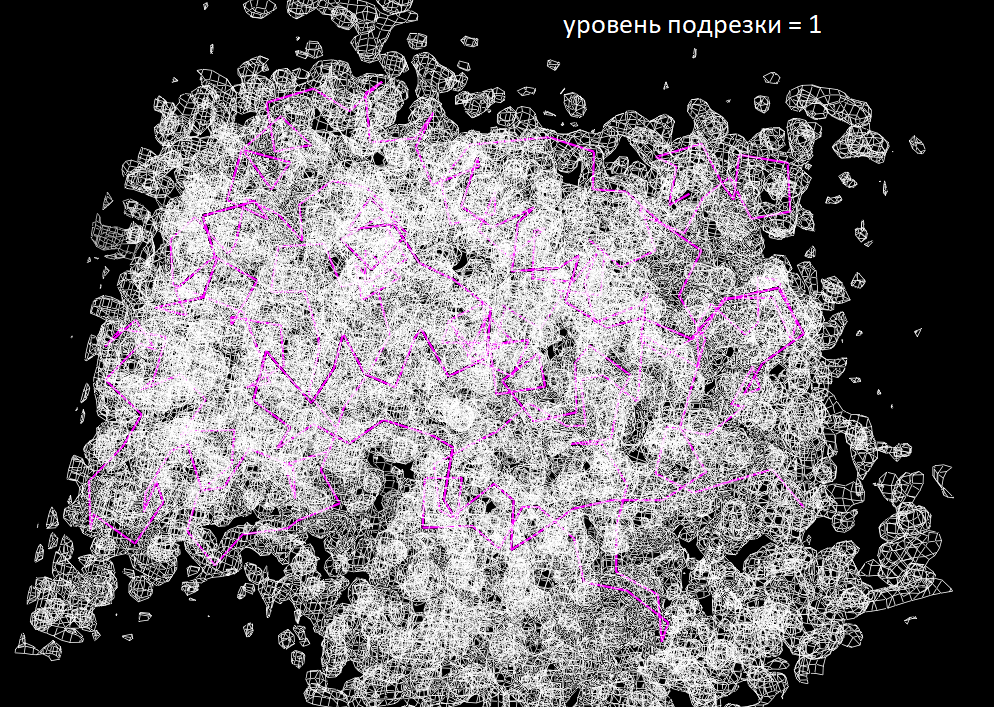
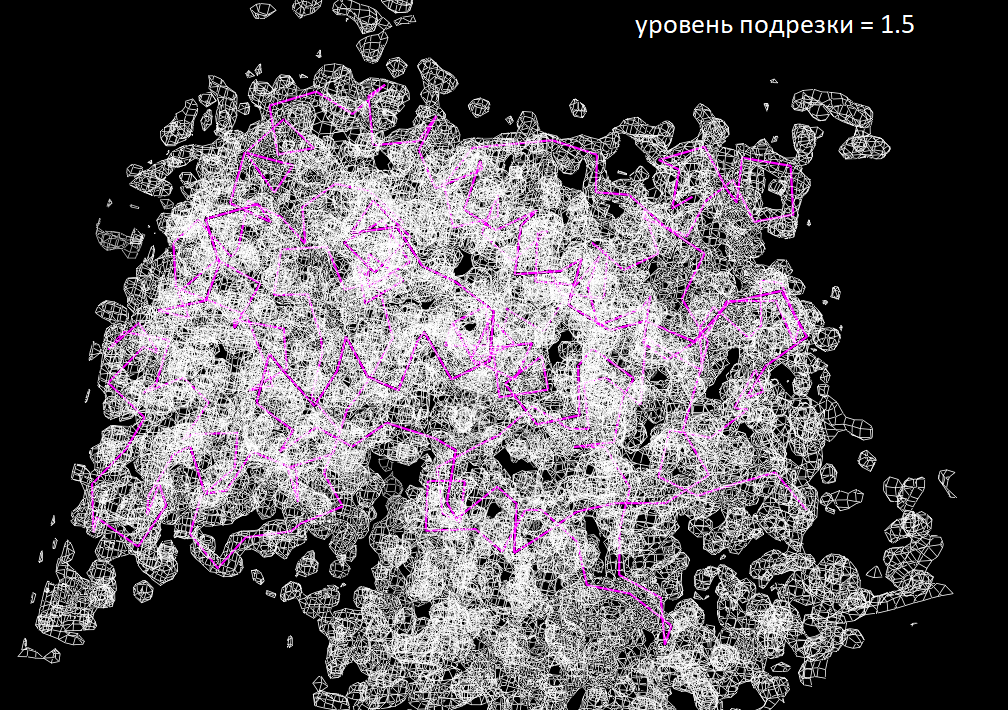
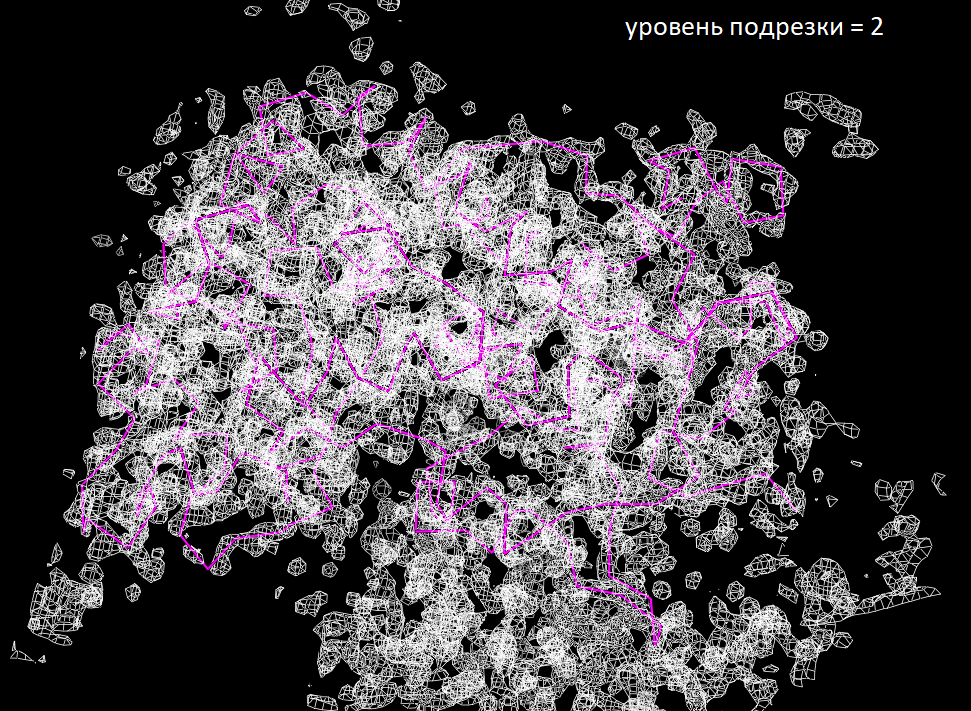



Из изображений видно, что на уровне подрезки 2 все атомы остова еще более-менее вписаны в сетку электронной плотности, когда на уровне 2.5 уже появляются отдельные "невидимые" атомы.
Электронная плотность вокруг аминокислотных остатков
Далее я выбрала 3 аминокислотных остатка и визуализировала электронную плотность вокруг них при значениях уровня подрезки 1.5, 2 и 2.5. Ниже представлены полученные изображения для остатков Trp 117, Lys 149 и Ala 90.
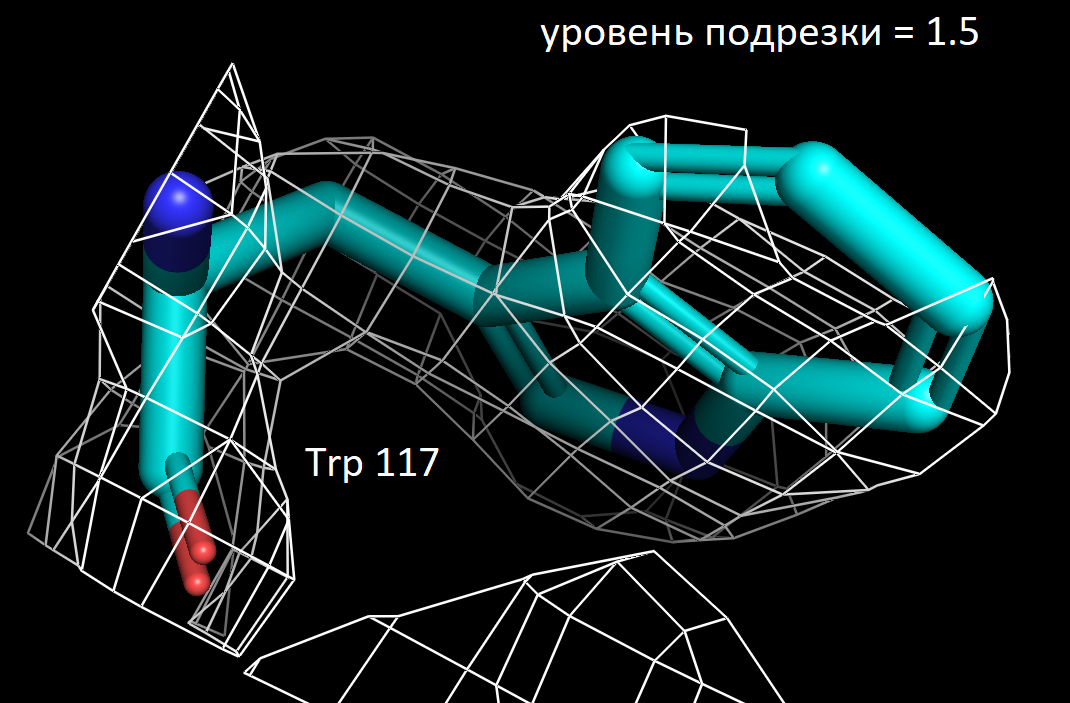
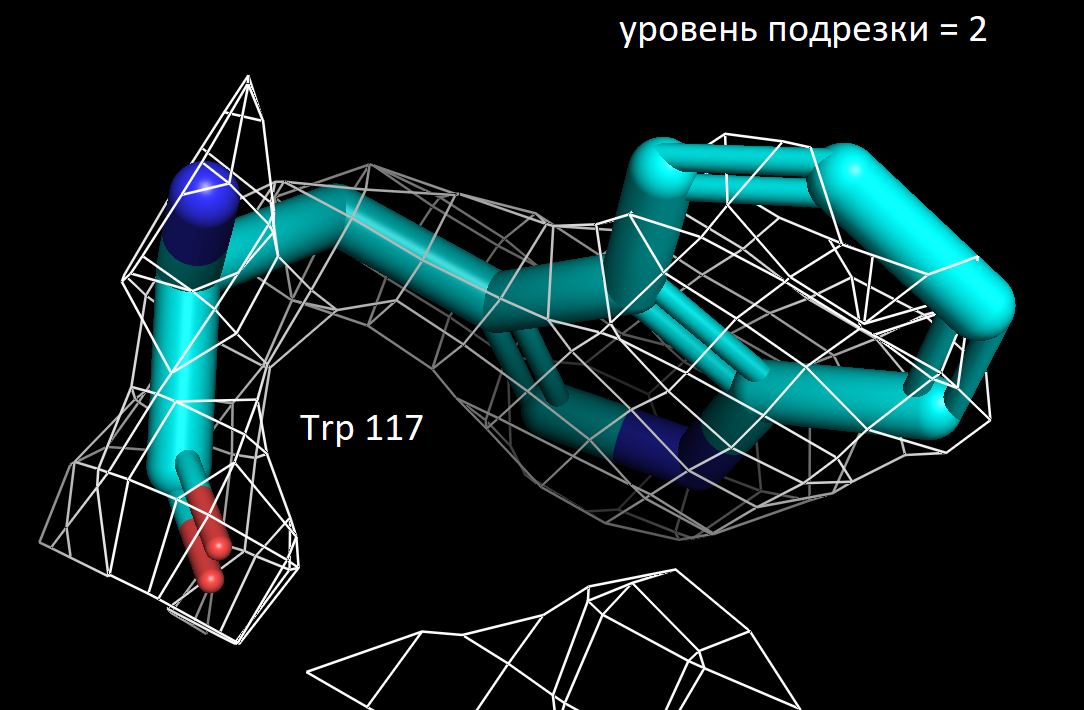
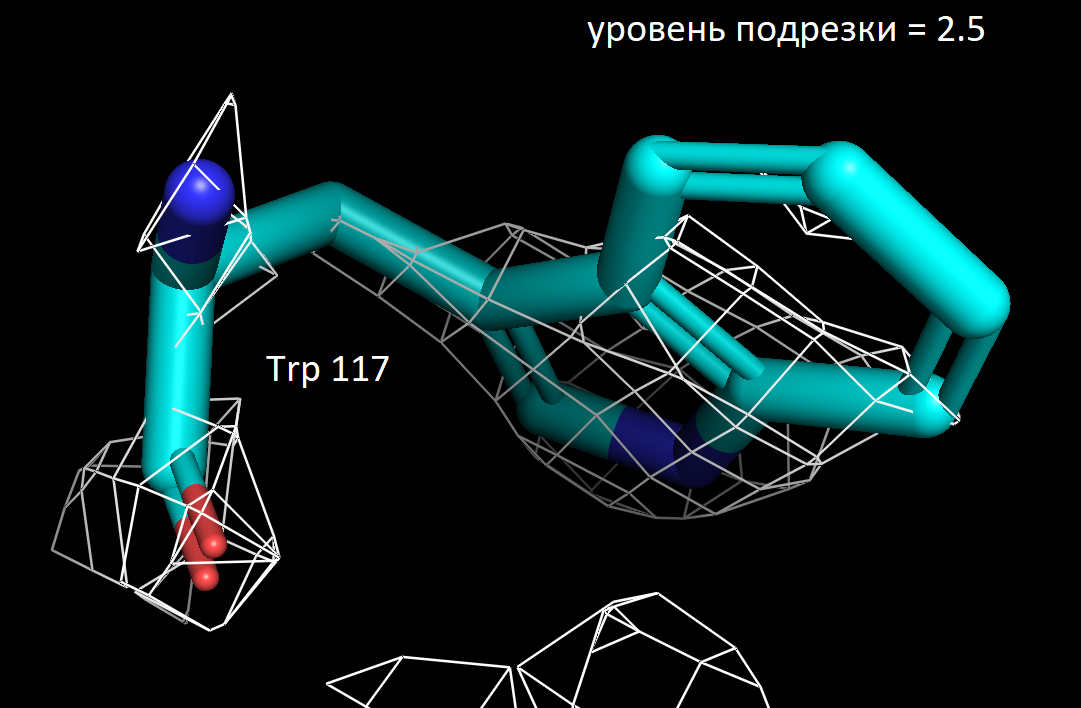

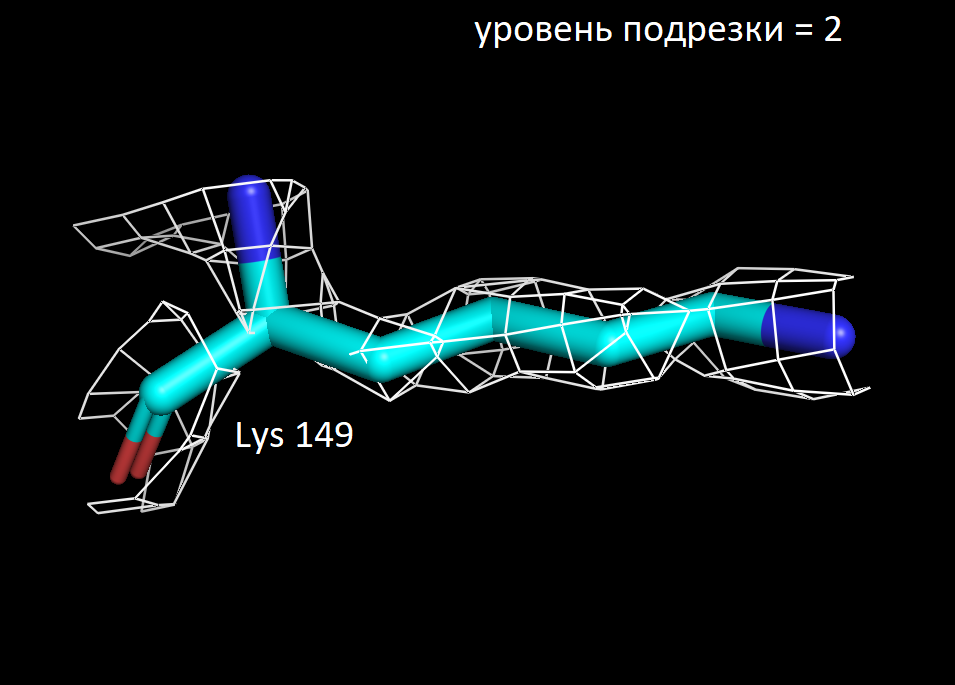
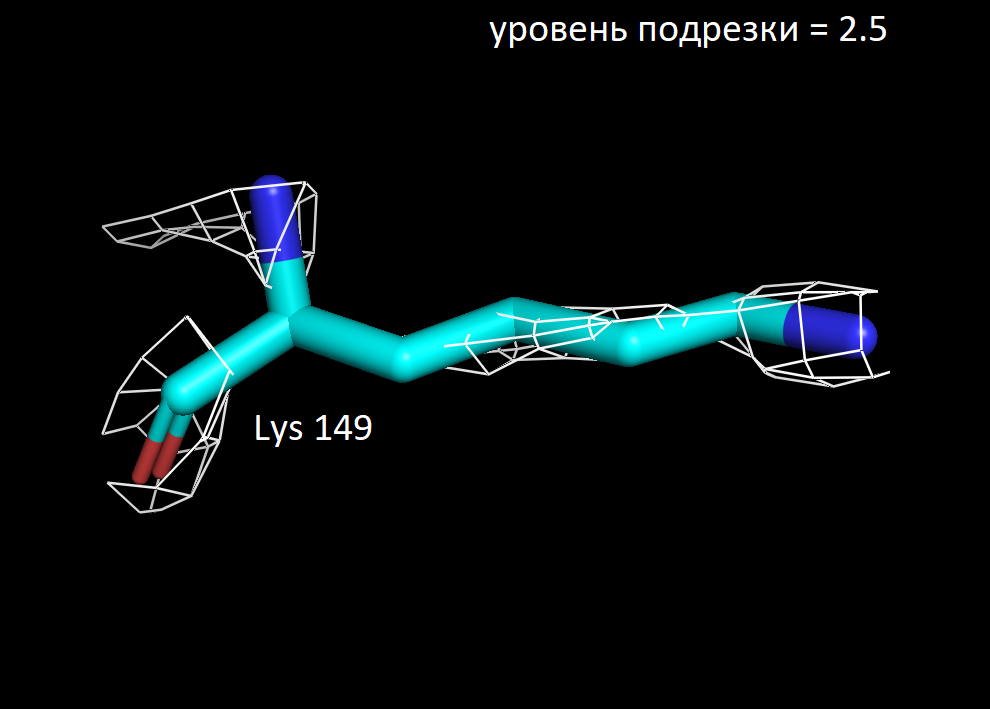
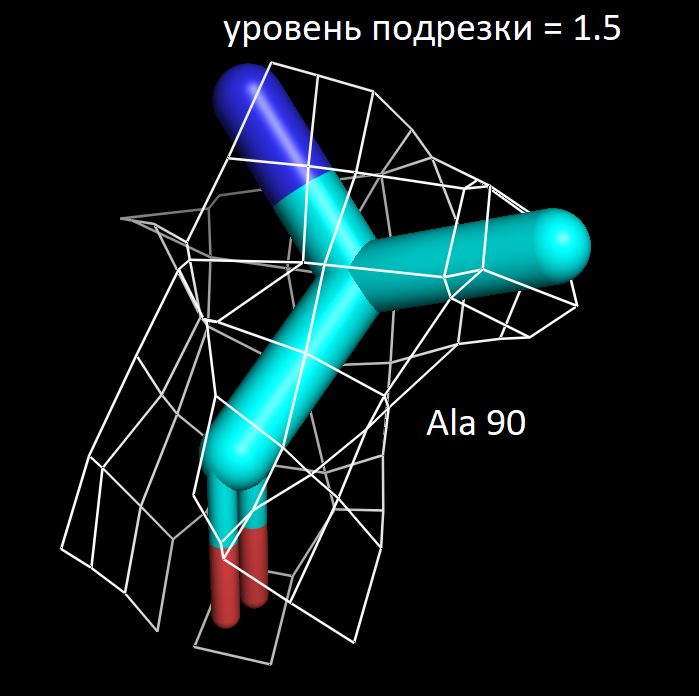
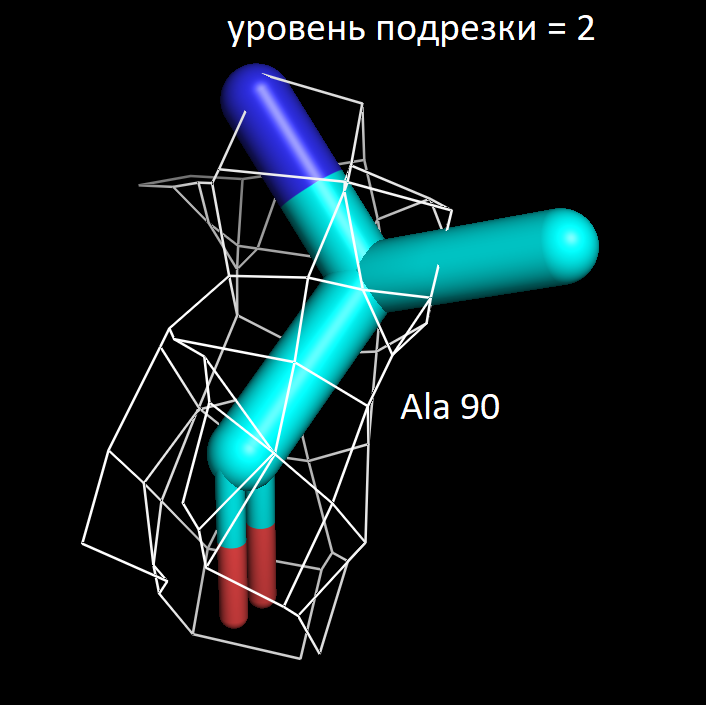
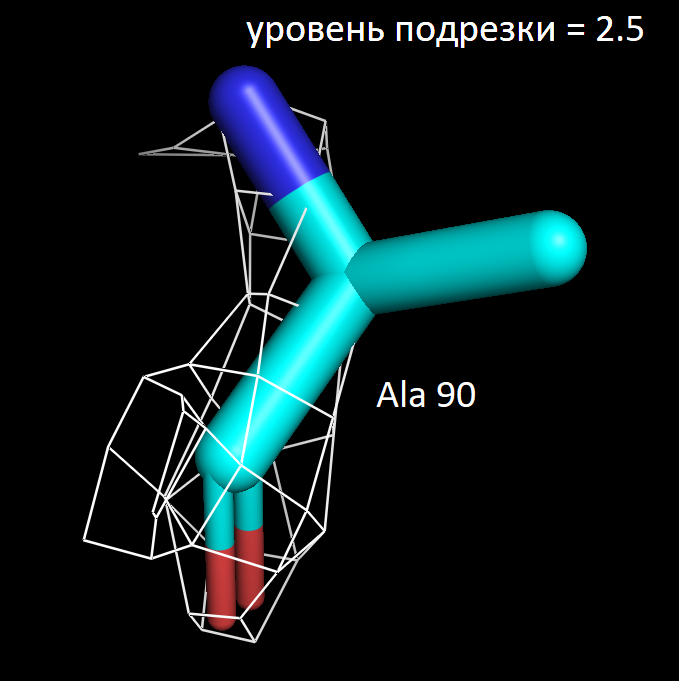
Более детальное рассмотрение на примере выбранных мною аминокислотных остатков показало в целом ту же закономерность. На уровне подрезки 2 сетка электронной плотности обтекает преимущественное число атомов, а на уровне 2.5 многие атомы углерода не визуализируются. Интересно отметить, что в остатке триптофана даже на уровне подрезки 2.5 атомы углерода при кратных ароматических связях в пятичленном кольце остаются детектируемыми. Что хорошо коррелирует с представлениями о том, что атомы в sp2 гибридном состоянии более электроотрицательны, чем их аналоги в sp3 гибридном состоянии. Также стоит отметить, что на всех трех представленных уровнях подрезки, четко выражены атомы азота (отмечены синим цветом на картинках) и кислорода (отмечены красным цветом на картинках). Так как они содержат по 7 и 8 электронов в электронных оболочках атомов соответственно и в добавок являются более электроотрицательными, по сравнению с углеродом. Поэтому большинство ошибок в определении структуры белка связано именно с положением боковых цепей, где не всегда четко удается установить соответствие. В частности, атомы кислорода и азота дают схожее распределение электронной плотности, из-за чего возникает неоднозначность с остатками аспарагина и глутамина. Помимо этого, простые гидрофобные остатки, как аланин, лейцин, валин, возможно детерминировать только при низком уровне подрезки, порядка 1.5. С другой стороны, регулярное чередование атомов кислорода и азота в остове полипептидной цепи позволяет, как правило, достоверно разрешить ее вторичную структуру в правильно закристаллизованных образцах.