Восстановление кристалла из PDB файла
Взаимодействие белков из соседних ячеек
Сперва приведем кристаллографические характеристики выбранной в предыдущем практикуме структуры 1KZM. В поле CRYST1 из файла pdb1kzm.ent, который можно скачать со страницы структуры, указаны следующие параметры:
- длины направляющих векторов кристалла: a = 40.4 Å, b = 66.7 Å, c = 117.1 Å;
- углы между векторами: α = 90.0, β = 90.0, γ = 90.0;
- кристаллографическая группа: P 21 21 21, что означает примитивную группу с тремя осями винтовой симметрии 21 (поворот на 1/2 периода, 180 градусов);
- число молекул в ячейке = 4.
Далее с помощью команды
symexp sym, 1kzm, 1kzm, 100
в PyMOL были визуализированы соседние образы, находящиеся не далее, чем на 100 Å от структуры 1kzm. При восстановлении этих образов за основу берутся матрица вращения и вектор трансляции. Ниже представлены полученные изображения. Красным цветом выделен белок, относительно которого строились образы, и кристаллическая ячейка с подписанными направляющими векторами. Другими цветами помечены группы структур имеющие одинаковое расположение в пространстве. Видно, что таких групп ровно 4.
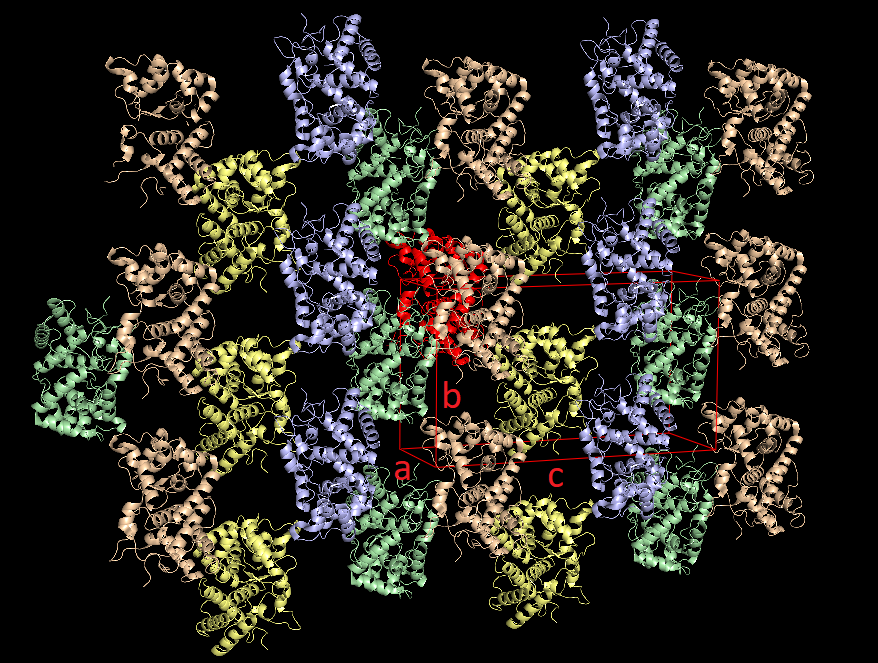
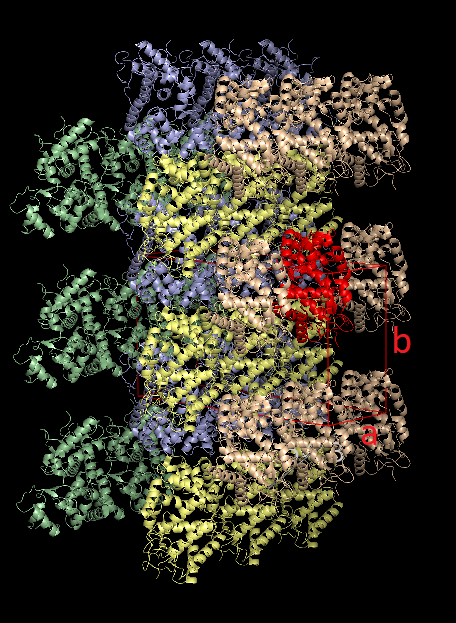
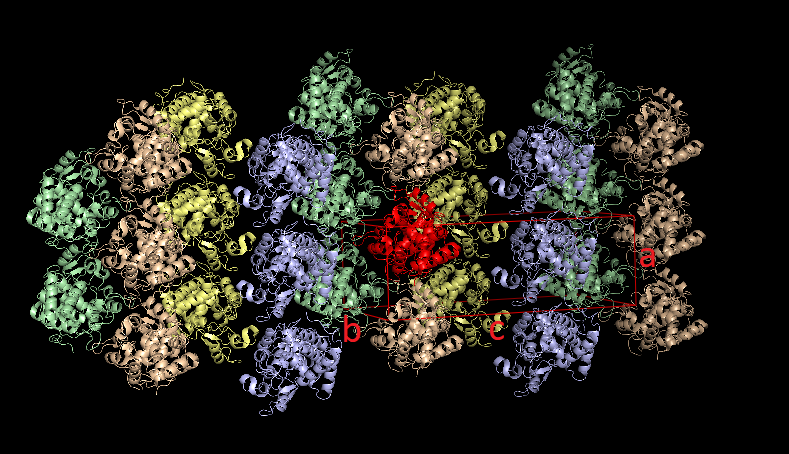
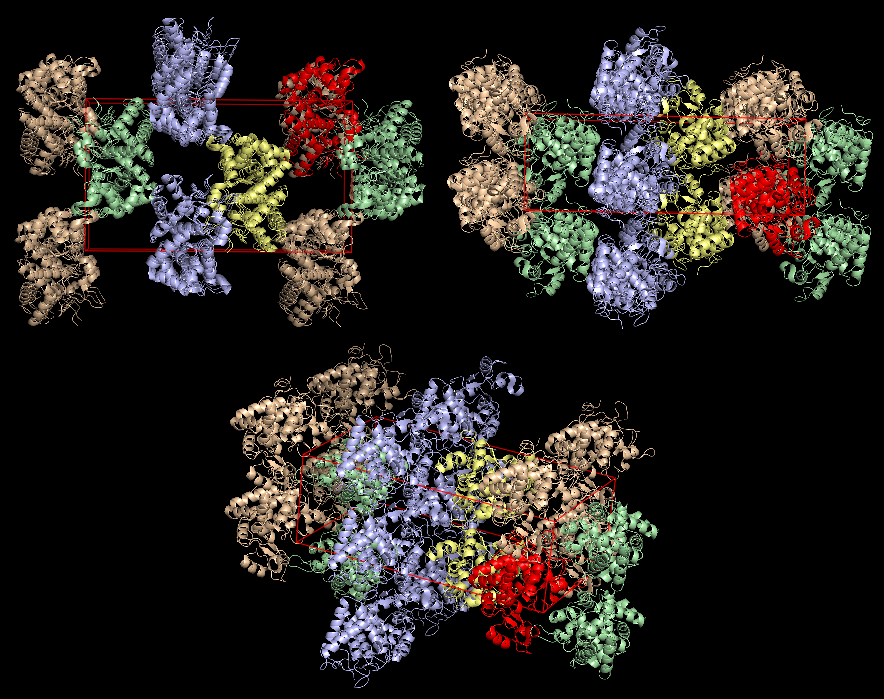
При детальном рассмотрении оказывается, что в элементарная кристаллическая ячейка образована частями 20 индивидульных молекул белков, каждый из которых одновременно лежит как минимум в двух соседних ячейках (см. последнюю картинку из четырех выше), поэтому в данном случае будет корректнее исследовать взаимодействие одного белка с соседями.
Пероксидаза хрена, структура которой здесь рассматривается, является мономером. Поэтому все обнаруженные зоны контакта между белками можно считать артефактами кристаллизации, никак не отражающими природные взаимодействия в клетках. С помощью следующих команд в PyMOL были визуализированы водородные связи между ближайшими соседями в кристалле (молекулы воды при этом не учитывались):
remove resn hoh select set_a, 1kzm and name n*+o* select set_b, sym<номер соседа> and name n*+o* select set1, byres (set_a and (set_b around 3.5)) select set2, byres (set_b and (set_a around 3.5)) show sticks, set1 show sticks, set2 distance hbonds, set1 and set_a, set2 and set_b, 3.5
В качестве критерия водородной связи брали расстояние не более 3.5 Å между полярными атомами белков. Всего было обнаружено 5 разных зон контакта между соседними белками. Ниже приведены их изображения относительно исходной структуры 1KZM (окрашена в lightpink).
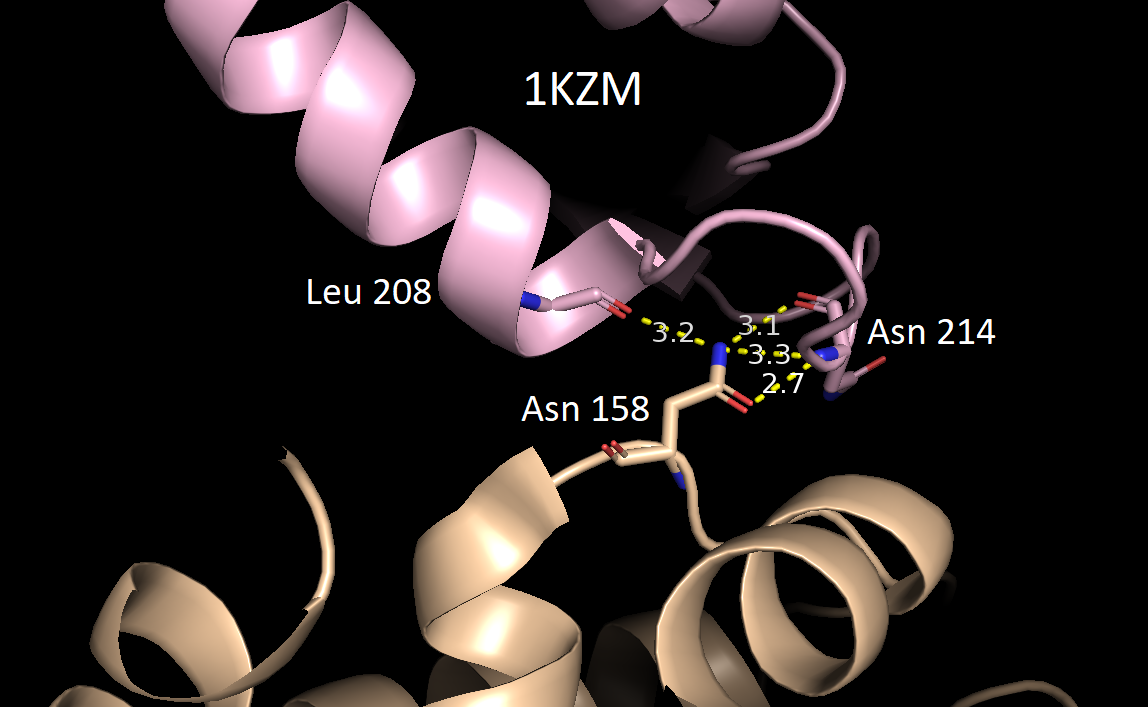
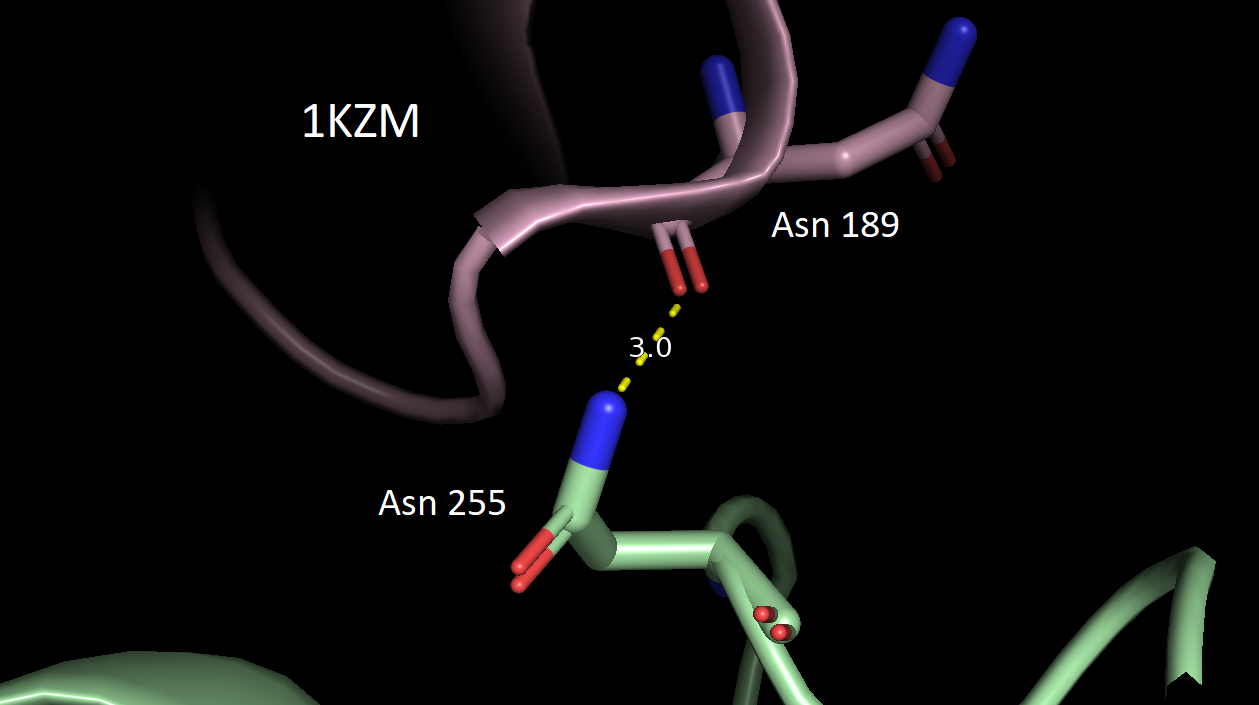
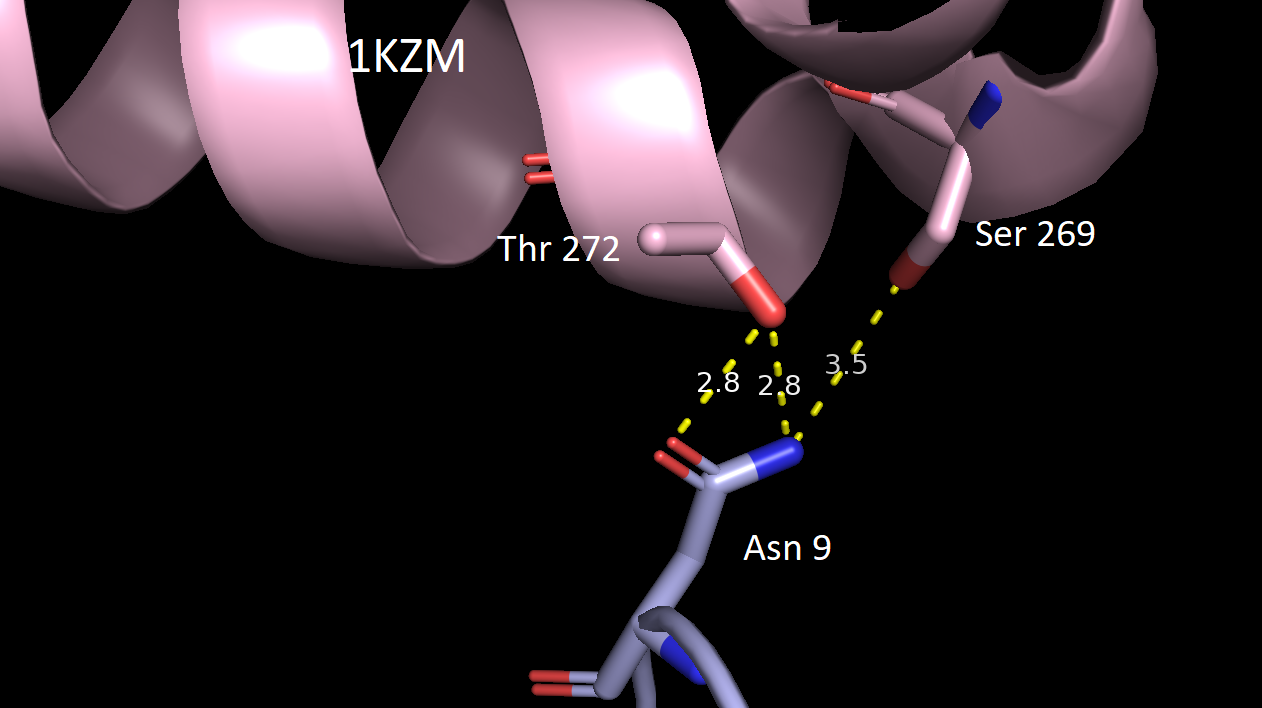
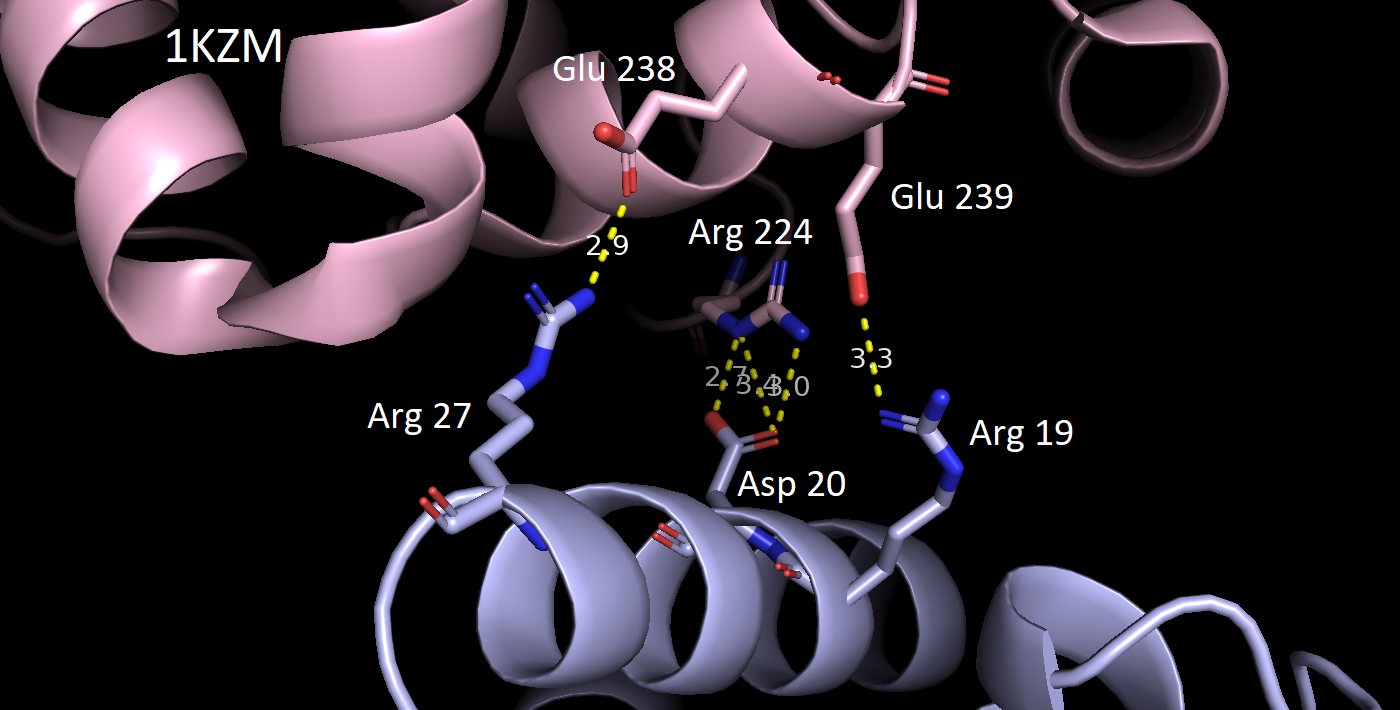
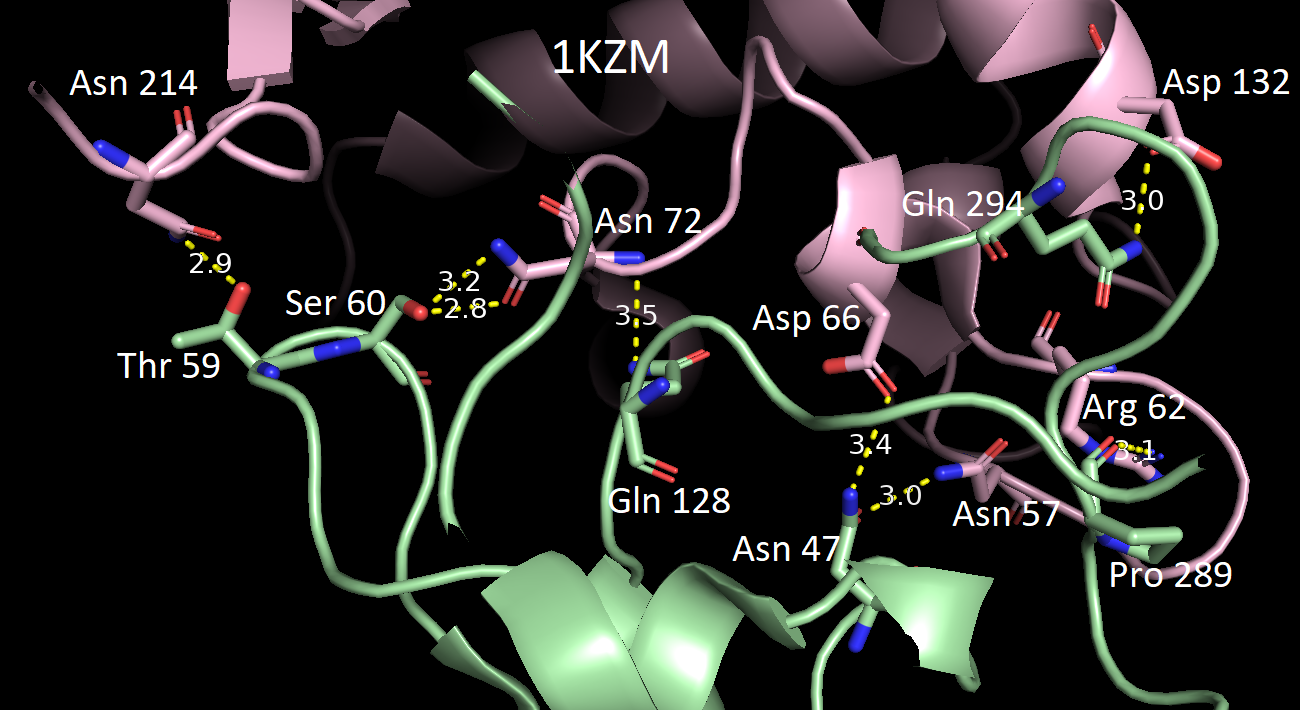
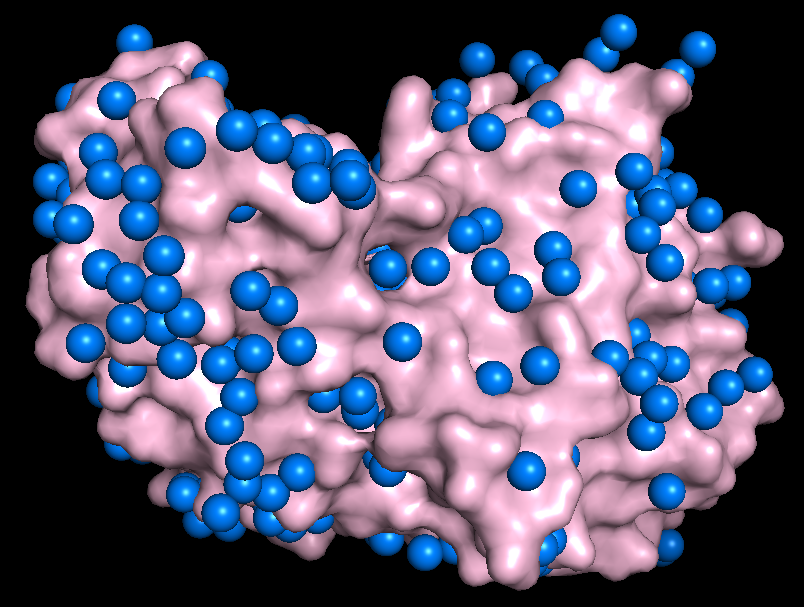
За исключением последней картинки, наблюдаем небольшое число водородных связей в зонах контакта. Скорее всего, все представленные водородные связи не имеют биологического смысла и являются артефактом кристаллизации. Кроме того, заметим, что во всех случаях наружу экспонированы преимущественно полярные аминокислотные остатки, что позволяет сделать вывод о том, что гидрофобные взаимодейсвия тоже вряд ли могли бы способствовать ди- или олигомеризации. Это же подтверждает и экранирование поверхности белка молекулами волы (синие шарики) в кристалле.
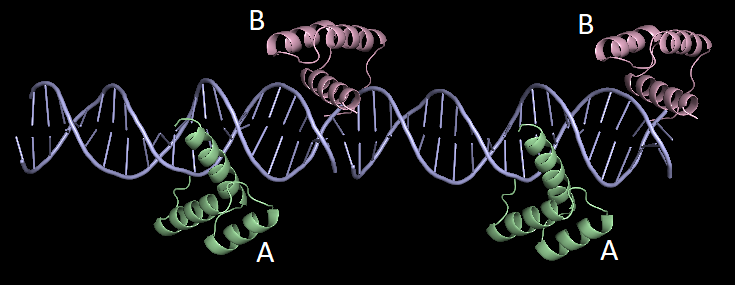
Пример странного расположения белковых цепей в структуре ДНК-белкового комплекса
Чтобы продемонстрировать, что порой для получения разумной картины необходимо визуализировать соседние образы, я выбрала структуру 3HDD. Она представляет из себя часть двухцепочечной ДНК, связанной с двумя полипептидными цепями, выполняющими в клетке роль регуляции транскрипции. Странным в приведенной структуре кажется то, что белковая цепь В (окрашенная в lightpink) находится как бы на краю ДНК.
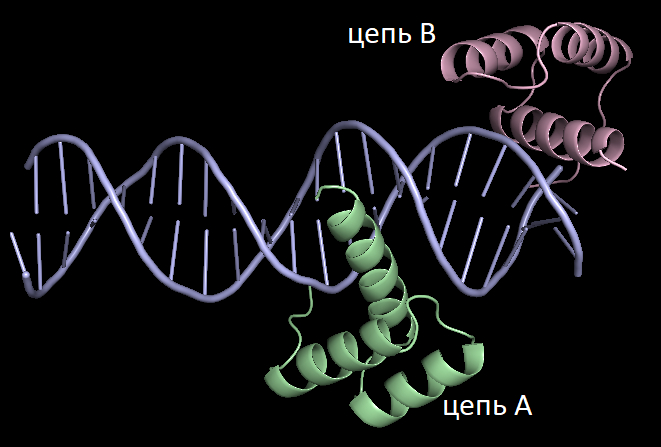
Однако после восстановления соседнего образа становится очевидным, что на самом деле белковая цепь В взаимодействует с двухцепочечной ДНК не только из своей, но и из соседней ячейки. Но тут стоит отметить, что восстановленная цепь ДНК в первом приближении прерывается на стыке. На практике это лишь артефакт отображения, и нуклеотиды, находящиеся на стыке, образуют единую цепь ДНК.
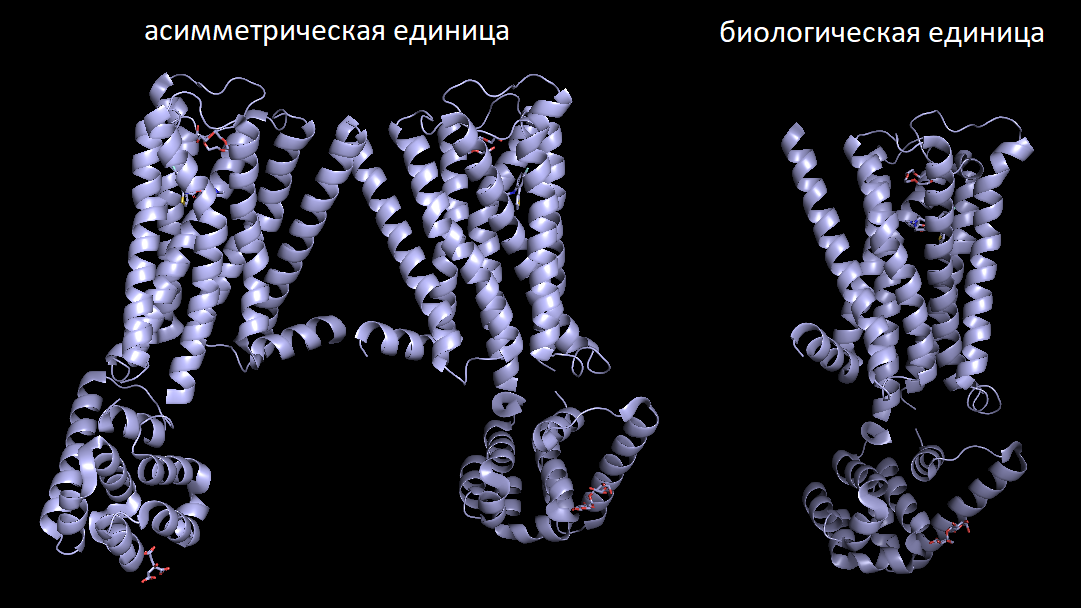
Примеры несовпадения асимметрической и биологической единиц
Сперва объясним, в чем разница между этими двумя понятиями. Асимметрическая ячейка - минимальная часть кристалла, из которой можно восстановить весь кристалл с помощью только кристаллографических симметрий (поворот и сдвиг). Когда биологическая единица отражает то, в какой форме белок функционирует в клетках.
Примером, когда асимметрическая единица представлена мономером (слева на картинке), а биологическая единица - димер (справа на картинке), является структура кинезина-3 6A1Z.
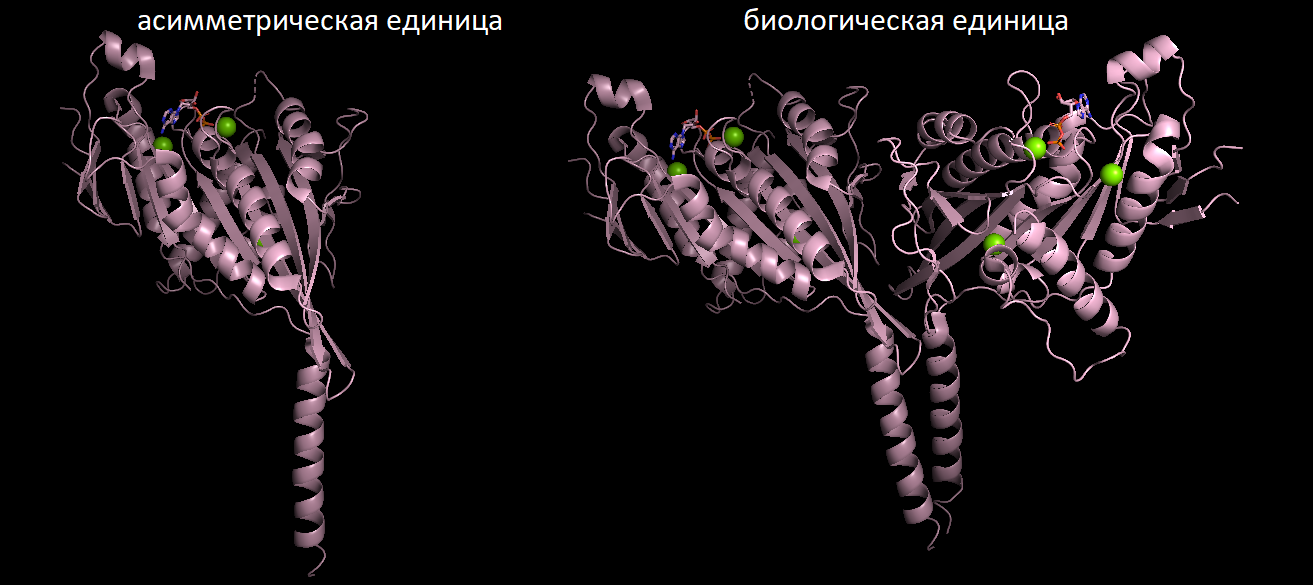
Примером, когда асимметрическая единица представлена димором (слева на картинке), а биологическая единица - мономер (справа на картинке), является структура M3 мускаринового ацетилхолинового рецептора 5ZHP.