Сравнение структур белка, расшифрованных с помощью ЯМР и PCA
Выбор объекта изучения
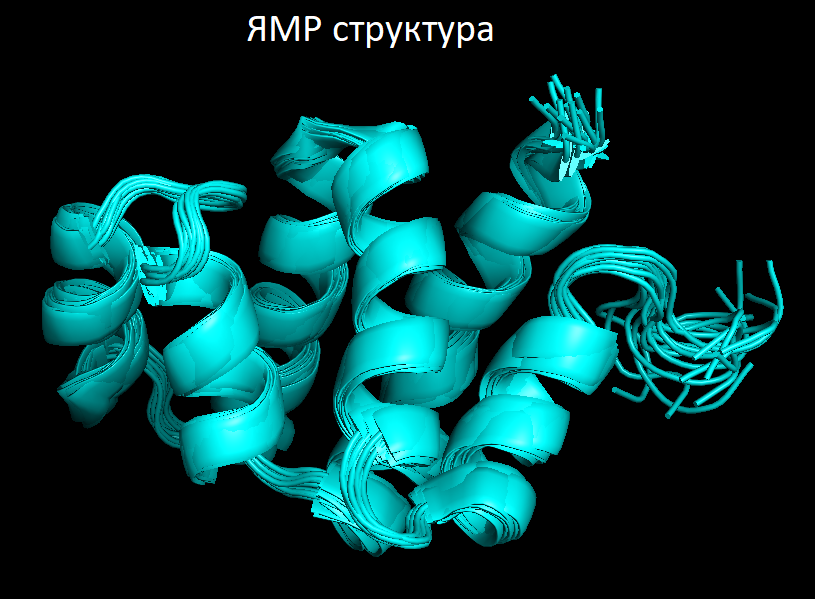
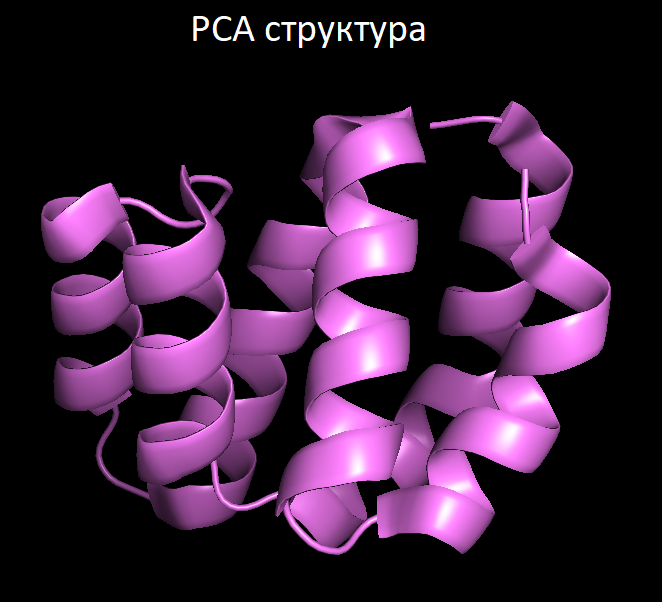
Для данной работы я остановила свой выбор на домене CARD белка Apaf-1, запускающего клеточный апоптоз. Соответственно я скачала PDB файлы со структурами, расшифрованными с помощью ЯМР (1C15) и PCA (1CY5). При этом разрешение PCA у структуры составляет 1.3 Å, а структура ЯМР представлена 16 конформерами. Ниже представлены изображения этих структур.
Далее я с помощью PyMOL совместила обе структуры в пространстве. Ниже представлены получившиеся структурные выравнивания (слева - одна модель ЯМР, а справа - все 16), на которых заметно, что все элементы вторичной структуры расположены сходным образом, однако точного совпадения нет.
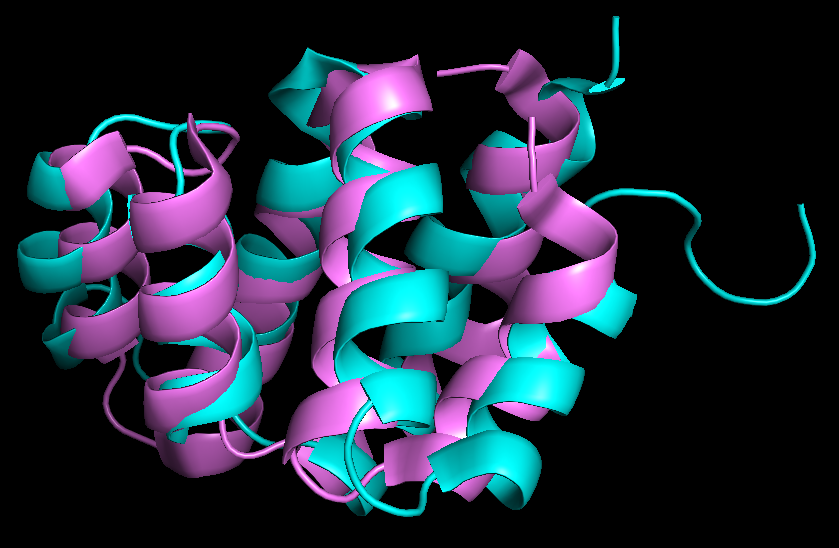
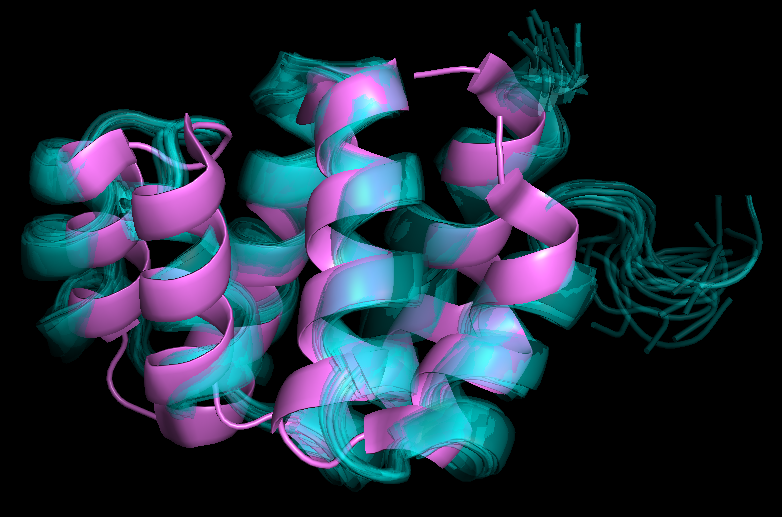
Интересно, что при кристаллизации белок становится чуть более компактным, поэтому в таком случае для каких-то точных раясчетов я бы больше доверяла ЯМР структуре, так как она отображает состояние белка в растворе, следовательно отсутствуют артефакты кристаллизации.
Выбор и анализ водородных связей в структурах
Будем считать, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3.5 Å. Помимо этого, воображаемый водород должен быть на линии донор-акцептор или отклоняться от этой линии не более чем на 70 градусов. Сперва для анализа я выбрала три водородные связи по PCA структуре:
- остовную водородную связь в α-спирали;
- водородную связь боковых цепей;
- водородную связь в петлях, выходящих на поверхность глобулы.
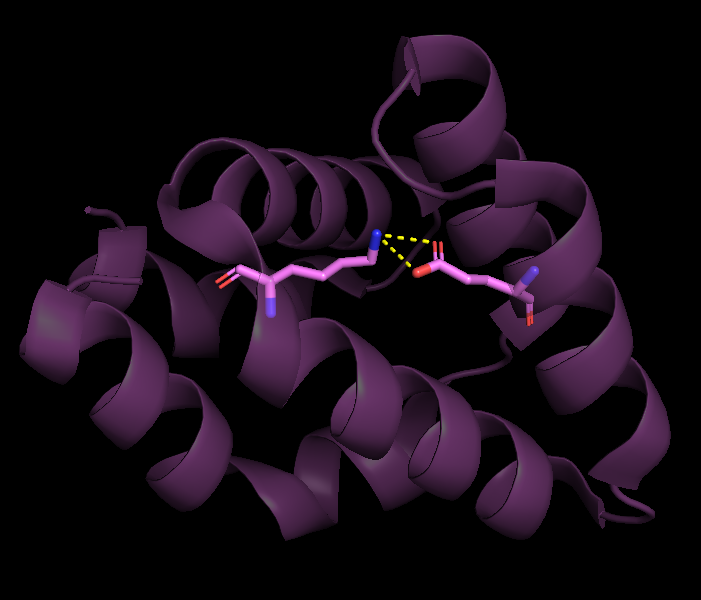
Водородных связей между боковыми цепями остатков не оказалось внутри ядра (что отчасти объясняет лабильность α-спиралей относительно друг друга при сравнении PCA и ЯМР структур), поэтому я выбрала связь между боковыми цепями, экспонированными наружу белковой глобулы. Ниже приведены их изображения и таблица сравнения этих же связей в структурах ЯМР.
| Таблица 1. Сравнение водородных связей в структурах PCA и ЯМР | ||||||
| Остатки (донор - акцептор) |
Расположение | Расстояние между донором и акцептором (PCA) |
Число моделей с данной связью (ЯМР) |
Min расстояние (ЯМР) |
Max расстояние (ЯМР) |
Медиана расстояний (ЯМР) |
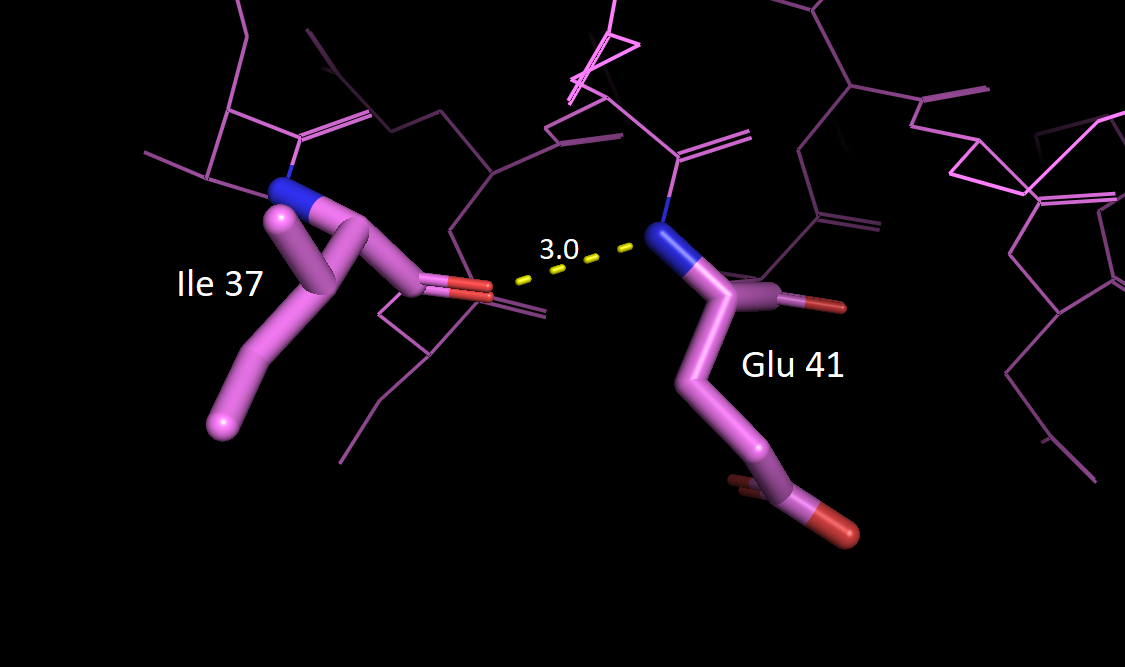
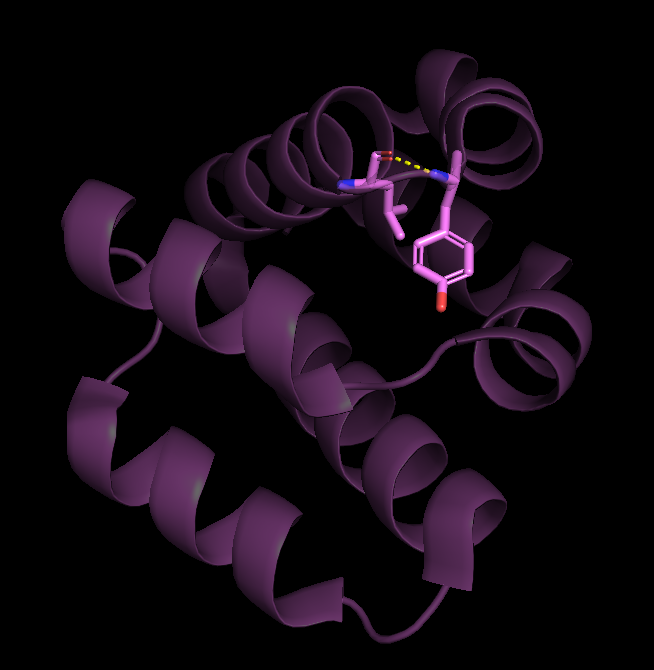
| Glu 41 - Ile 37 (N - O) |
α-спираль, поверхность глобулы |
3.0 Å | 6 (37.5 %) | 3.2 Å | 3.4 Å | 3.3 Å |
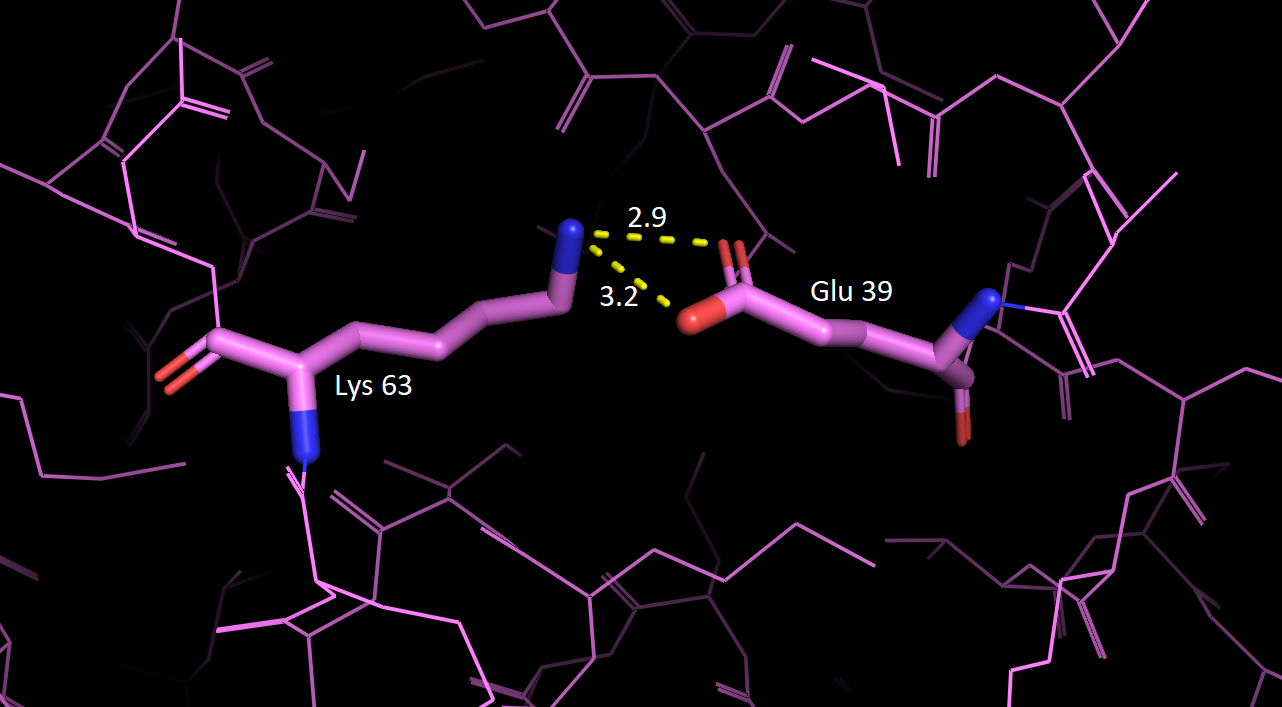
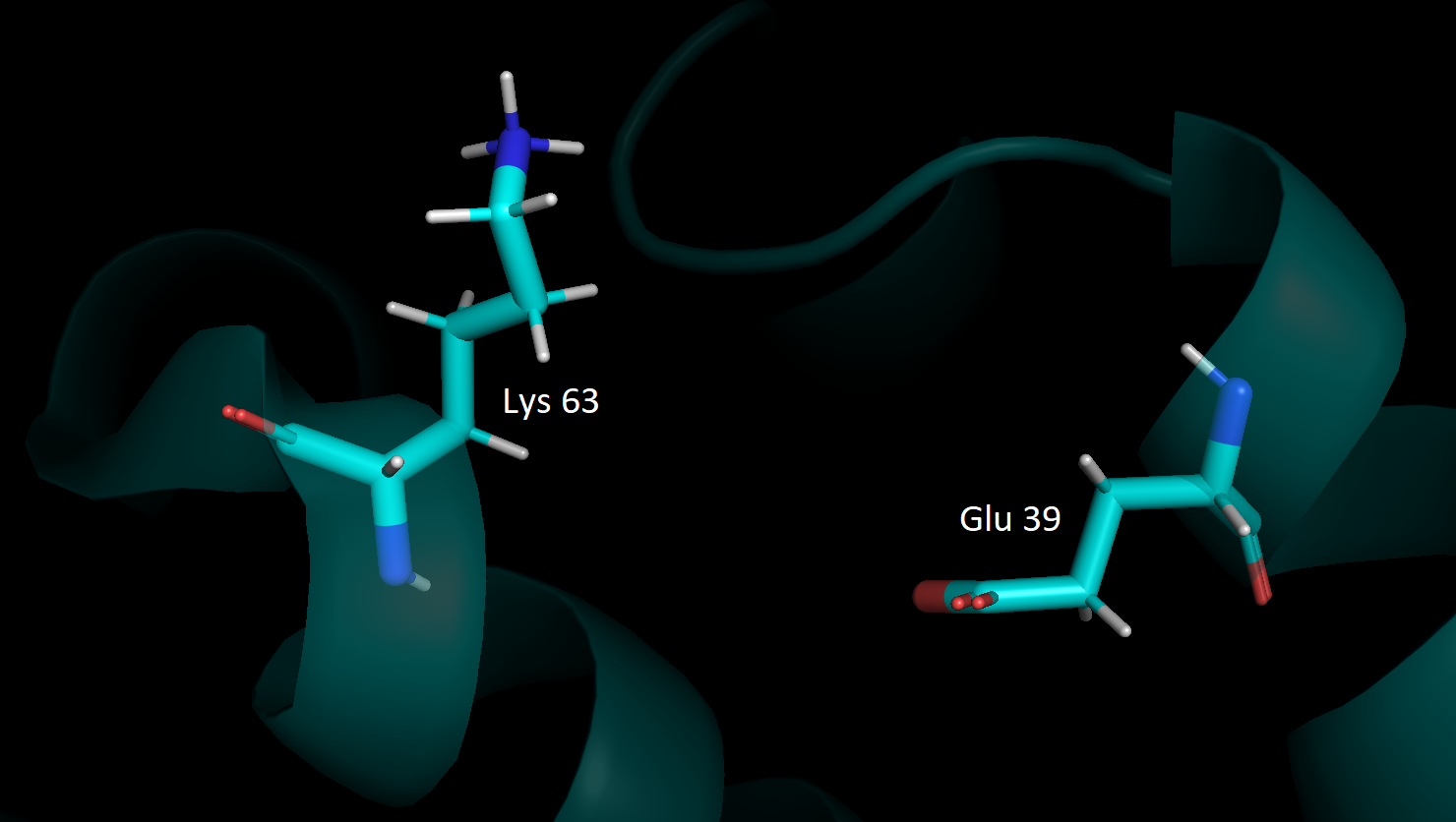
| Lys 63 - Glu 39 (NZ - OE1) (NZ - OE2) |
две соседние α-спирали, поверхность глобулы |
2.9 Å 3.2 Å |
0 (0 %) | - | - | - |
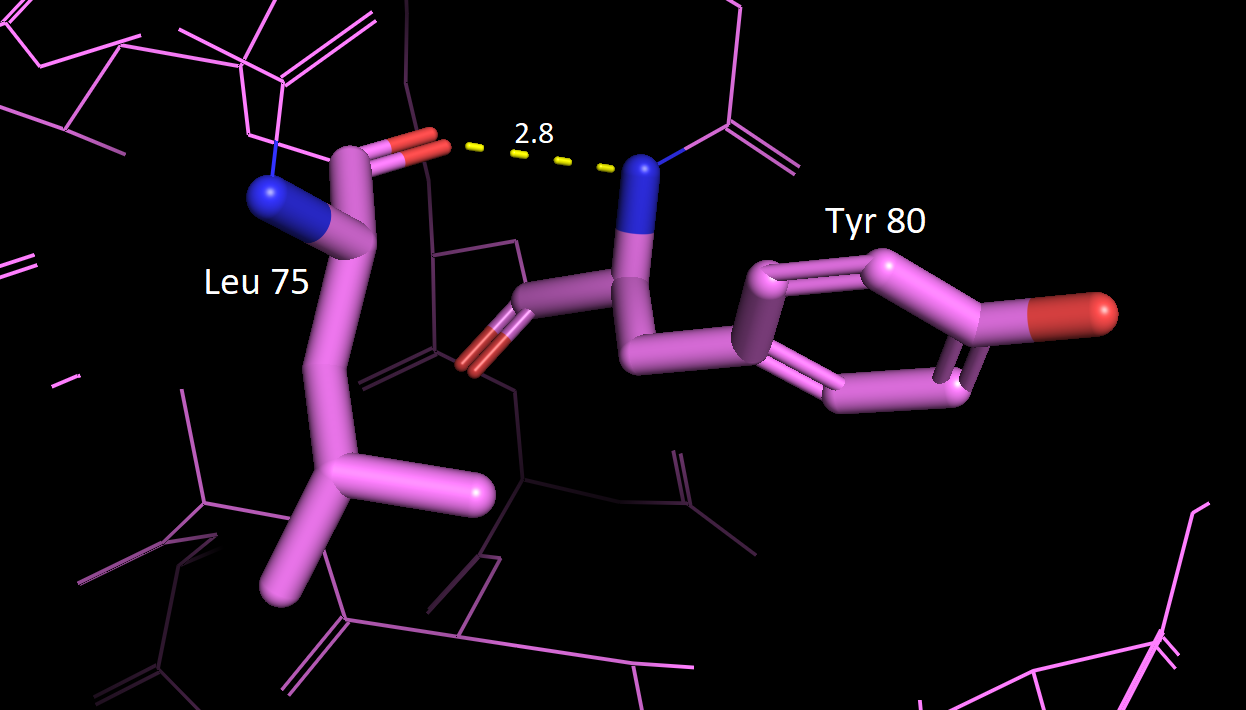
| Tyr 80 - Leu 75 (N - O) |
петля и α-спираль, поверхность глобулы |
2.8 Å | 11 (68.75 %) | 3.1 Å | 3.4 Å | 3.3 Å |
Оказалось, что ни одна связь не присутствует во всех 16 моделях ЯМР. Очень странным кажется, что остовная связь в α-спирали была выявлена лишь в 37.5 % случаев. Оказывается, что в остальных структурах Ile 37 образует связь с Glu 40 с расстоянием между донором и акцептором 2.9 Å, когда расстояние в связи Glu 41 - Ile 37 составляет 3.8 Å. Это немного странно, так как по канонам укладки α-спиралей связь должна быть именно между Glu 41 и Ile 37. Могу предположить, что так как α-спирали в исследуемом белке небольшие, то в растворе они обладают такой вот своеобразной подвижностью. Что касается второй водородной связи, то скорее всего она является артефактом кристаллизации и не существует в нативных условиях. На следующей картинке видно, что полярные боковые группы Lys 63 и Glu 39 не контакритуют в ЯМР структуре.
А третья водородная связь наоборот оказалась весьма значимой и скорее всего она отвечает за правильное сворачивание белка в третичную структуру.