Гидрофобные кластеры
Поиск гидрофобных кластеров в структуре белка HRP
С помощью сервиса CluD производился поиск гидрофобных кластеров в структуре белка пероксидазы хрена (PDB ID = 1KZM). Сперва программа была запущена с теми параметрами, которые стоят по умолчанию. В результате было найдено 8 кластеров, 7 из которых содержали не больше 10 атомов, а один кластер (отмечен желтым) включал в себя атомы, равномерно распределенные по всей структуре белка. Ниже приведено изображение найденных гидрофобных кластеров (синий, белый, желтый и зелёный цвета), красным цветом выделен гем, образующий активный центр фермента, розовым - представлена структура белка в виде cartoon.
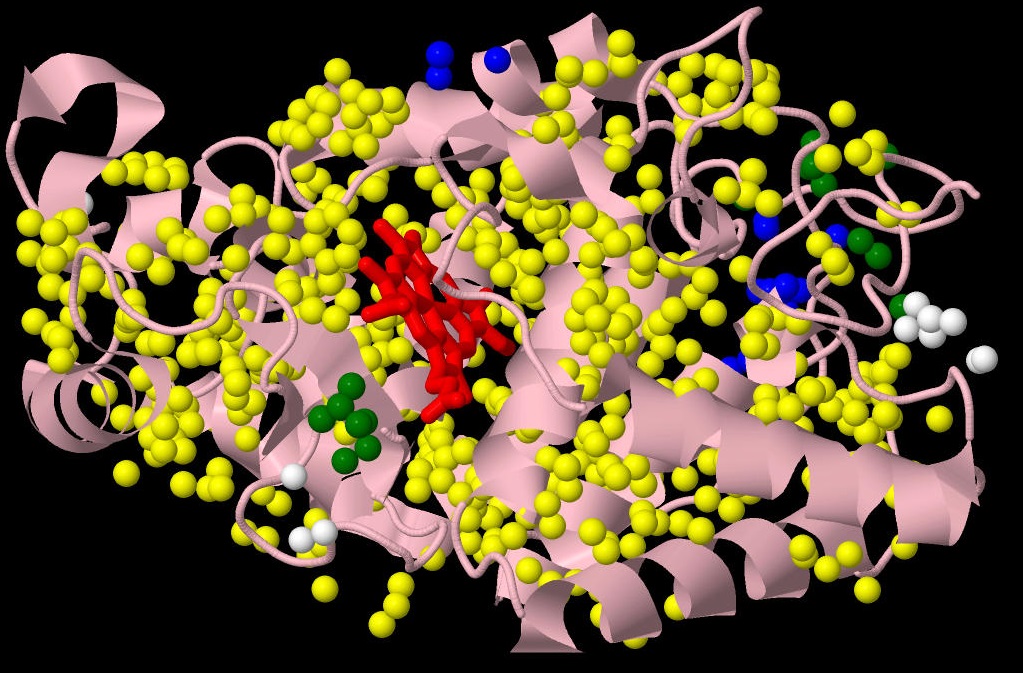
Видно, что гидрофобные атомы занимают все внутреннее пространство белка, за исключением активного центра и областей связывания ионов кальция, необходимых для правильного функционирования белка. Однако такое разбиение на кластеры не позволяет выделить функционально значимые участки. Хотелось бы обнаружить небольшие области плотного скопления гидрофобных атомов. Тогда было решено изменить параметр "Distance threshold" с 5.4 Å до 4.0 Å. (Я также пыталась увеличить порог размера кластера, но программа все равно выдавала мне полный набор кластеров вплоть до самых маленьких, размером в 3 атома). В результате было найдено 35 кластеров, из которых я отобрала те, в которых было не меньше 7 атомов из как минимум 4 аминокислотных остатков. Ниже представлено их распределение (у каждого кластера индивидуальный цвет) на фоне общей структуры белка.
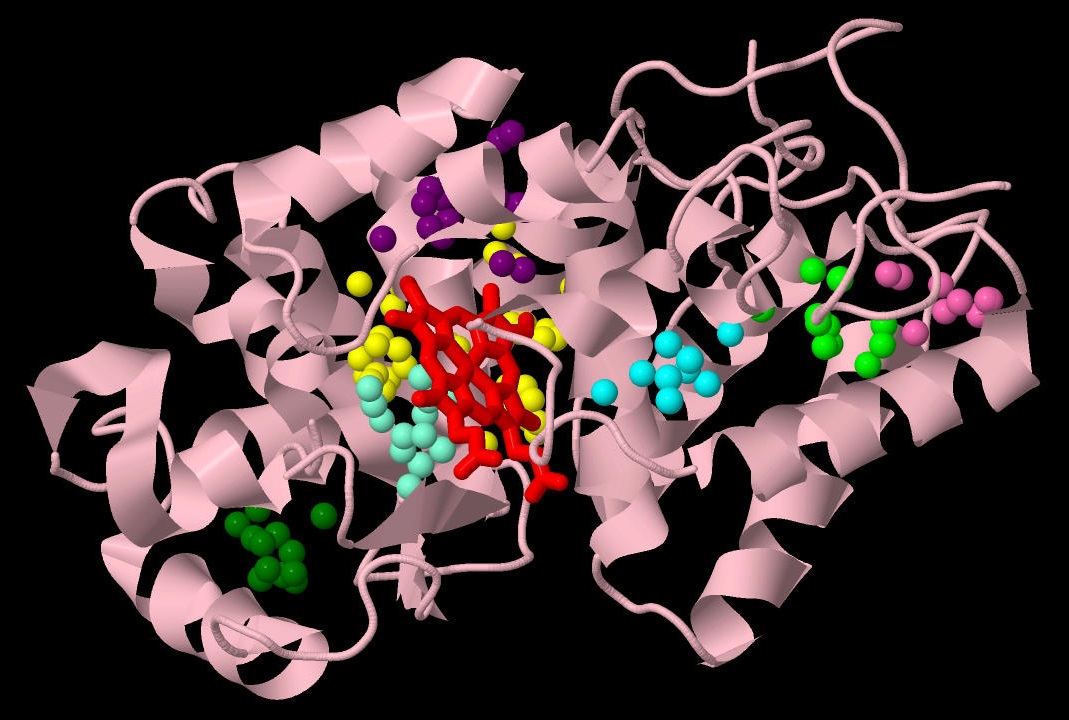
Все гидрофобные участки расположены внутри белка (не на его поверхности!) между α-спиралями. Что позволяет утверждать, что расположение спиралей друг относительно друга поддерживается гидрофобными взаимодействиями. Интересно отметить, что один из таких достоверных кластеров расположен вплотную к гему с одной стороны его плоскости. Из литературы известно, что с этой же стороны к центру гема подходит остаток гистидина 170, который координирует центральный ион железа. Он же одновременно входит в состав данного кластера. Вероятно, гидрофобное окружение в данном случае (и вообще) усиливает все водородные и ионные связи в активном центре.
Поиск гидрофобных кластеров в комплексе белка с ДНК
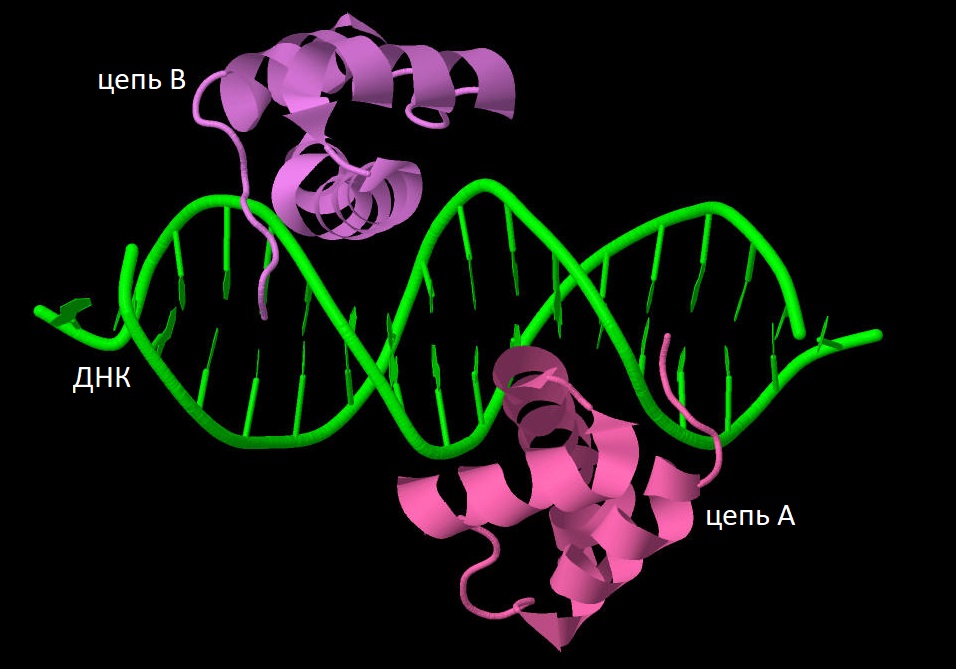
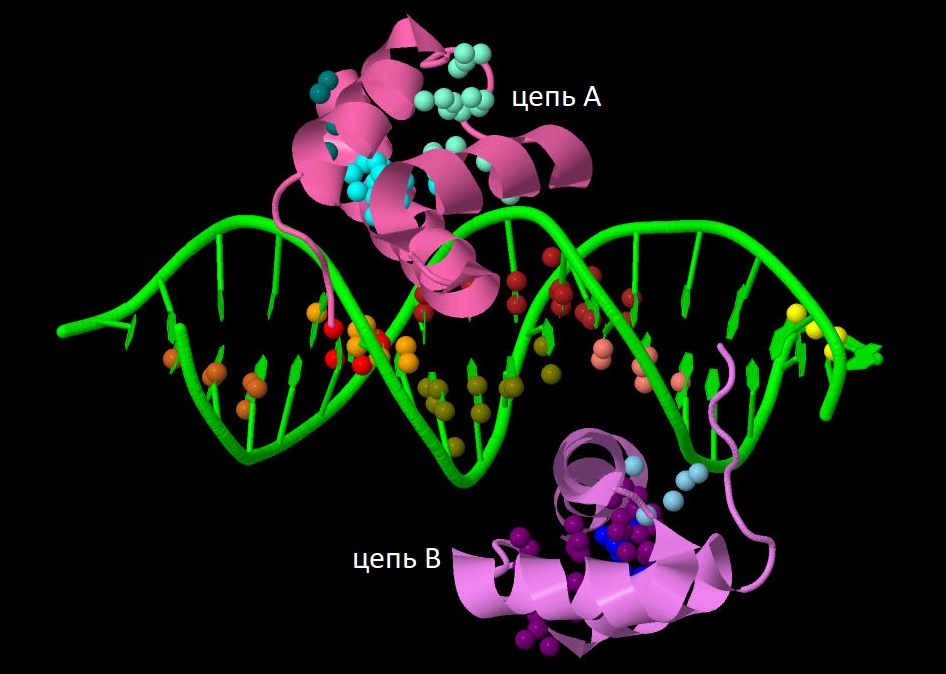
Для работы я выбрала структуру гомодимера из двух транскрипционных факторов MEIS1 в комплексе с гомеобоксом (специфичной последовательностью ДНК) (PDB ID = 4XRM). Ниже представлено изображение структуры выбранного комплекса.
При запуске сервиса CluD с параметром "Distance threshold" = 4.0 Å было найдено всего 24 гидрофобных ядра. Из них я выбрала 14 "достоверных" кластеров (8 из ДНК и по 3 на каждый мономер белка) с минимальным количеством атомов = 5 и минимальным числом аминокислотных остатков = 3 в составе. Ниже представлено их распределение (у каждого кластера индивидуальный цвет).
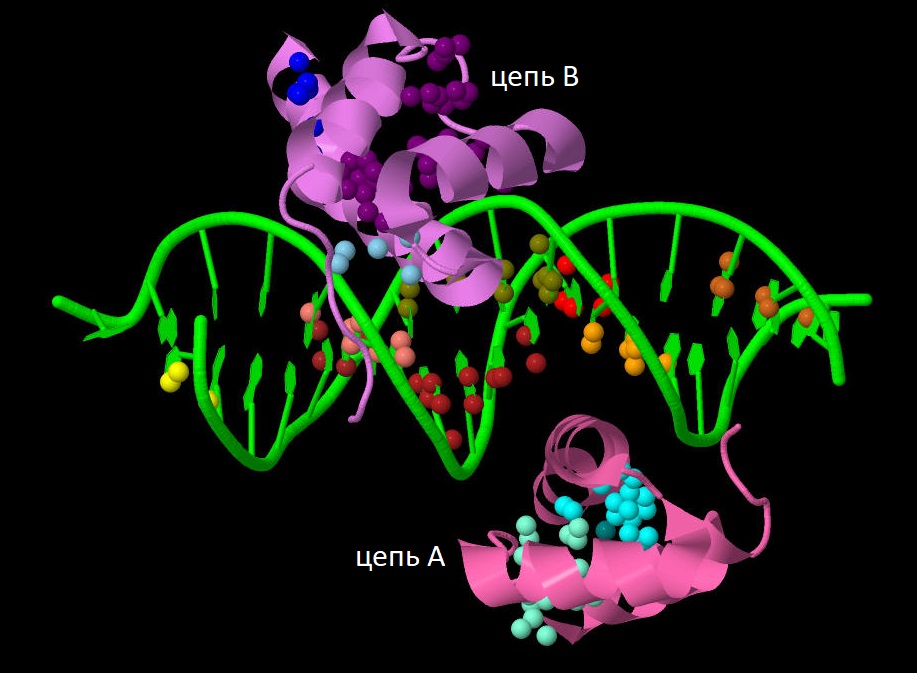
Наблюдаем аналогичную картину, как в случае HRP. Гидрофобные взаимодействия стабилизируют расположение α-спиралей друг относительно друга в моледуле белка, а связывание транскрипционного фактора с большой бороздкой ДНК, вероятно, происходит за счет водородных или ионных связей поверхности α-спирали белка с отрицательно заряженным остовом ДНК.
Действительно, дальнейший анализ показал, что три остатка лизина в цепи отвечают за связывание с остовом ДНК, а два остатка аргинина непосредственно взаимодействуют своими заряженными концевыми группами с азотистыми осмованиями нуклеотидов (данные не приведены).