Введение
| PDB ID | 4REK |
|---|---|
| Uniprot ID | CHOD_STRS0 |
| Название гена | choA |
| Название организма | Streptomyces sp. (strain SA-COO) |
| Длина белка (а.о.) | 546 |
Холестериноксидаза - бифункциональный фермент, катализирующий окисление 3-бета-гидроксильной группы холестерина и изомеризацию двойной связи полученного продукта [2].
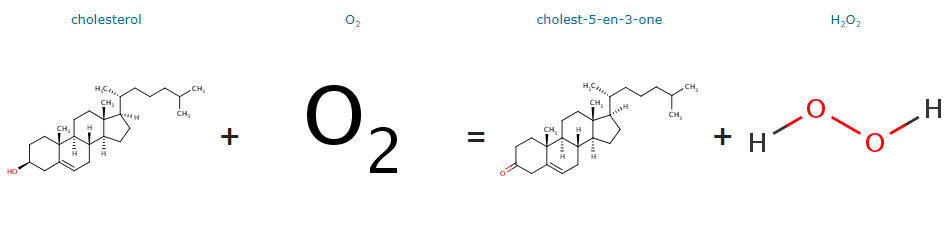
Реакция окисления:
cholesterol + O2 = cholest-5-en-3-one + H2O2
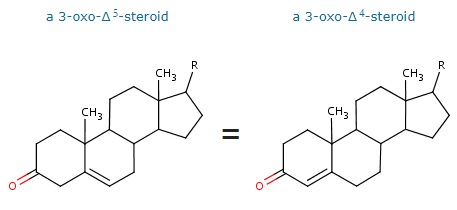
Реакция изомеризации:
a 3-oxo-Δ5-steroid = a 3-oxo-Δ4-steroid
В организме бактерии холестериноксидаза служит ферментом, связывающим кофактор флавин-адениндинуклеотид (FAD). Идентифицированы две основные формы этого фермента: в форме I кофактор FAD нековалентно связан с белком, тогда как в форме II группа FAD ковалентно связана с His121. Нековалентные формы флавопротеина являются членами семейства флавоферментов, и имеют два остатка - His447 и Asn485, участвующие в окислении субстрата и являющиеся полуконсервативными. Окисление гидроксильной группы требует кофактора FAD, который одновременно редуцируется, но затем повторно окисляется с образованием перекиси водорода. (рис.1)
Бактерии, использующие холестериноксидазу, можно разделить на две группы: патогенные и непатогенные. Непатогенные, такие как стрептомицеты и бысторорастущие микробактерии могут использовать холестерин в качестве источника углерода и активировать экспрессию холестериноксидазы в его присутствии. Патогенные бактерии, например Rhodococcus equi, нуждаются в холестериноксидазе для инфекция макрофага хозяина; холестерин также регулирует экспрессию фермента в этих организмах. Предполагается, что роль фермента в патогенезе в изменении физической структуры липидной мембраны путем преобразования холестерина в холест-4-ен-3-он.
ChOx также обладает инсектицидными свойствами против личинки Coeloptera, которые являются сельскохозяйственными вредителями, и в настоящее время разработана для использования в обработке сельскохозяйственных культур [3].
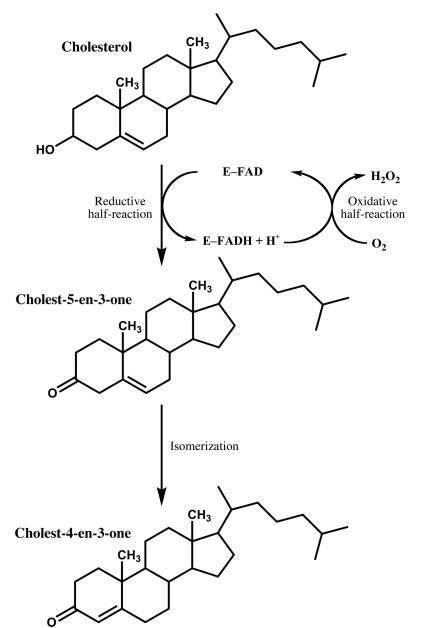
Рис. 1
Лиганды
 |
Flavin adenine dinucleotideФАД — флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. ФАД существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. Он может быть восстанавливается до ФАДH2, когда принимает два атома водорода. Молекула ФАДH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии. Молекула ФАДH2 окисляется в ФАД, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молекулам ATФ. Активной частью кофермента является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона [5]. |
|---|
| Название по IUPAC | [[(2R,3S,4R,5R)-5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [(2R,3S,4S)-5-(7,8-dimethyl-2,4-dioxobenzo[g]pteridin-10-yl)-2,3,4-trihydroxypentyl] hydrogen phosphate |
|---|---|
| Химическая формула | 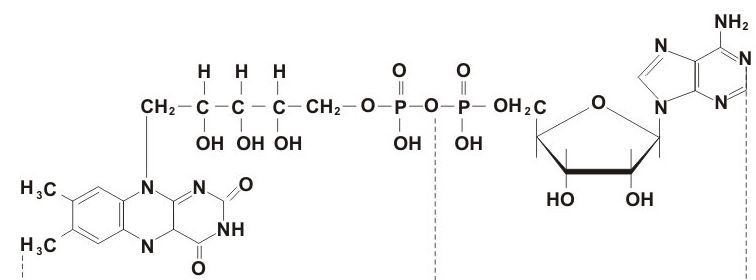 |
| Брутто-формула | C27H33N9O15P2 |
| Молярная масса | 785,5 г/моль |
| Идентификатор в PubChem | 643975 |
Информация о белок-белковых контактах
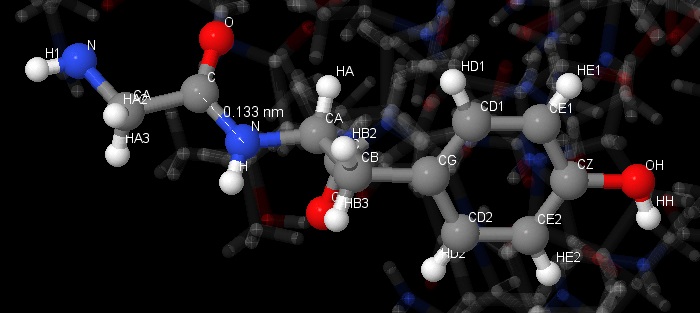
| Имена атомов | Длина связи (Å) |
|---|---|
| [GLY]9:A.C - [TYR]10:A.N | 1.33 |
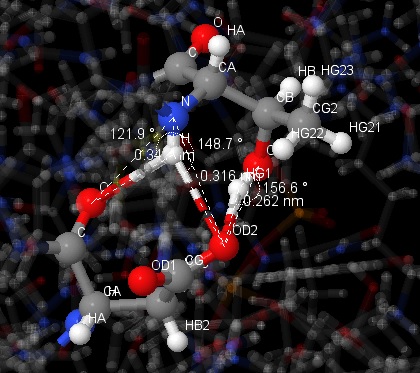
| Имена атомов | Длина связи (Å) | Угол N-H-O (°) |
|---|---|---|
| [THR]394:A.OG1 - [ASP]391:A.OD2 | 2.62 | 156.6 |
| [THR]394:A.N - [ASP]391:A.OD2 | 3.16 | 148.7 |
| [THR]394:A.N - [ASP]391:A.O | 3.41 | 121.9 |
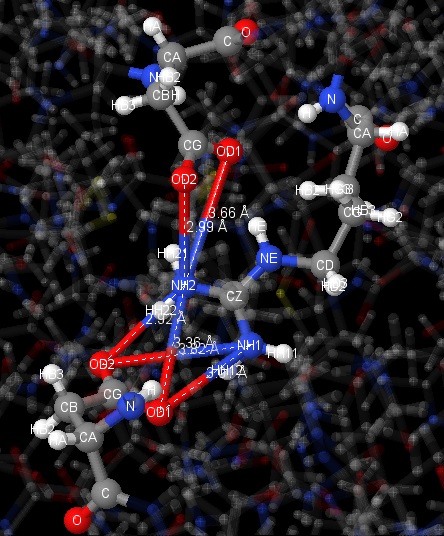
Солевые мостики возникают между положительно и отрицательно заряженными боковыми радикалами аминокислотных остатков, расстояние между атомами которых не может быть больше 4 А. Ионное взаимодействие между атомами относится к электростатическим [6].
Чтобы найти солевые мостики можно воспользоваться командами выделения отрицательно заряженных остатков "select acidic" и выделения положительно заряженных остатков "select basic", затем окрасить их в разный цвет. Таким образом были выбраны остатки: два аргинина и аспаргиновая кислота. Далее было проверено не превышает ли расстояние между заряженными атомами 4 ангстрема с помощью команды "select within(4,64) and protein". Так было установлено, что между этими остатками есть солевые мостики.
| Имена атомов | Длина связи (Å) |
|---|---|
| [ARG]64:A.NH2 - [ASP]62:A.OD1 | 3.66 |
| [ARG]64:A.NH2 - [ASP]62:A.OD2 | 2.99 |
| [ARG]64:A.NH2 - [ASP]51:A.OD1 | 3.36 |
| [ARG]64:A.NH2 - [ASP]51:A.OD2 | 2.92 |
| [ARG]64:A.NH1 - [ASP]51:A.OD2 | 3.82 |
| [ARG]64:A.NH1 - [ASP]51:A.OD1 | 3.01 |
Исследование плотности упаковки в гидрофобном ядре
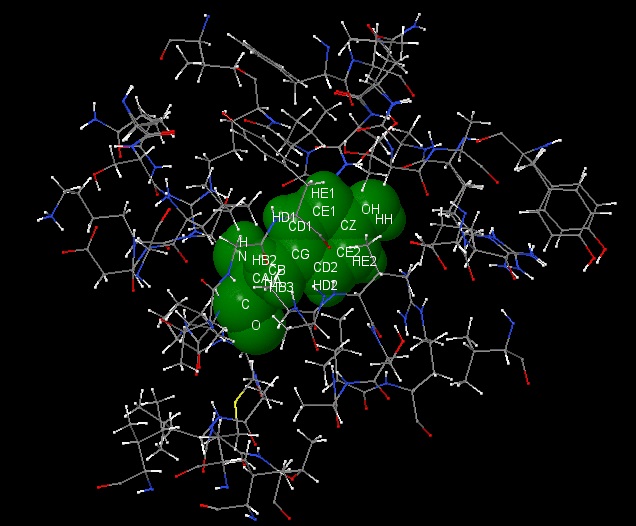
1. Минимальное расстояние от остатка, на котором атомы окружения почти полностью покрывают тирозин - 4 Å.
2. Характерное расстояние между соседними не связанными ковалентно атомами в белке колеблется до 2 Å. Минимальное расстояние, от тирозина до атома, не связанного с ним ковалентно - 1.32 Å.
3. Так как диаметр атома кислорода составляет 3.2Å. Молекула воды не сможет поместиться между соседними аминокислотными остатками.
Чтобы найти гидрофобное ядро, с помощью команды "select hydrophobic" были найдены гидрофобные аминокислотные остатки, а также было видно расположение между ними полярных аминокислот. Так был выбран участок белка с большой плотностью гидрофобных радикалов. Из них был выбран крупный остаток - тирозин. Затем над ним были проделаны исследования, описанные в практикуме.
Информация о лиганд-биомолекулярных контактах
Для исследования данных контактов снова был взят лиганд FAD. Выяснилось, что между ним и белком нет других взаимодействий, кроме водородных связей.
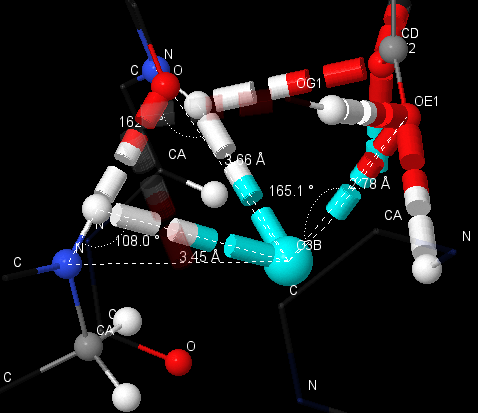
| Имена атомов | Длина связи (Å) | Угол N-H-O (°) |
|---|---|---|
| [FAD]601:A.O3B - [GLU]40:A.OE1 | 2.78 | 165.1 |
| [FAD]601:A.O3B - [GLY]111:A.N | 3.66 | 162.0 |
| [FAD]601:A.O3B - [GLY]114:A.N | 3.45 | 108.0 |
Личный вклад
Автором данного исследовательского мини-проекта является Горелова Ирина. Хотелось бы выразить огромную благодарность:
Салимгарееву Руслану за помощь на начальном этапе с поиском информации о белке и о разных контактах, в частности с поиском солевых мостиков и гидрофобного ядра. А так же за общее моё понимание скриптов Jmol.
Никитину Иннокентию за помощь с лиганд-биомолекулярными контактами и с написанием кнопок апплета, особенно кнопки "сохранить изображение".
Малеевой Александре за "толчок" в сторону лучшего понимания скриптов Jmol.
1.https://www.uniprot.org/uniprot/P12676
2.https://www.rcsb.org/structure/4rek
5.https://wiki2.org/ru/Флавинадениндинуклеотид
6.Учебный сайт Хвень Ирины. Солевые мостики в белке дисульфидного обмена Chlorobium tepidum TLS.