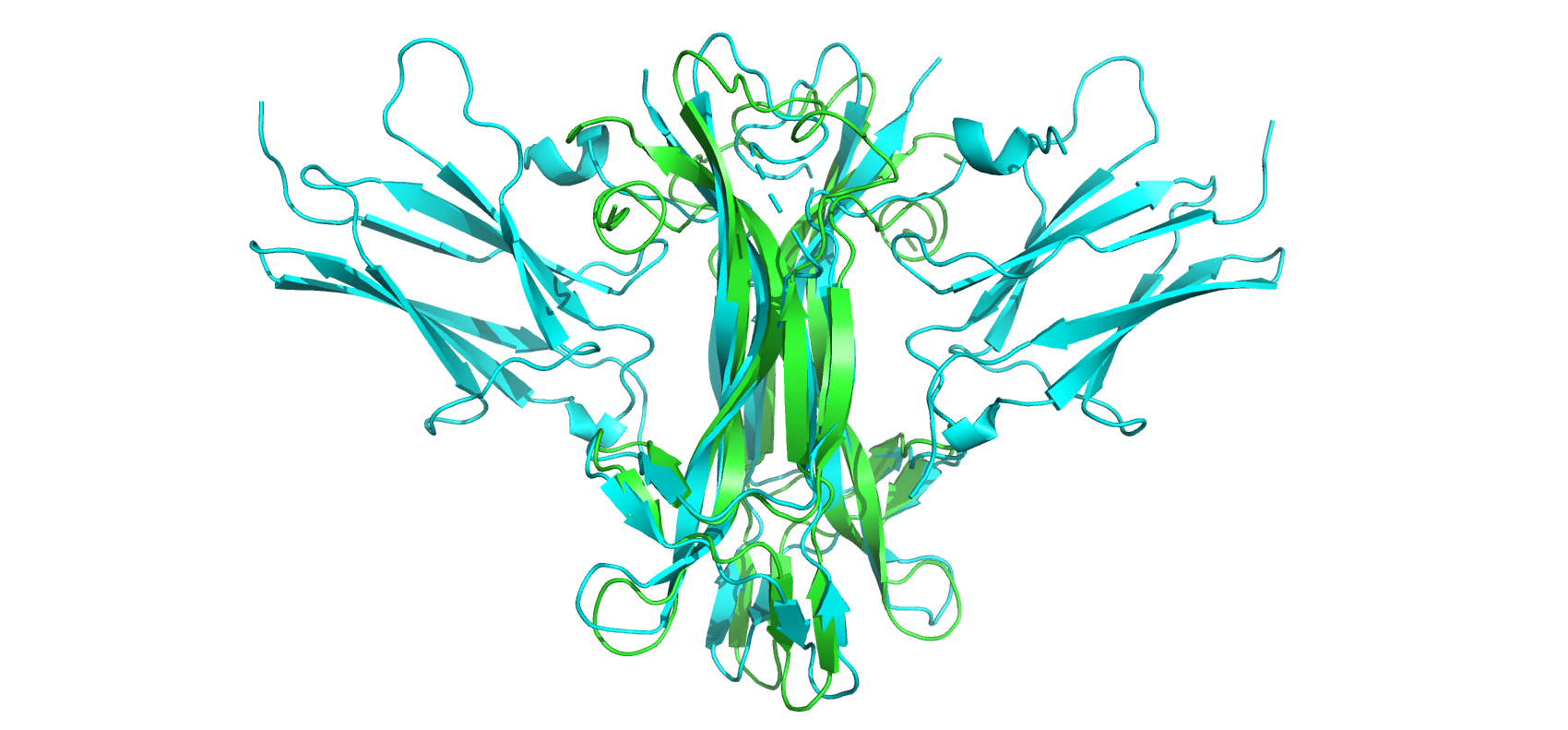
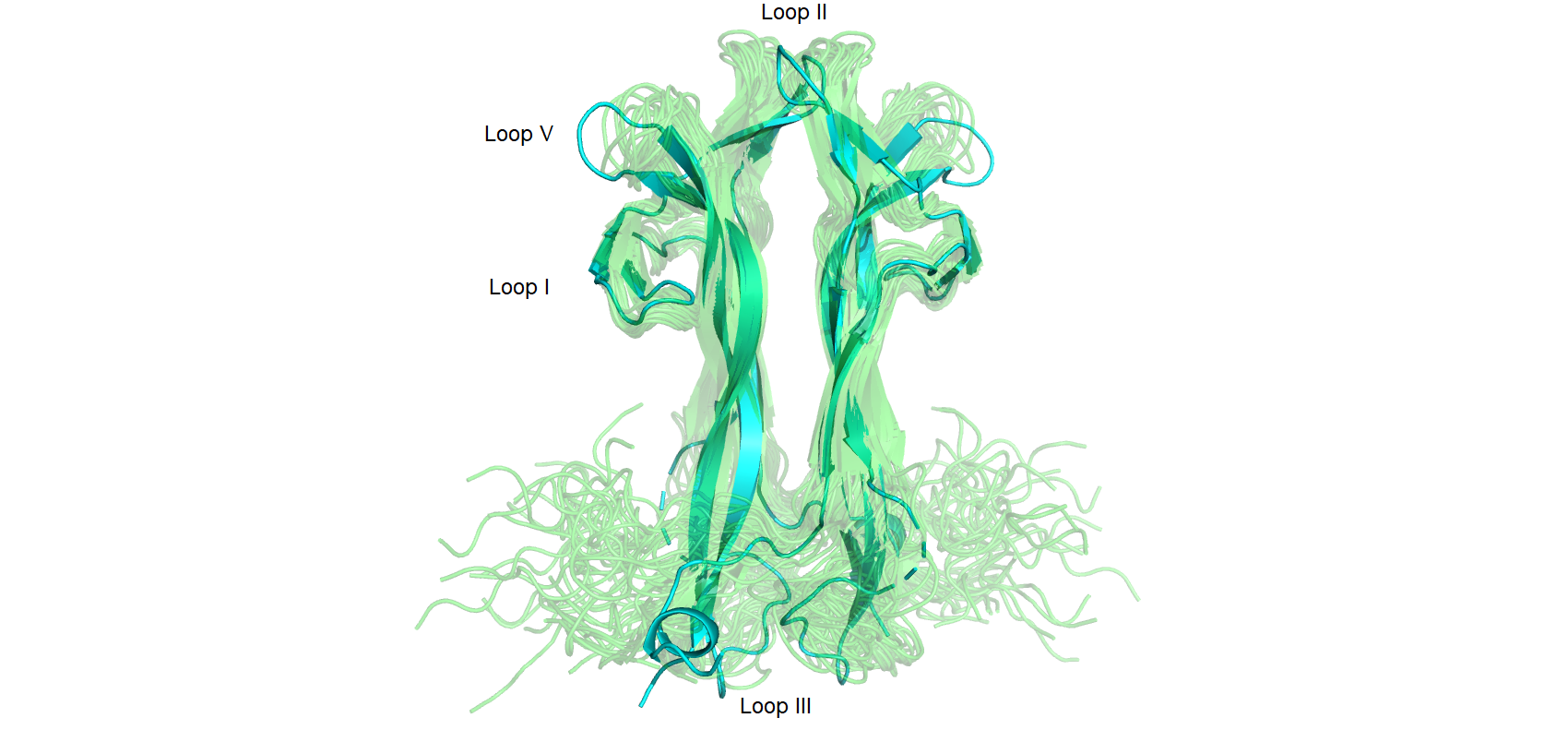
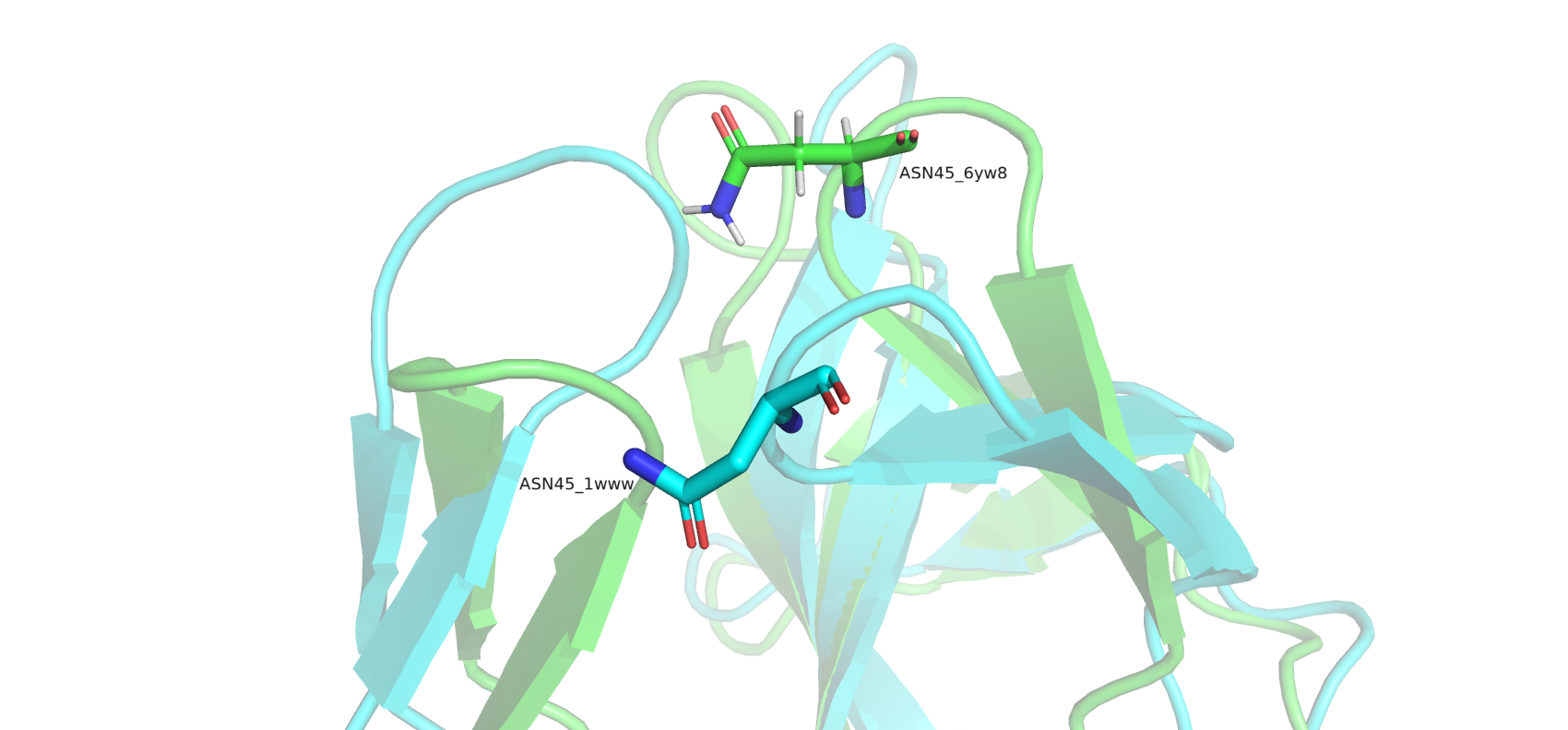
В начале были рассмотрены 2 структуры белка NGF человека, полученные методами РСА и ЯМР. Фактор роста нервов (NGF) участвует во множестве процессов, таких как дифференцировка и выживание клеток, прекращение их роста и апоптоз нейронов. Эти события контролируются NGF в результате его связывания с рецепторами на поверхности клетки - TrkA и p75. Структура 1www (полученная РСА в 1999 году) имеет разрешение 2.20 Å (на рисунках - голубая), а структура 6yw8 (полученная ЯМР в 2020 году) включает в свой состав 20 конформеров (на рисунках - зеленые). Большая часть вторичных структур (B-листов) совпадает при наложении, однако есть и исключения. Возможно это связано с тем, что в структуре 1www, в отличие от свободного в растворе белка из структуры 6ym8, NGF связан с рецептором TrkA, что повлияло на его конформацию. Однако больше всего не совпали друг с другом петли белка. Так, 3 петля с 60 по 67 остаток отсутствует у 1www, являясь очень подвижной частью структуры. Остальные петли 6ym8 также плохо накладываются на 1www. Был отдельно рассмотрен остаток ASN45 во 2 петле NGF: при сравнении в одной из конформаций расстояние между остатками составляет около 9 Å.


Далее для каждой из 2 цепей белка из ансамбля 6ym8 были рассчитаны RMSF остатков и сравнены с их B-факторами из 1www. RMSF (среднеквадратичной флуктуация) является мерой подвижности для ЯМР структур. При сопоставлении RMSF и B-факторов можно прикинуть, в какой мере ансамбль моделей в записи PDB, полученной методом ЯМР, действительно можно принять за отражение подвижности белка. Многие остатки из 1www отсутствуют в 6ym8, поэтому сравнение проводилось для общих.
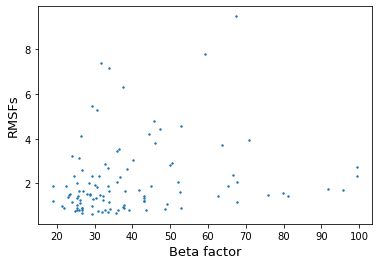
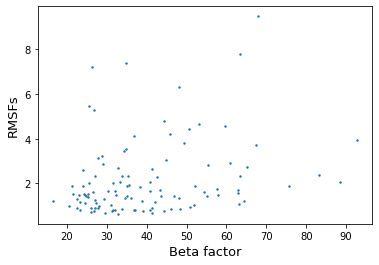
Корреляция Спирмана составила 0.2706 (pvalue=0.0046) и 0.2678 (pvalue=0.0049) для рисунков 4 и 5 соответственно. Однозначно линейной зависимости найти не удается. Многим RMSF с малыми значениями соответствуют различные B-факторы (как большие, так и малые). Поэтому можно сделать вывод, что ансамбль, полученный ЯМР в данном случает нельзя принять за отражение подвижности белка. При этом в 1www достаточно много больших B-факторов, что может говорить о плохом качестве данных из РСА эксперимента.
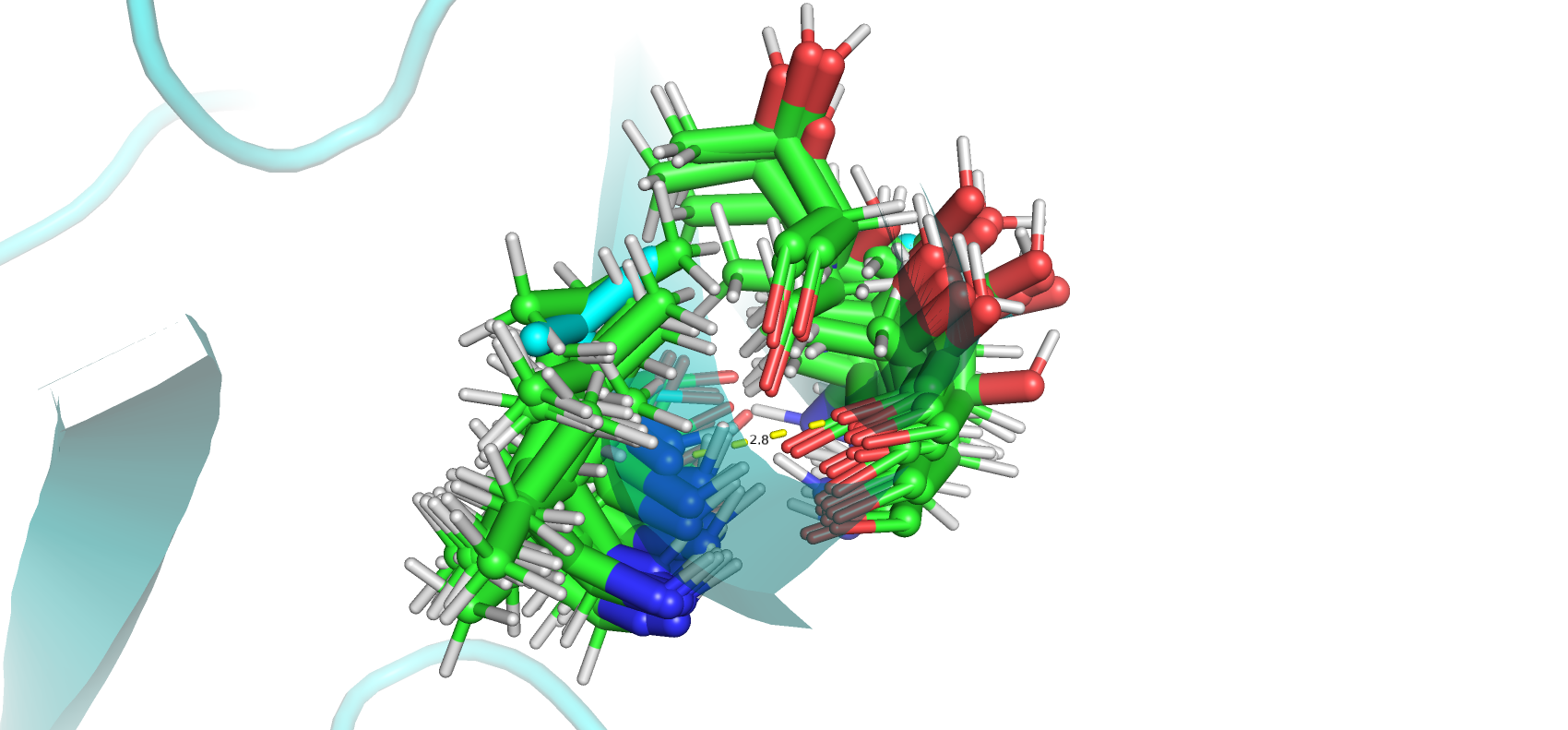
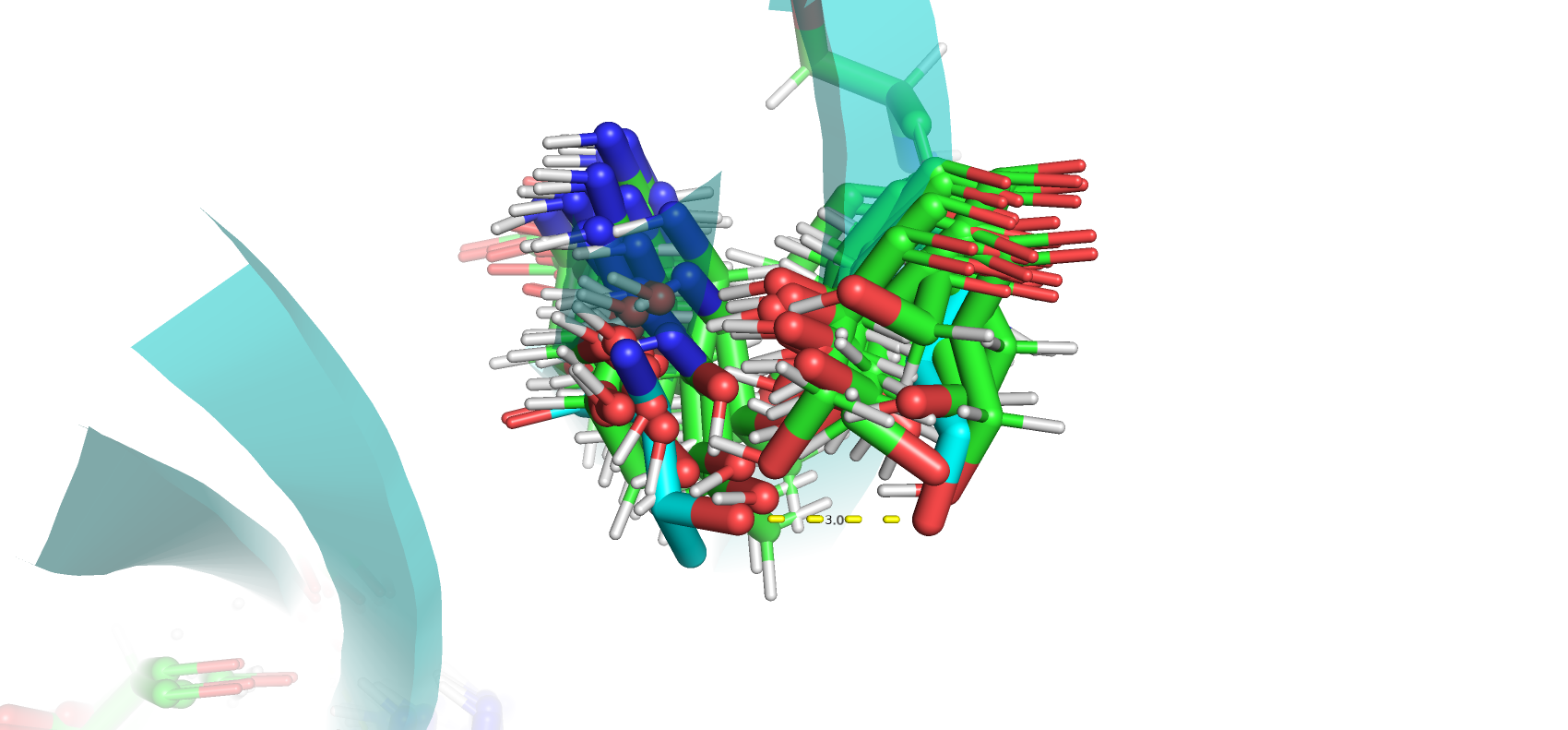
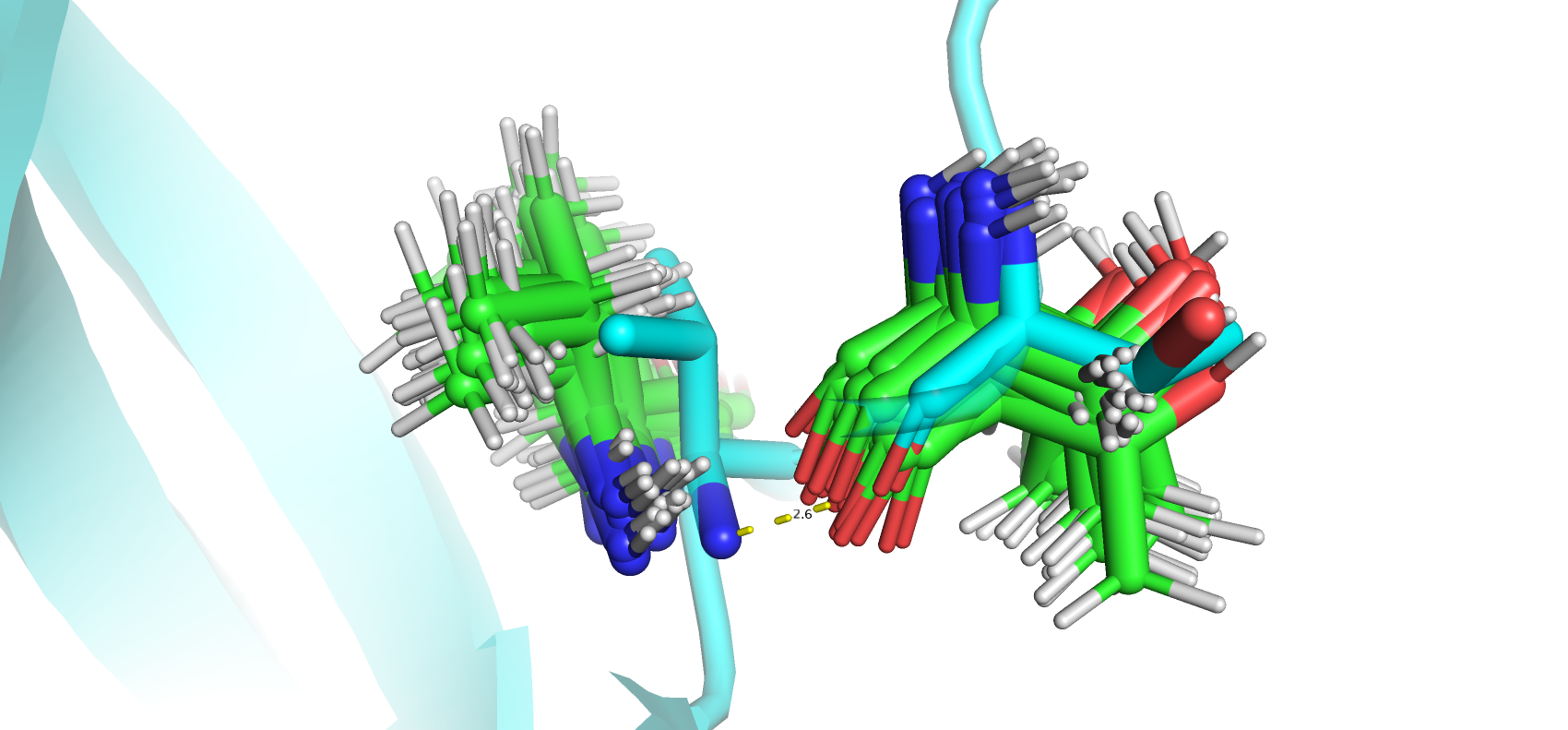
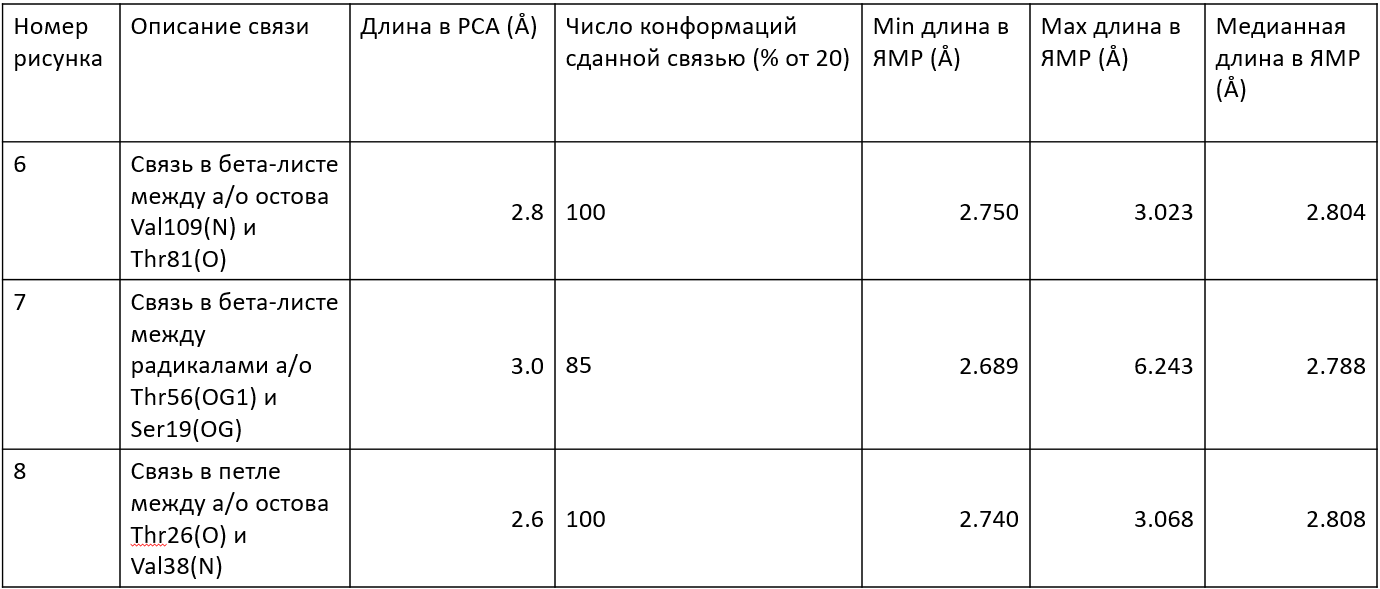
Были исследованы водородные связи в разных частях структур. Были посчитаны минимальные, максимальные и медианные значения длин водородных связей. Как и ожидалось разброс длин в центре структуры у водородных связей в остове меньше всех. Однако в петле 1, расположенная на поверхности белка, разброс длин оказался небольшим. Ожидалось, что водородные связи петель нестабильны, так как остатки могут сольватироваться. Возможно данная петля находится достаточно близко к бета-листу белка, что мешает ей двигаться.