На рассмотрение была получена структура PDB ID: 3JXV. Это первая структура трех FK506-связывающих доменов, входящих в состав N-концевого домена белка FKBP73 пшеницы. Кроме получения самой структуры, целью исследования являлось изучение структурных особенностей, определяющих пептидилпролил изомеразную активность доменов данного белка, а также поиск его возможных новых функций. Оригенальную публикация можно посмотреть здесь.
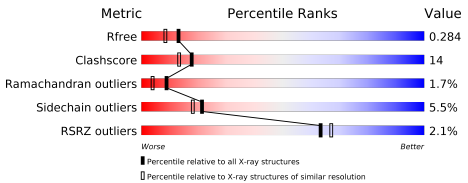
Данная структура имеет разрешение 2.08 Å. Метрики качества структуры со страницы PDB можно увидеть на рисунке ниже.

Видно, что значения метрик для данной структуры в целом ниже, чем у большинства структур, что говорит о ее плохом качестве. Для подсчета Rfree была взята тестовая выборка из 1271 рефлексов (5.08%) из которых получили Fobs и рабочая выборка из 23752 рефлексов, по которым оптимизировали модели и получили R=0.248. Объединив выборки было получено Rfree=0.287. Исходя из значений, модель не была переоптимизирована (Rfree-R < 10%), однако сам по себе Rfree не является хорошим (>20%). Остатков, RSRZ которых оказался > 2, относительно немного (2.1%).
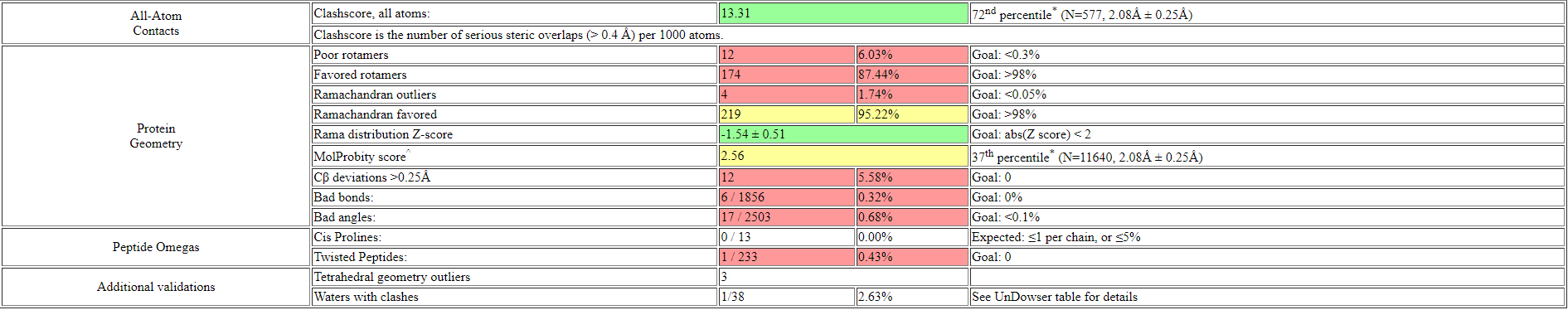
На рис.2 остатки белковой цепи 3JXV были покрашены по количеству геометрических критериев, по которым они являются аутлайерами (зеленым - 0, желтым - 1, оранжевым - 2, красным >=, серым - остатки, не вошедшие в модель, красные точки над остатками и красная полоса над общей линией - остатки, не вписавшиеся в электронную плотность, у которых RSRZ > 2). Таким образом, 27% остатков модели является аутлайером по 1 или более геометрическому критерию. 5 остатков имеют нестандартную длину связи. Существуют 7 нестандартных углов у 4 аминокислот, образующиеся между 3 определенными атомами. 50 пар атомов расположены слишком близко друг к другу, и их Ван-дер-Ваальсовые радиусы перекрываются (50 клэшей). Clashscore=14, расчитанный как количество клэшей на 1000 атомов (включая атомы водорода), является большим. 4 остатка (2%) являются аутлайерами по карте Рамачандрана (по углам φ и ψ). Это больше чем у 96% структур со схожим разрешением. 11 остатков (6%) имеют отличные от ротамеров значения углов вращения вокруг боковых цепей (χ1-χ4): больше чем у 82% структур со схожим разрешением.
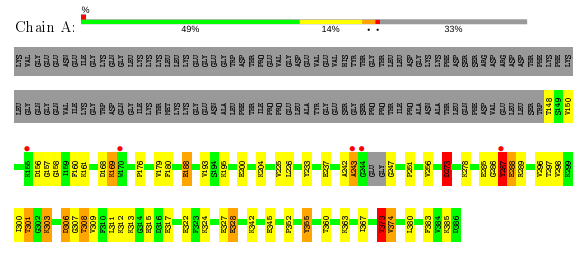
Далее приведены остатки, не вписавшиеся в электронную плотность. Данные остатки находятся на окраинах белка, где, возможно, имеют высокую подвижность, что влияет на соответствие модели электтронной плотности. Это подтверждает значение B-фактора (рис.7). Помимо данных остатков, у которых RSRZ > 2, на 1 уровне подрезки видно также большое количество боковых групп лизинов и глутаматов, плохо вписанных в электронную плотность.
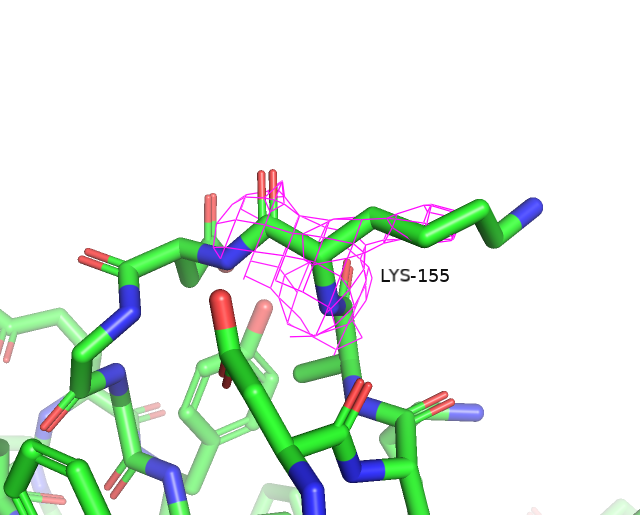
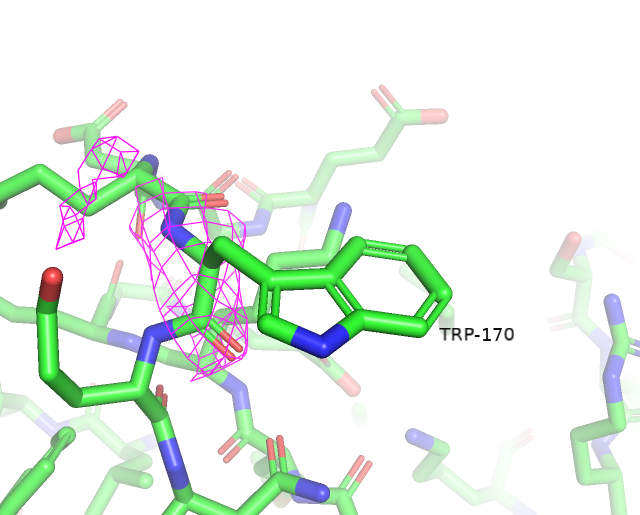
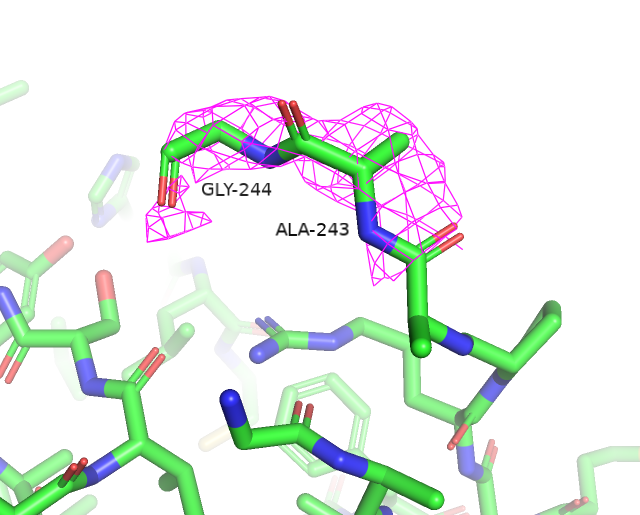
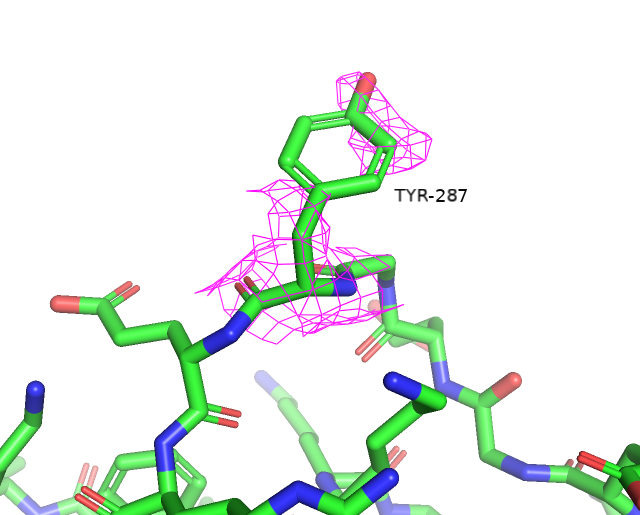
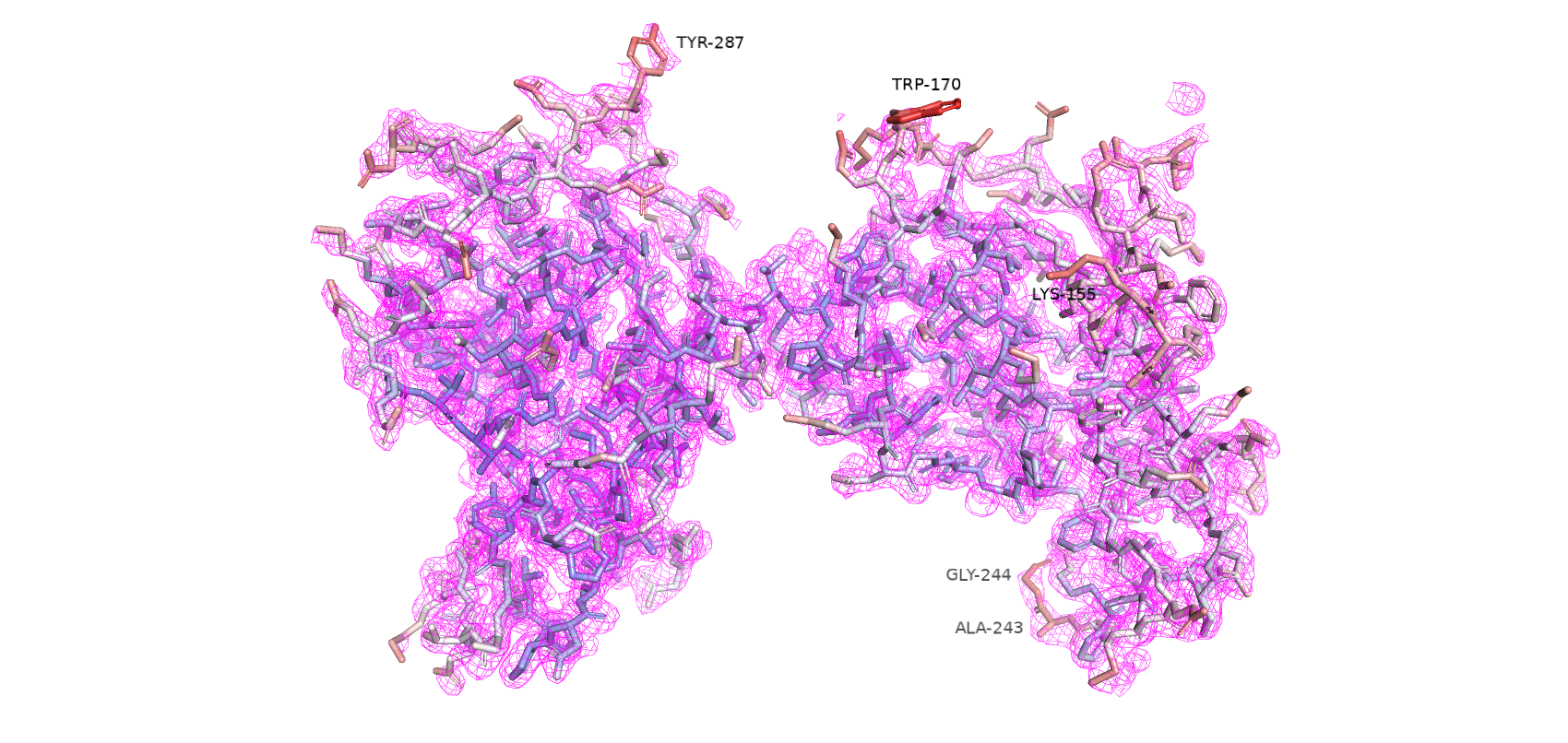
Воспользовавшись сервисом MolProbity, была получена сводная таблица по геометрии остатков. Предварительно к структуре были добавлены водороды и проведен разворот 2 остатков гистидина (His-207 и His-315) для улучшения водородных связей и уменьшении клэша. За счет этих преобразований Clashscore был улучшен на 0.27 единицы.
Остатки, имеющие нестандартные расстояния стали другими, по сравнению с wwPDB. Сохранилось только 3 такие аминокислоты из wwPDB и к ним прибавилось еще 3 новые. Количество уникальных остатков с нестандартными углами возросло с 4 до 17. Остатки, имеющие нестандартные углы Рамачандрана или плохие ротамеры остались почти те же (добавился еще 1 неправильный ротамер). Также был обнаружен остаток Gly-286, который имеет цис-конформацию. Самым популярным остатком, имеющим плохой ротамер является треонин (6/12). Также их имеют 2 Glu, 2 Val, 1 Asp и 1 Tyr. Далее приведены примеры различных маргиналов.
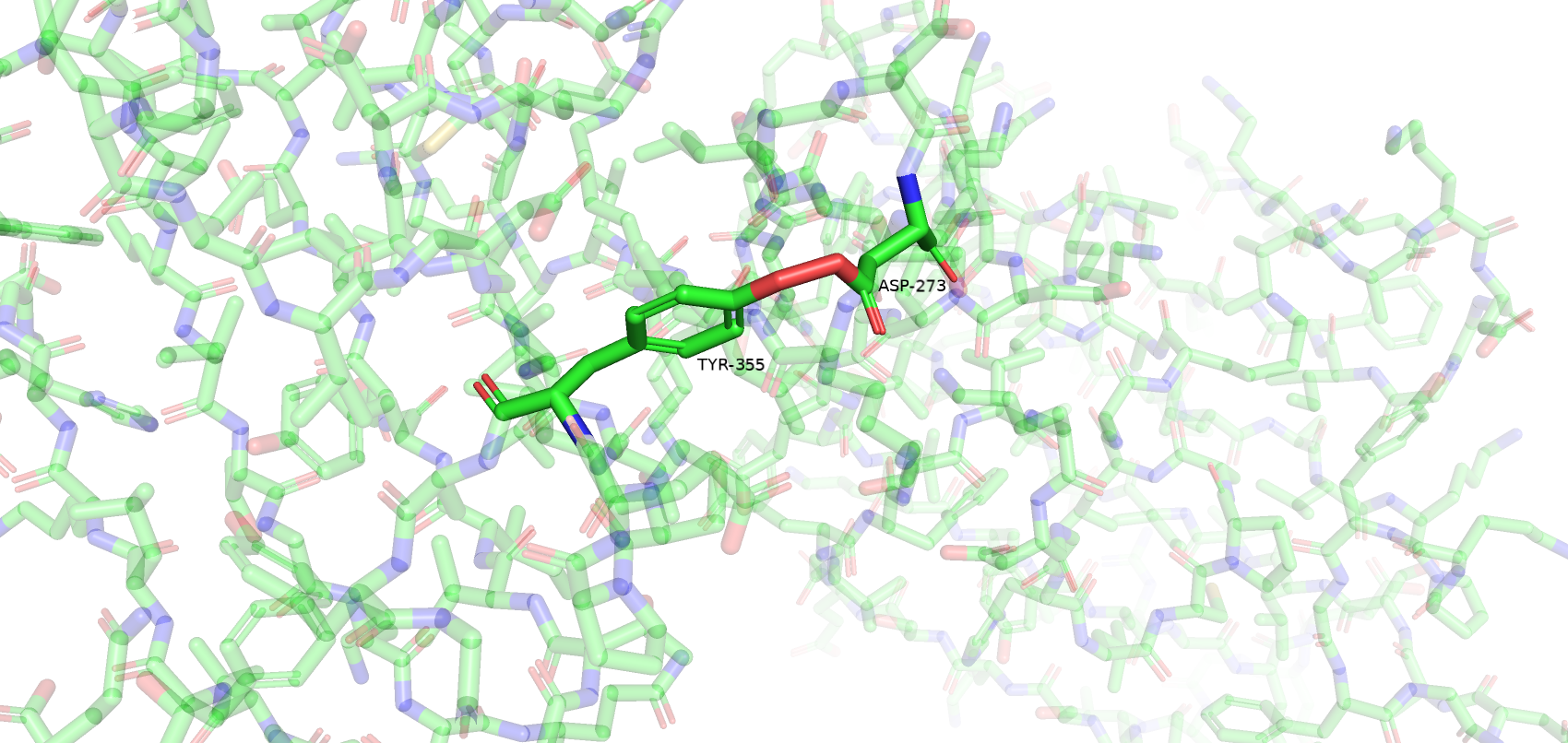
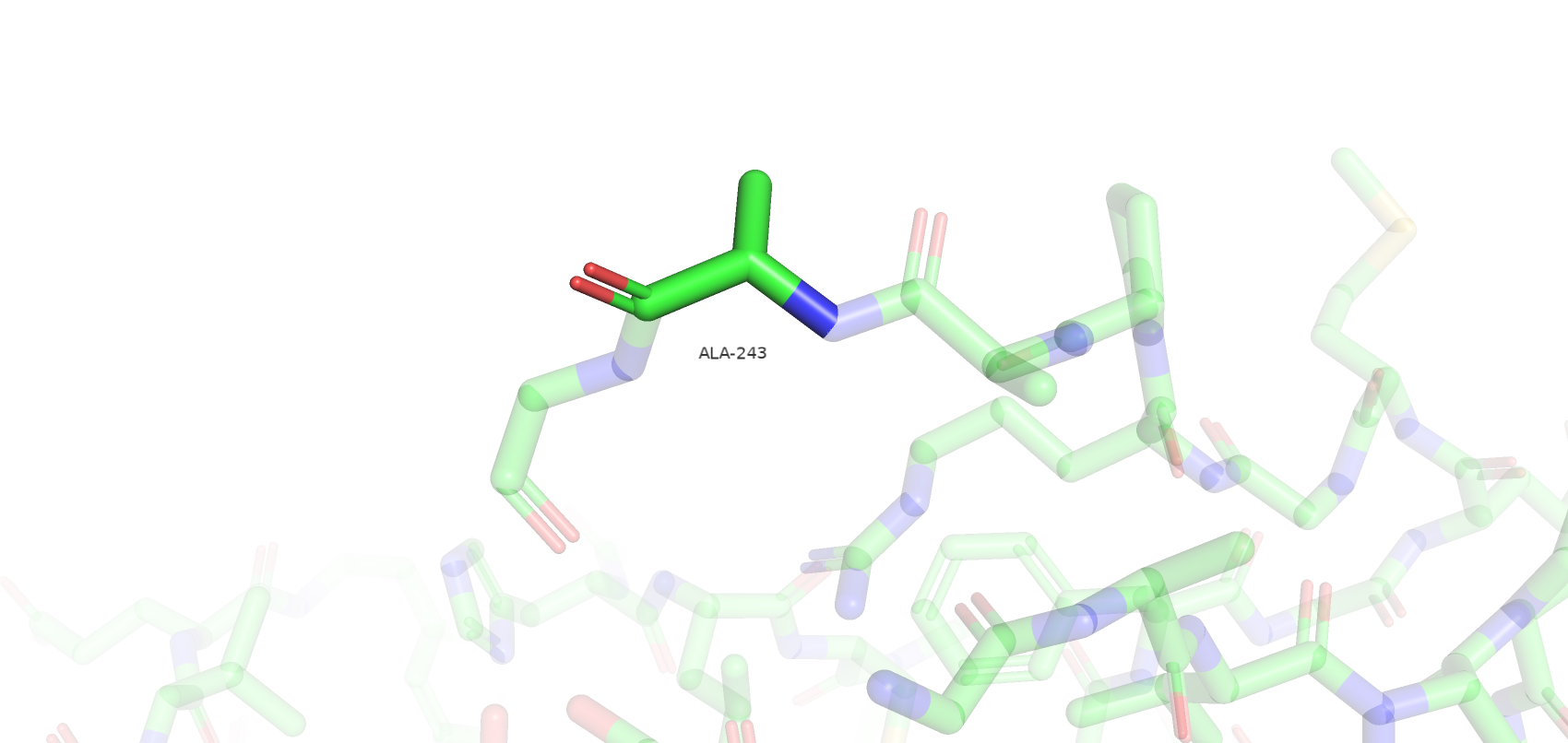
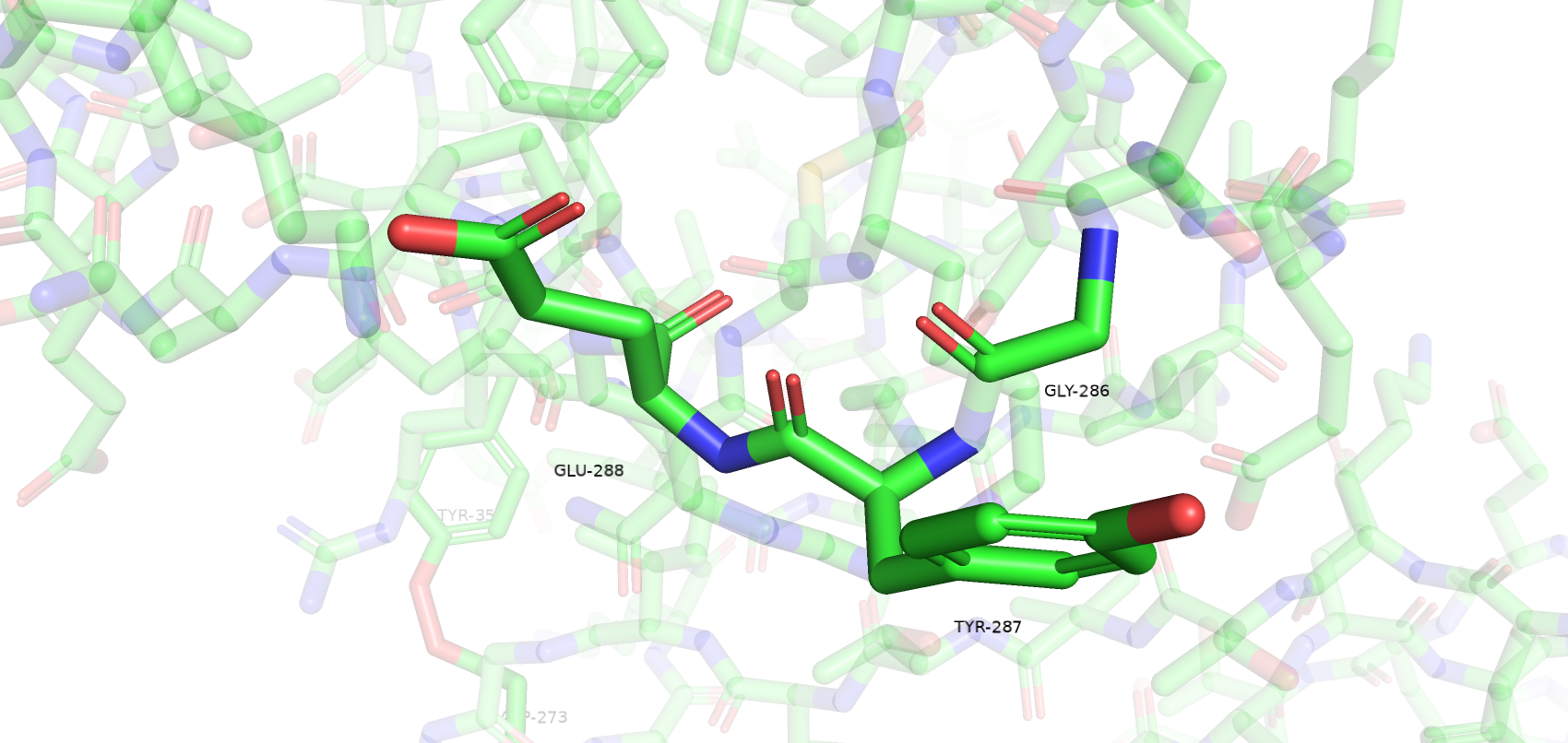
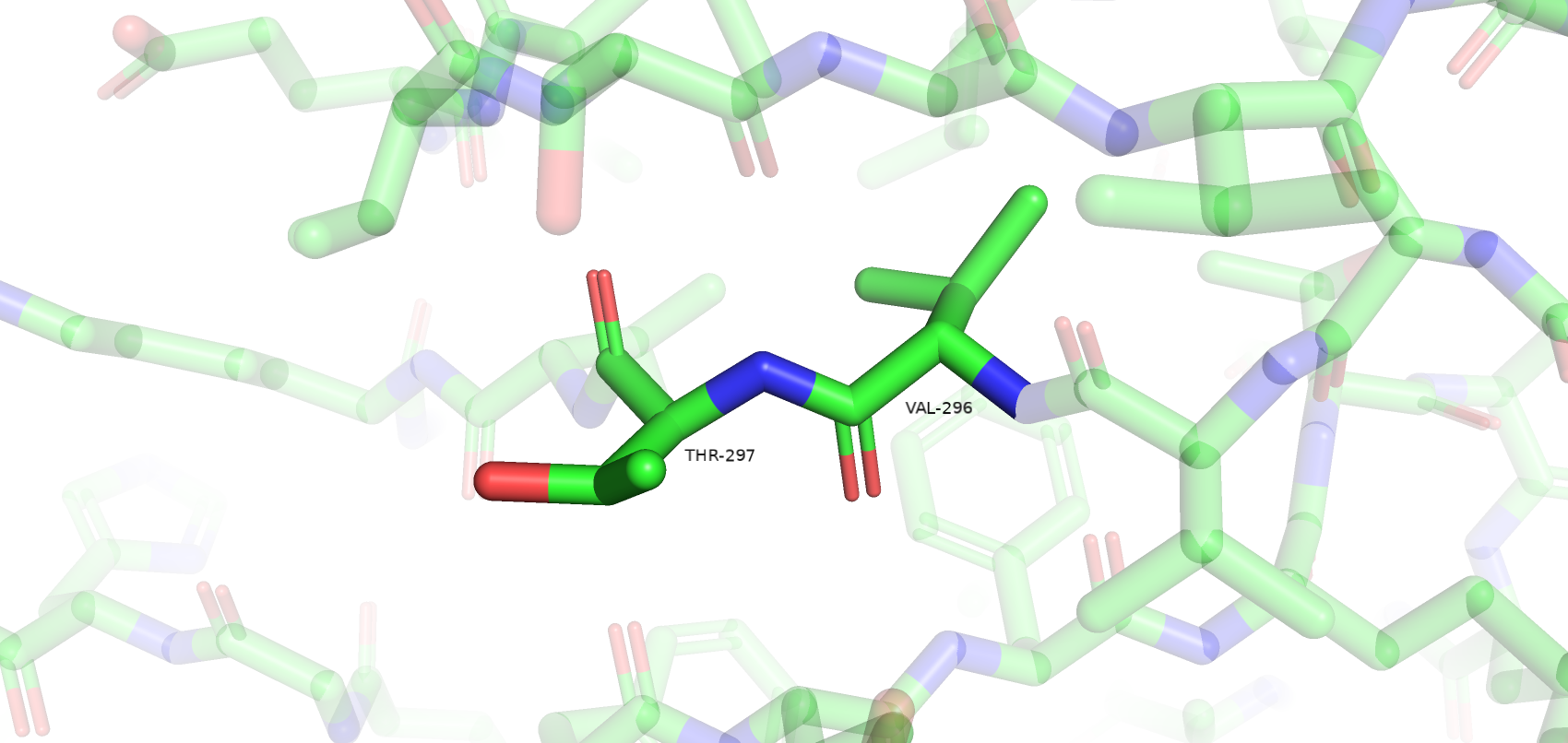
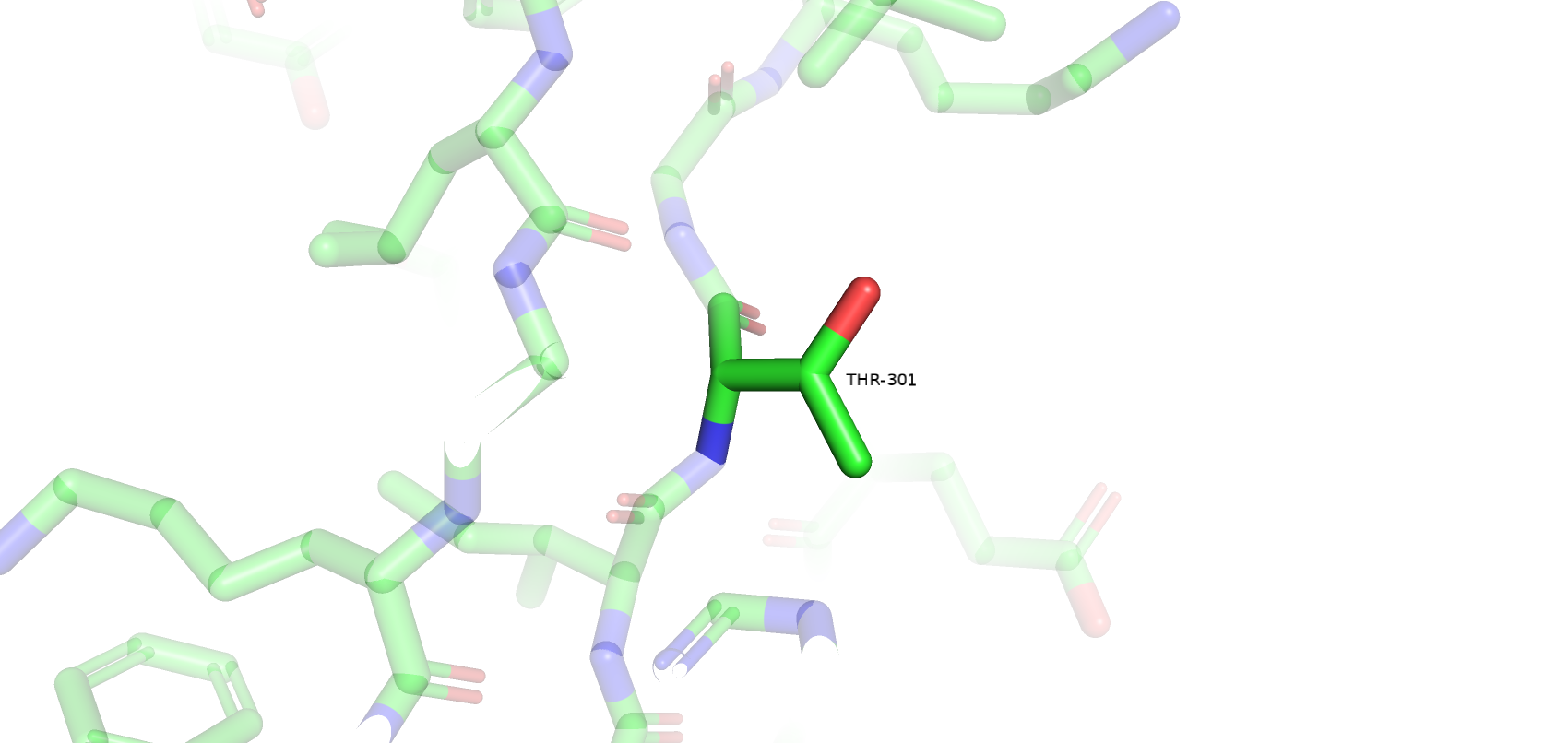
Несмотря на то, что большинство маргинальных остатков расположены на периферии белка и не являются важными в его работе (например, не образуют солевые мостики между субъединицами), большое количество маргинальных остатков и сомнительное качество исходной электронной плотности (даже на 1 уровне подрезки) не позволяет в полной мере использовать данную структуру белка для изучения его особенностей.
Для данного белка была получена улучшенная структура из PDBRedo. Чтобы сравнить её с оригиналом был снова использован MolProbity.
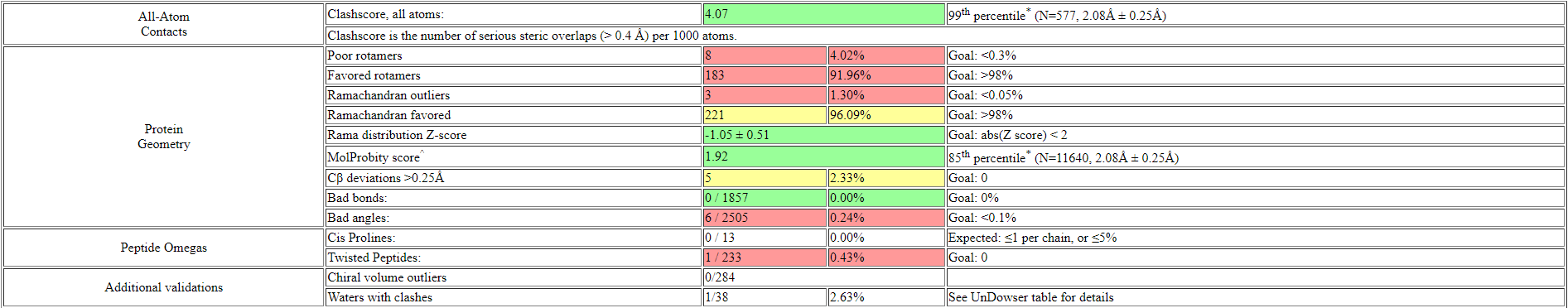
Как видно качество структуры значительно улучшилось: Clashscore упал с 13.31 до 4; количество плохих ротамеров сократилось с 12 до 8; аутлайеров по Рамачандрану стало на 1 меньше; остатков с нестандартными длинами не осталось; остатков с нестандартными углами осталось 6 (было 17). Также MolProbity score улучшился с 2.56 (37 перцентиль) до 1.92 (85 перцентиль). Далее несколько примеров улучшения модели. Зеленым цветом покрашена оригинальная структура, голубым - улучшенная.
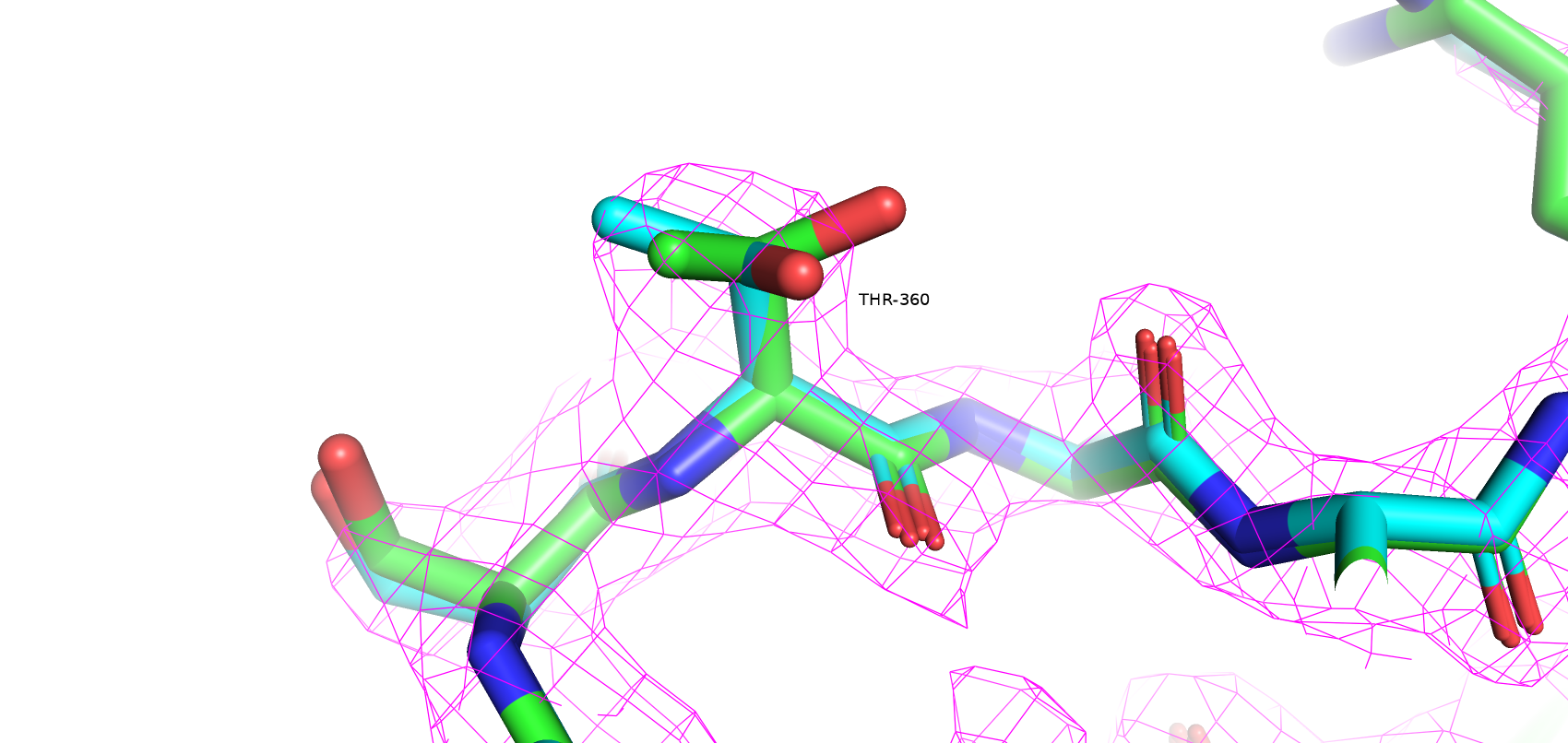
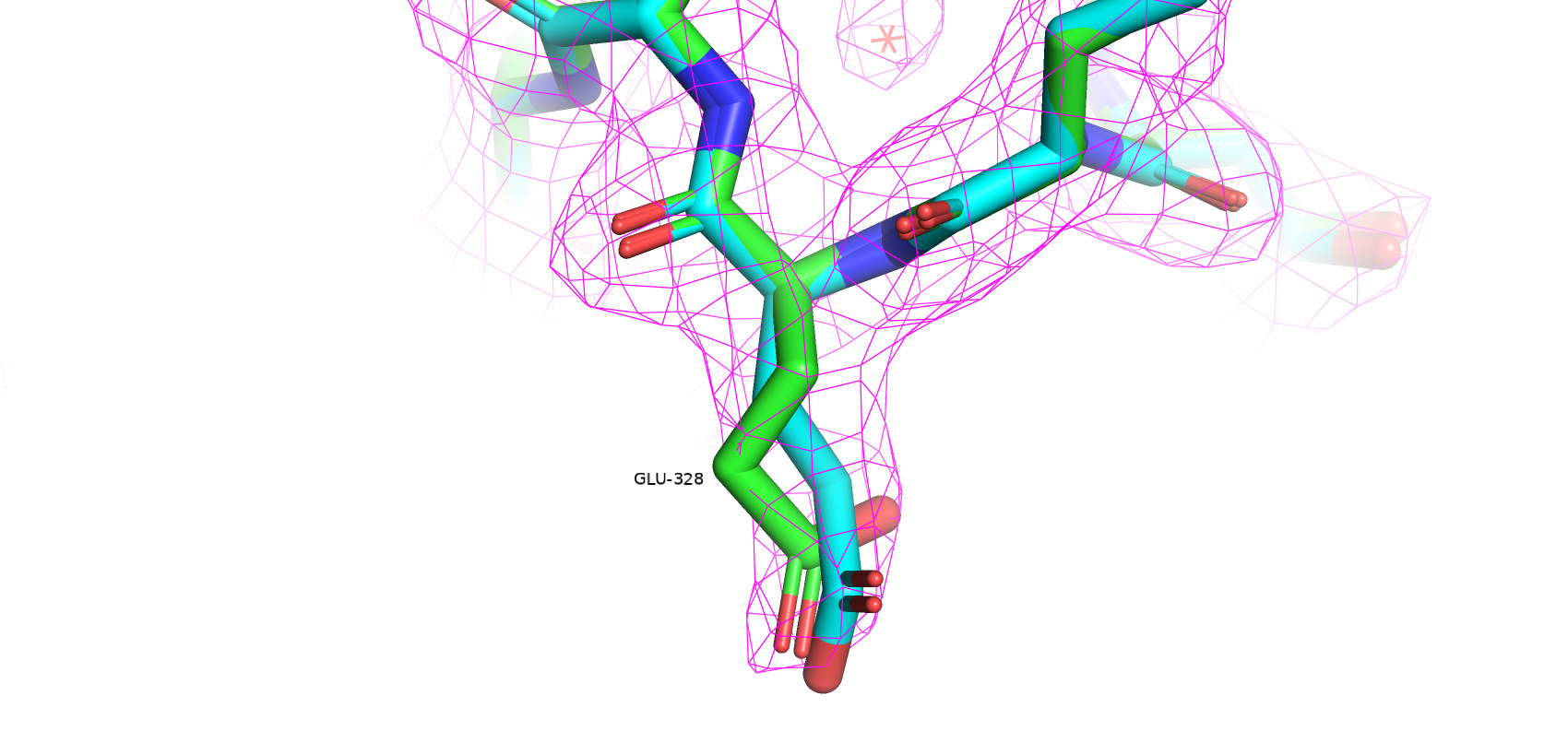
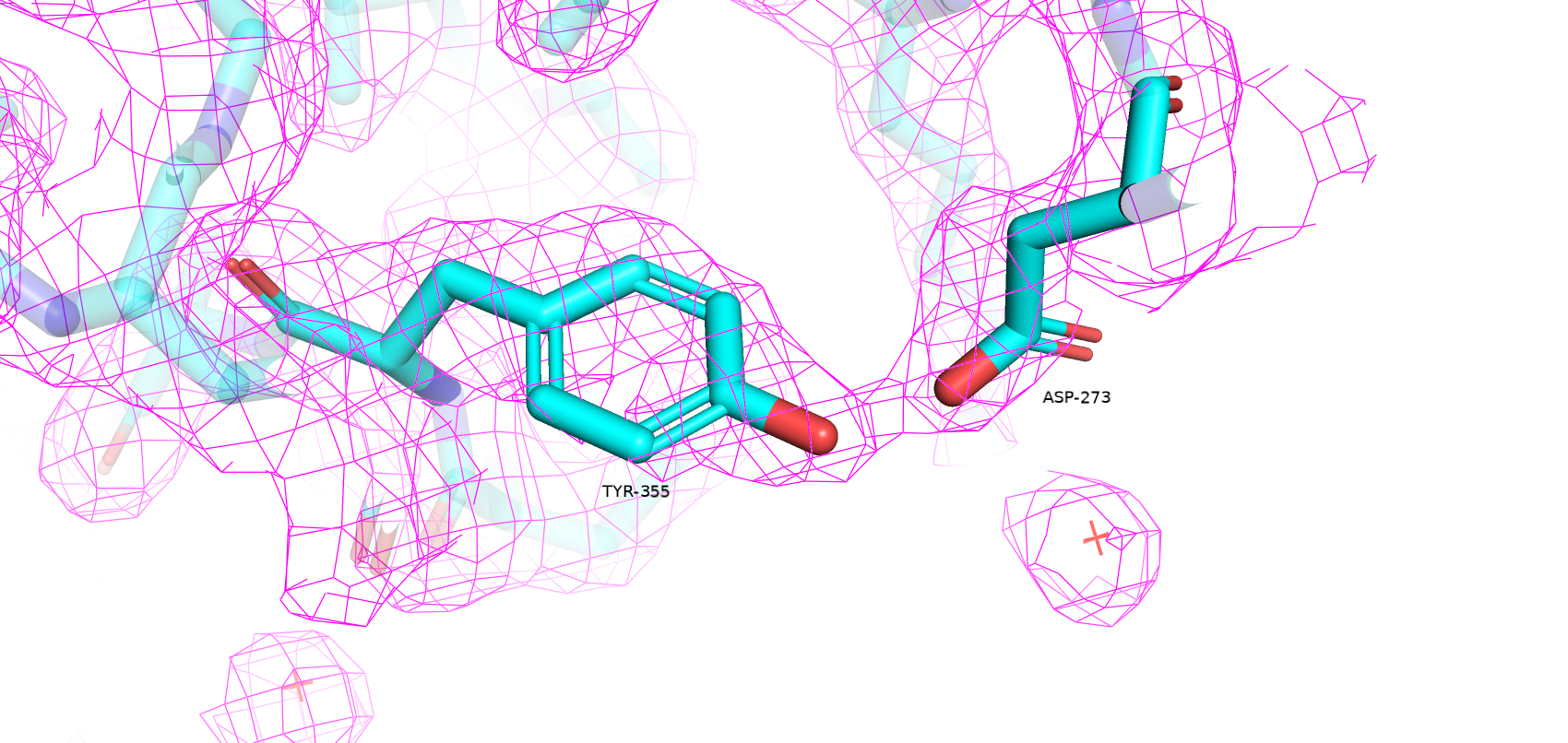
Таким образом, структура из PDBRedo значительно меньше маргинальных остатков, что может сделать её полезной для исследования данного белка.
Назад