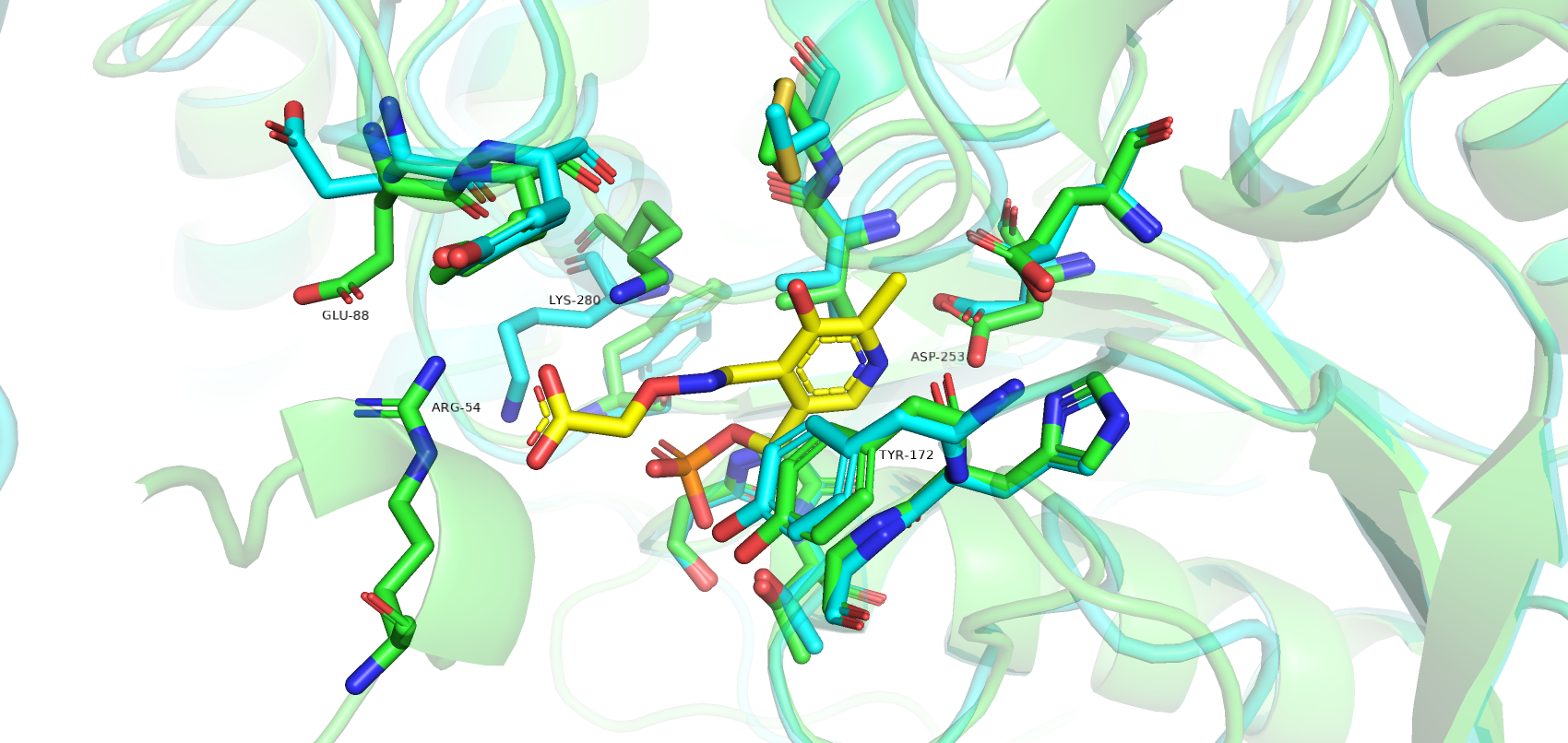
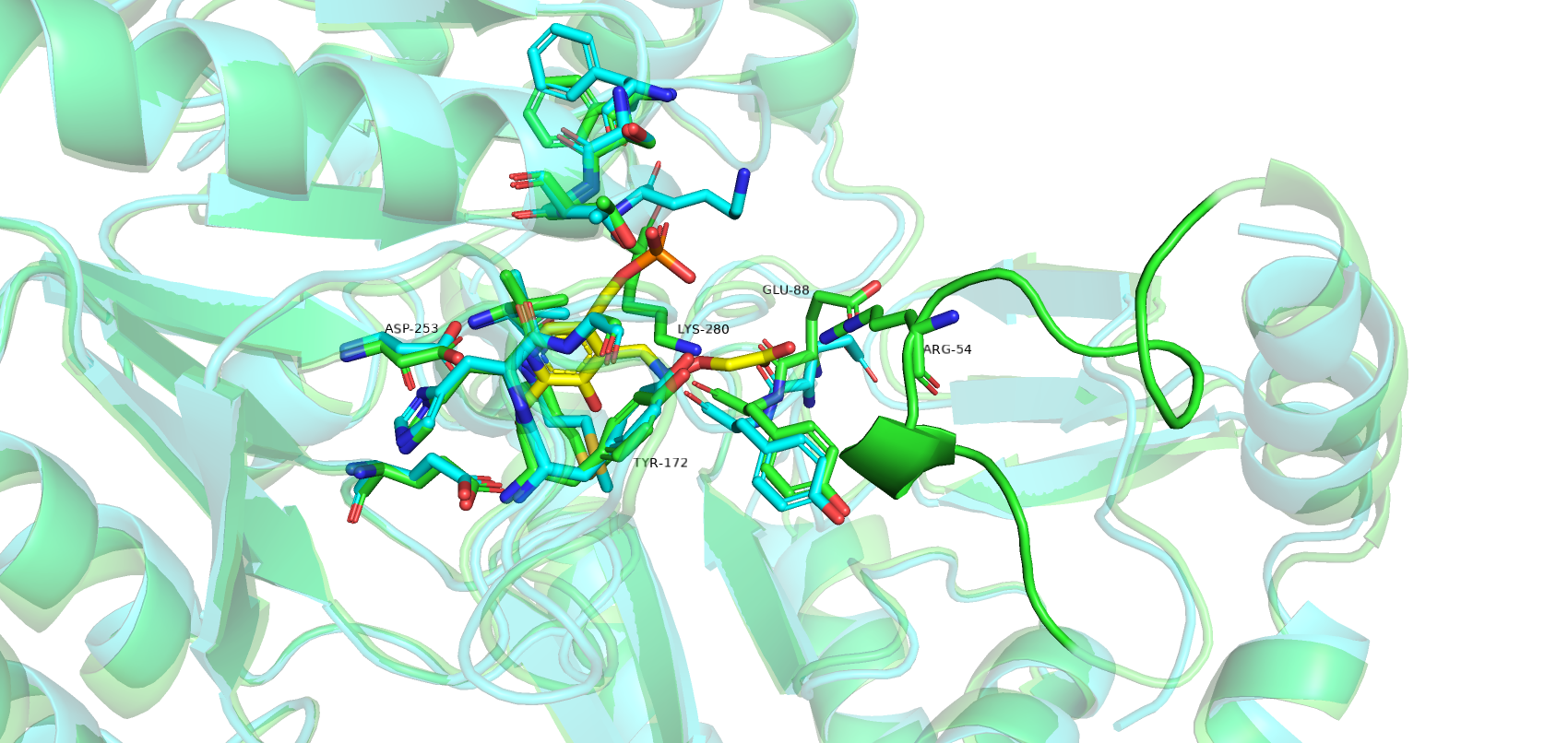
Были получены 2 структуры одного и того же белка в связанной с лигандом и свободной формах. Сравним положение остатков в кармане связывания в двух формах (рис.1). Голубым цветом покрашена свободная форма, зеленым - связанная, желтым окрашен лиганд. Больших изменений в положениях аминокислот при сравнении 2 структур не наблюдалось (большинство подвижны в пределах 1-2 Å). В структуре без лиганда, в отличие от связанной структуры, отсутствует участок с 48 по 59 остаток (рис.2). Этот участок играет важную роль в связывании лиганда (например, остаток Arg-54). Отсутствие данного участка в свободной форме может указывать на его большую подвижность, когда лиганд не связан.


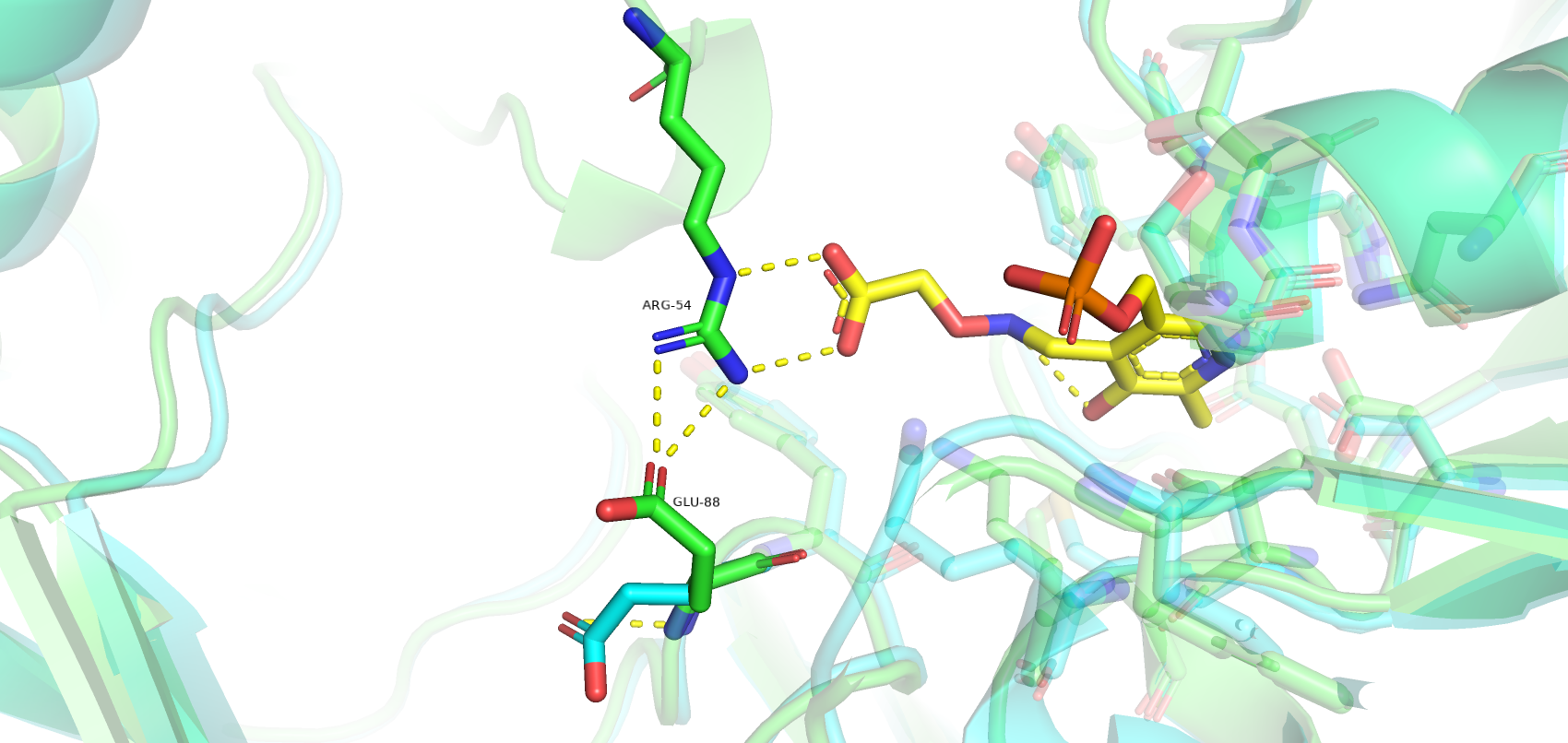
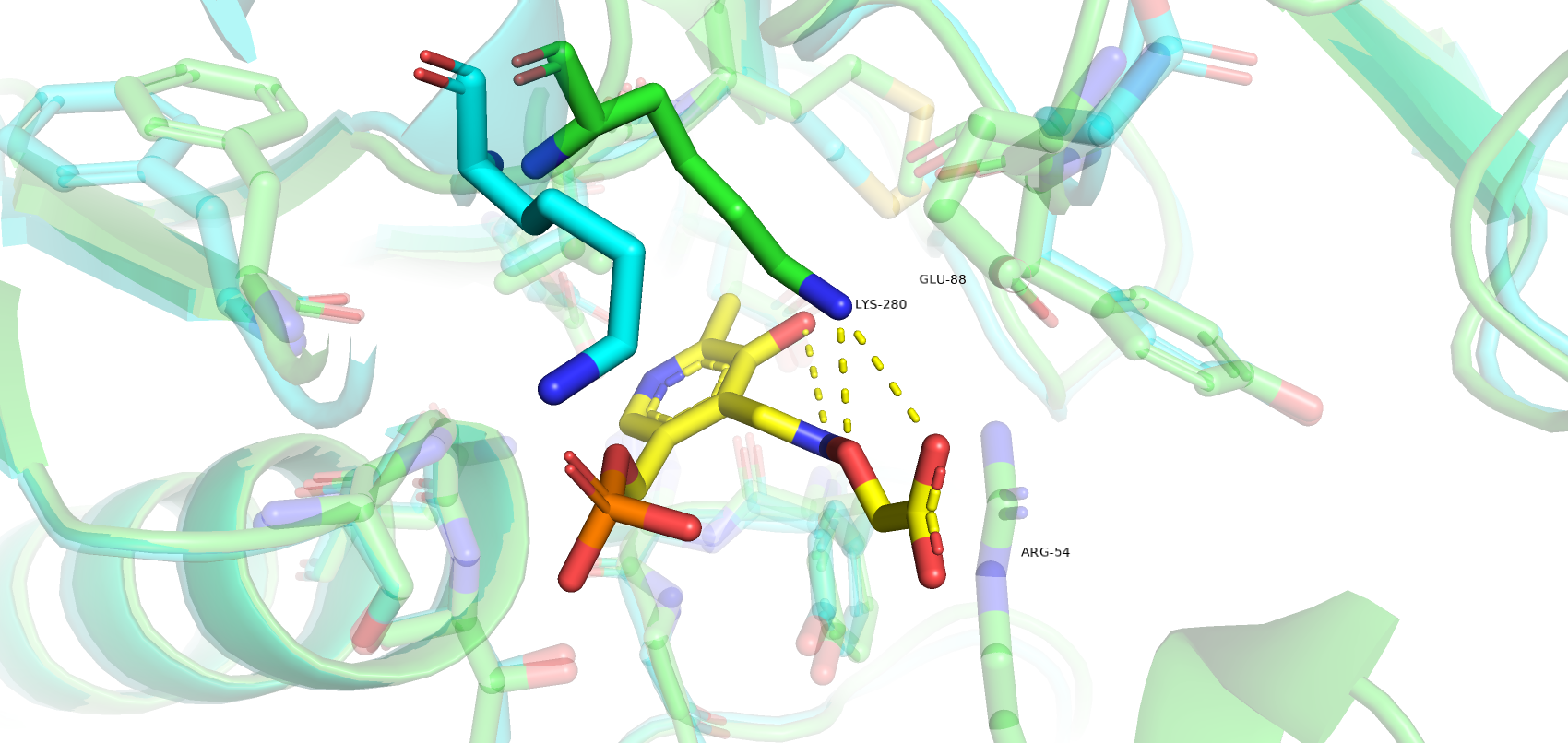
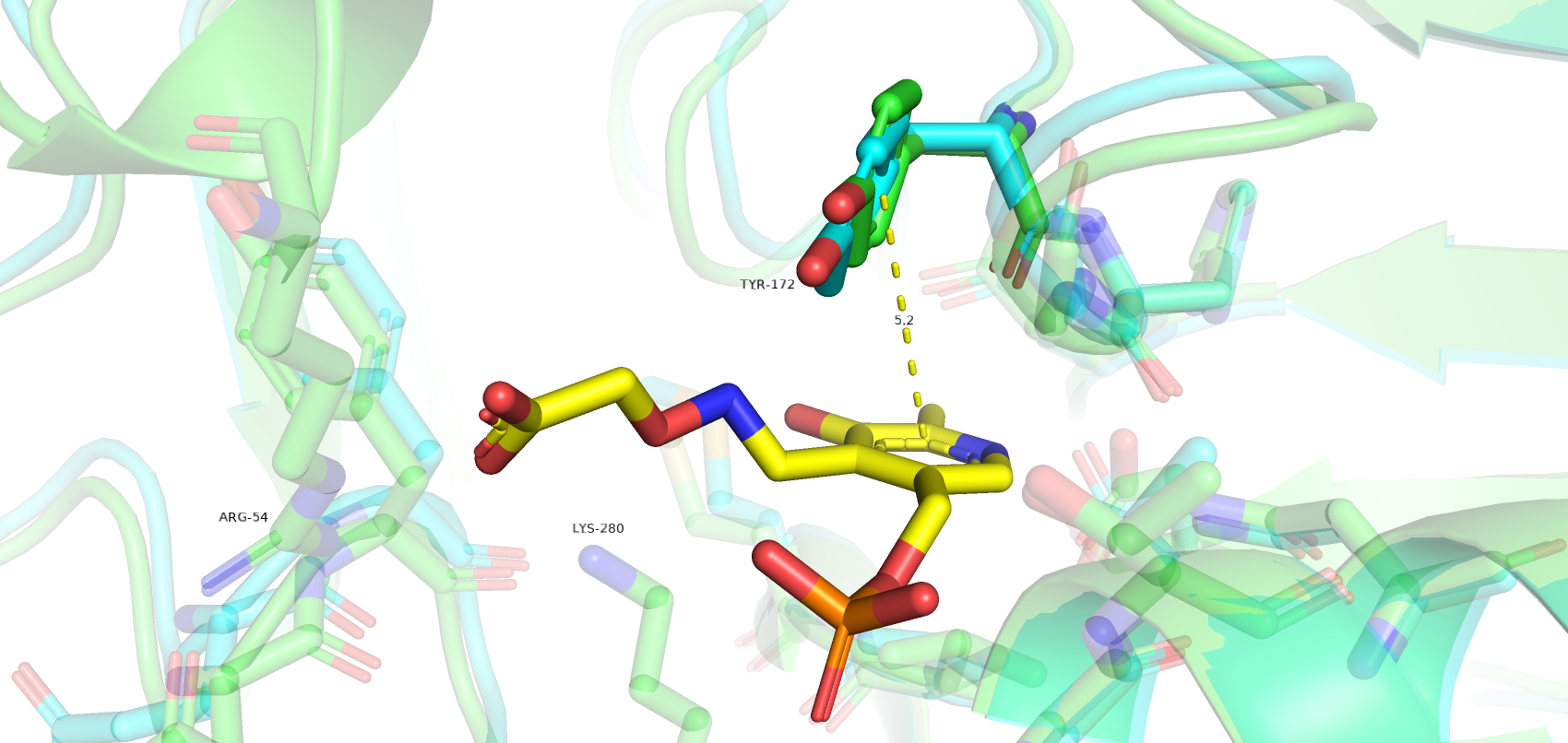
Однако есть остатки, которые значительно поменяли своё положение при связывании лиганда. Так, Glu-88 в закрытой форме меняет свою конформацию, образуя водородные связи с Arg-54, который, в свою очередь, связывается с карбоксильной группой лиганда. Такое взаимодействие двух остатков, возможно, удерживает петлю в правильно положении при связывании лиганда. Остаток Lys-80 также значительно меняет свое пространственное положение, образую водородные связи с кислородами лиганда. Tyr-172 имеет т-стекинг взаимодействие с ароматическим кольцом лиганда.
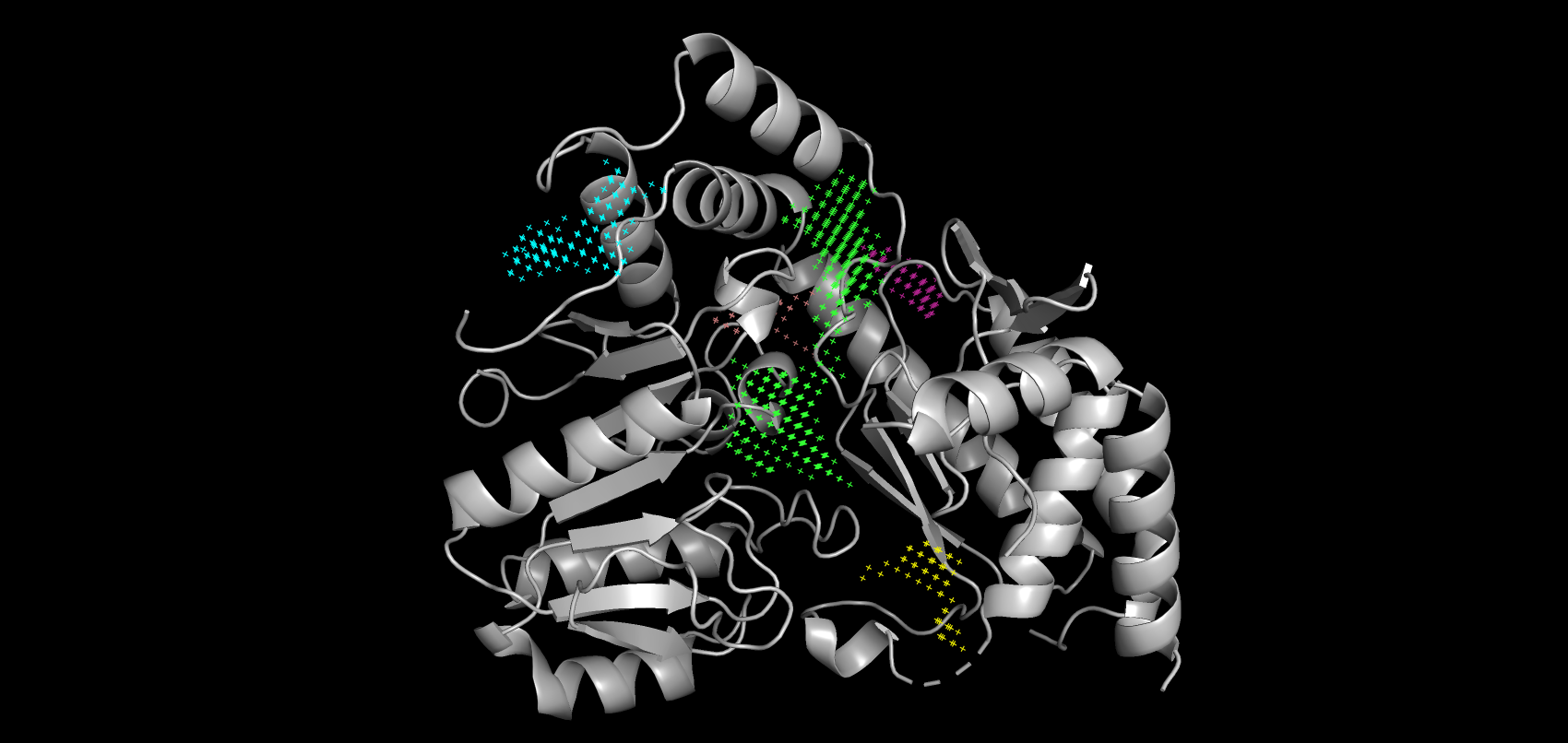
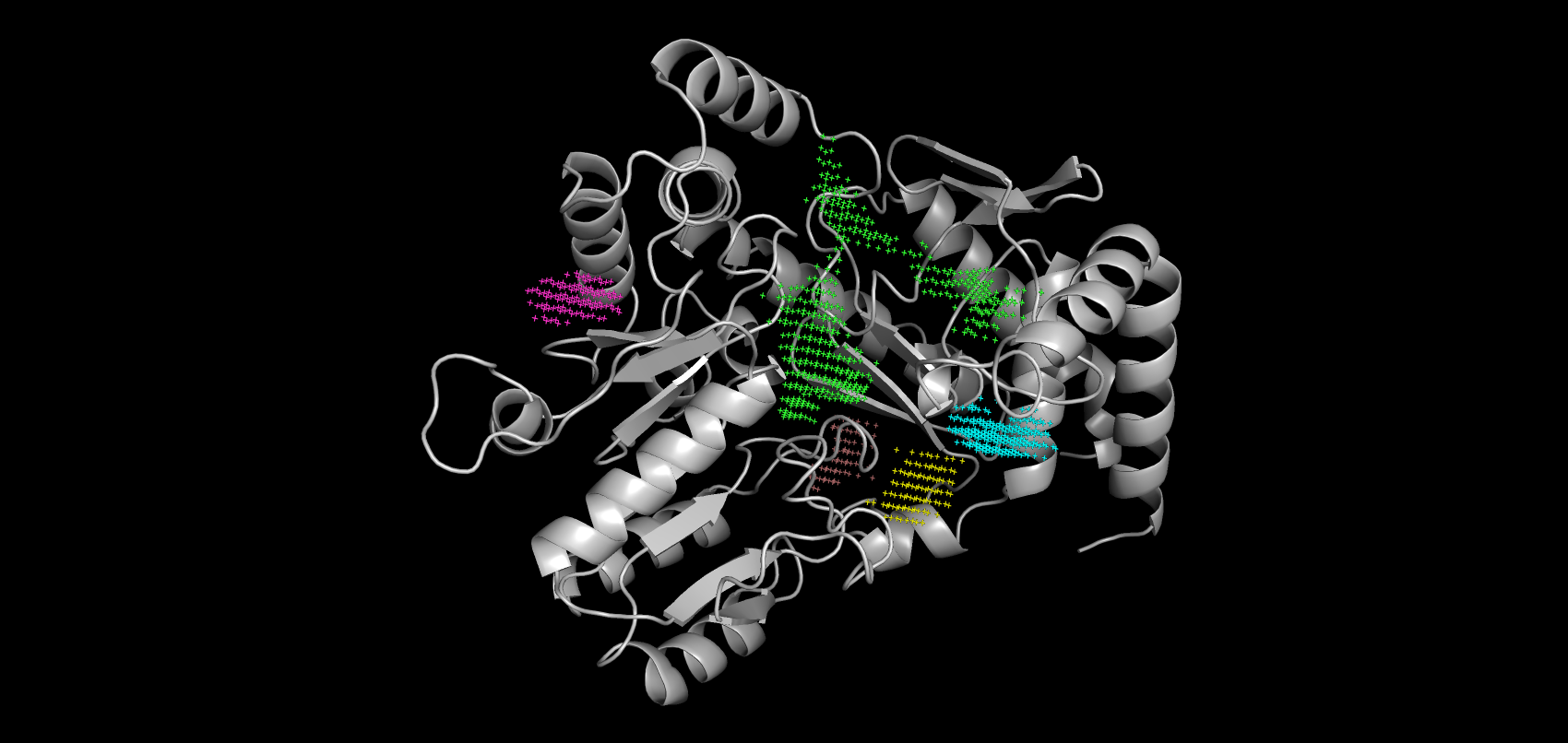
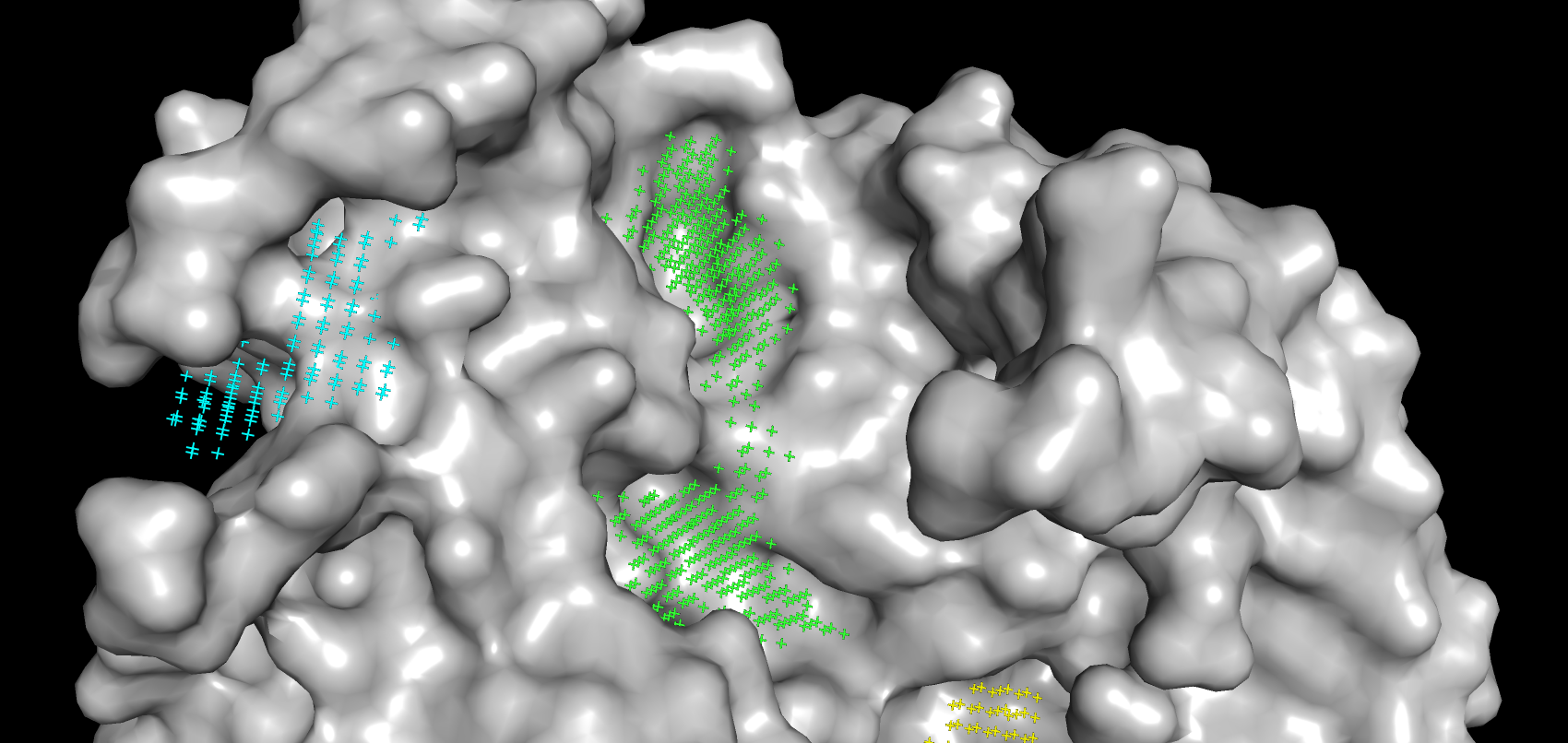
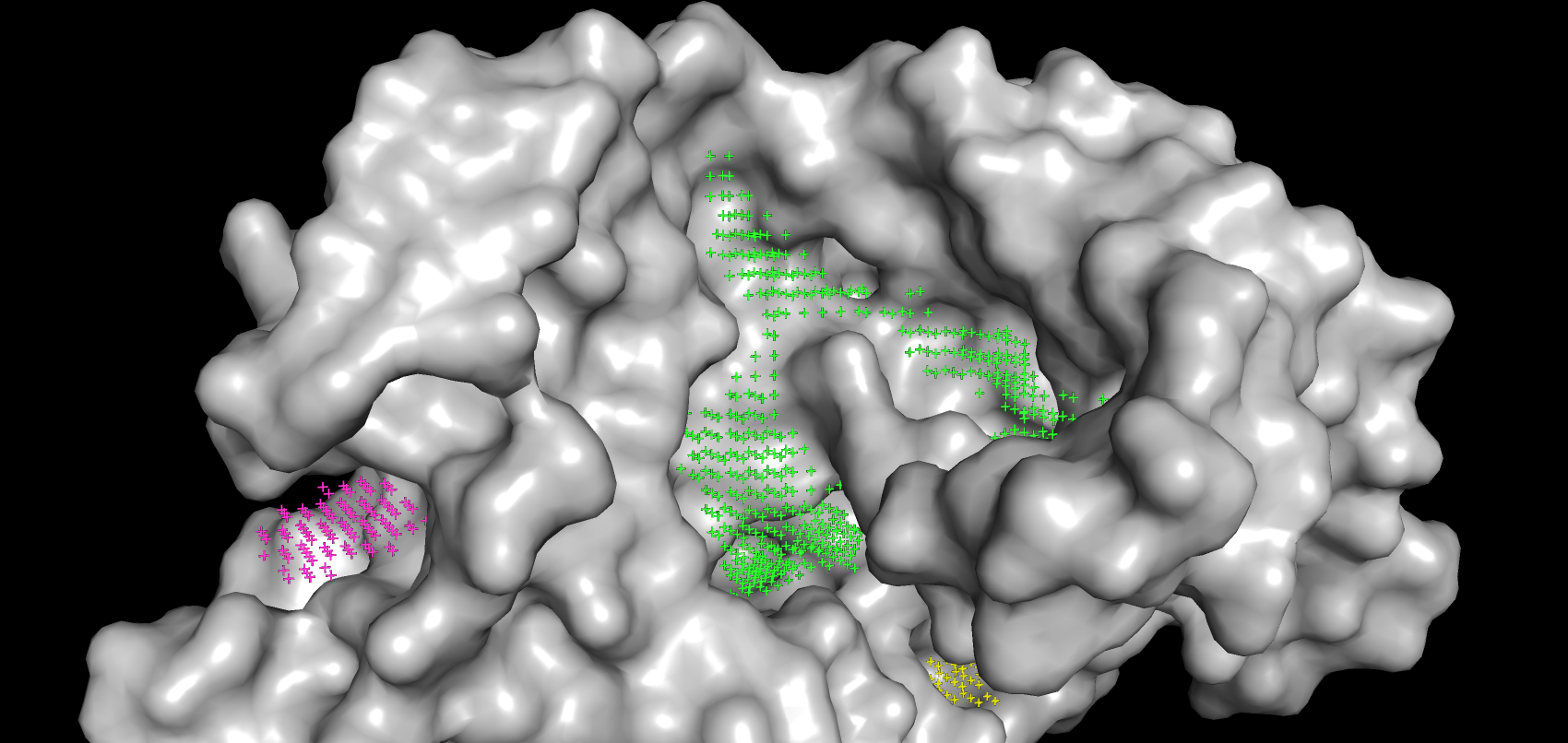
В результате работы сервиса POCASA были получены возможные карманы связывания для свободного белка и связанной с лигандом структуры, но без самого лиганда. По убыванию объема они покрашены в зеленый, голубой, розовый, желтый и бледно-розовый. Объем самого большого кармана, который связывает лиганд, незначительно увеличился в "закрытой" форме (с 455 до 459). На рисунках 8-9 видно, что петля с 48 по 59 остаток и, входящий в нее Arg-54, ограничивают карман от остальной поверхности белка. Таким образом, о "стягивании" аминокислот можно говорить только применительно к фиксации вышеупомянутой петли в пространстве. Изменения положений остальных аминокислот при связывании белка незначительны.
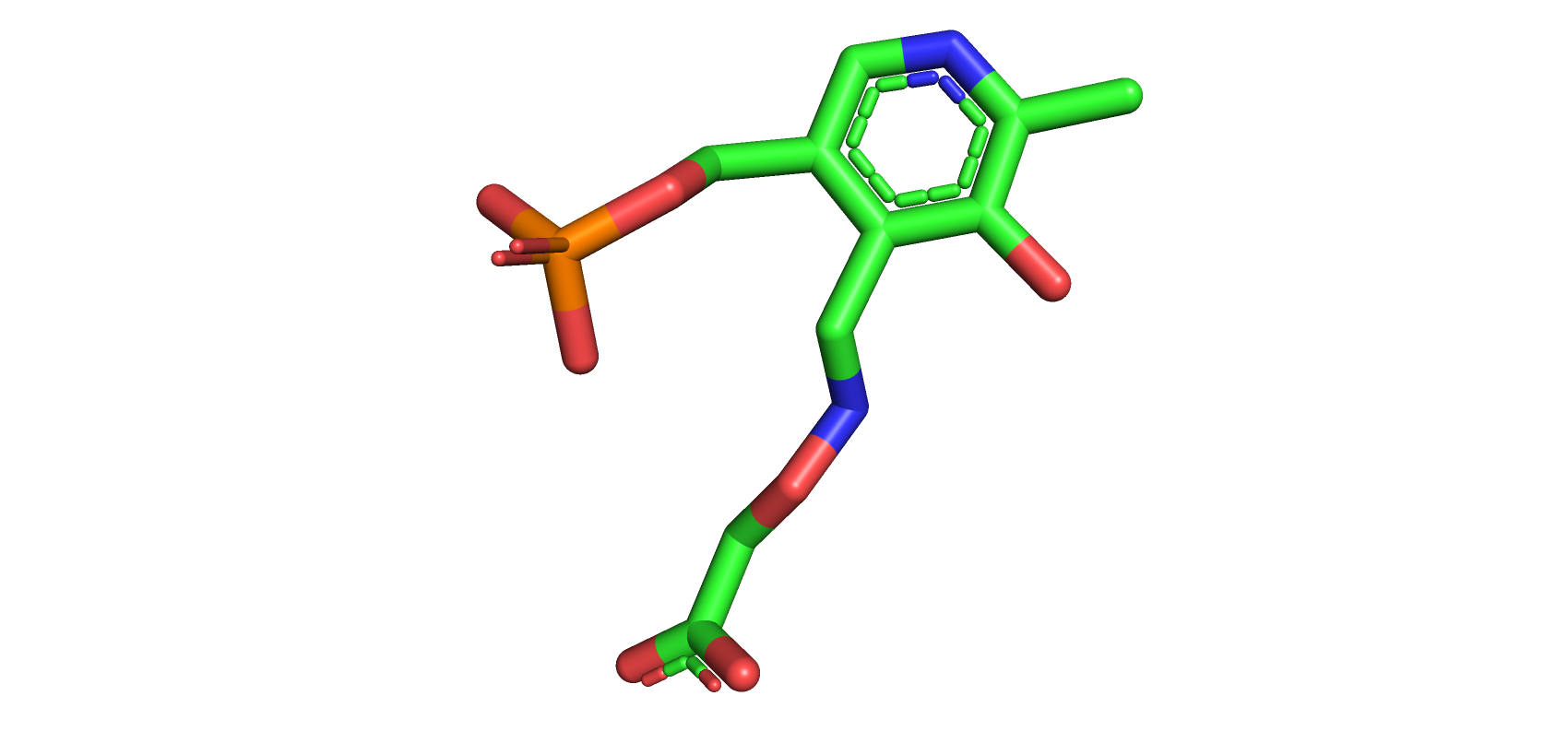
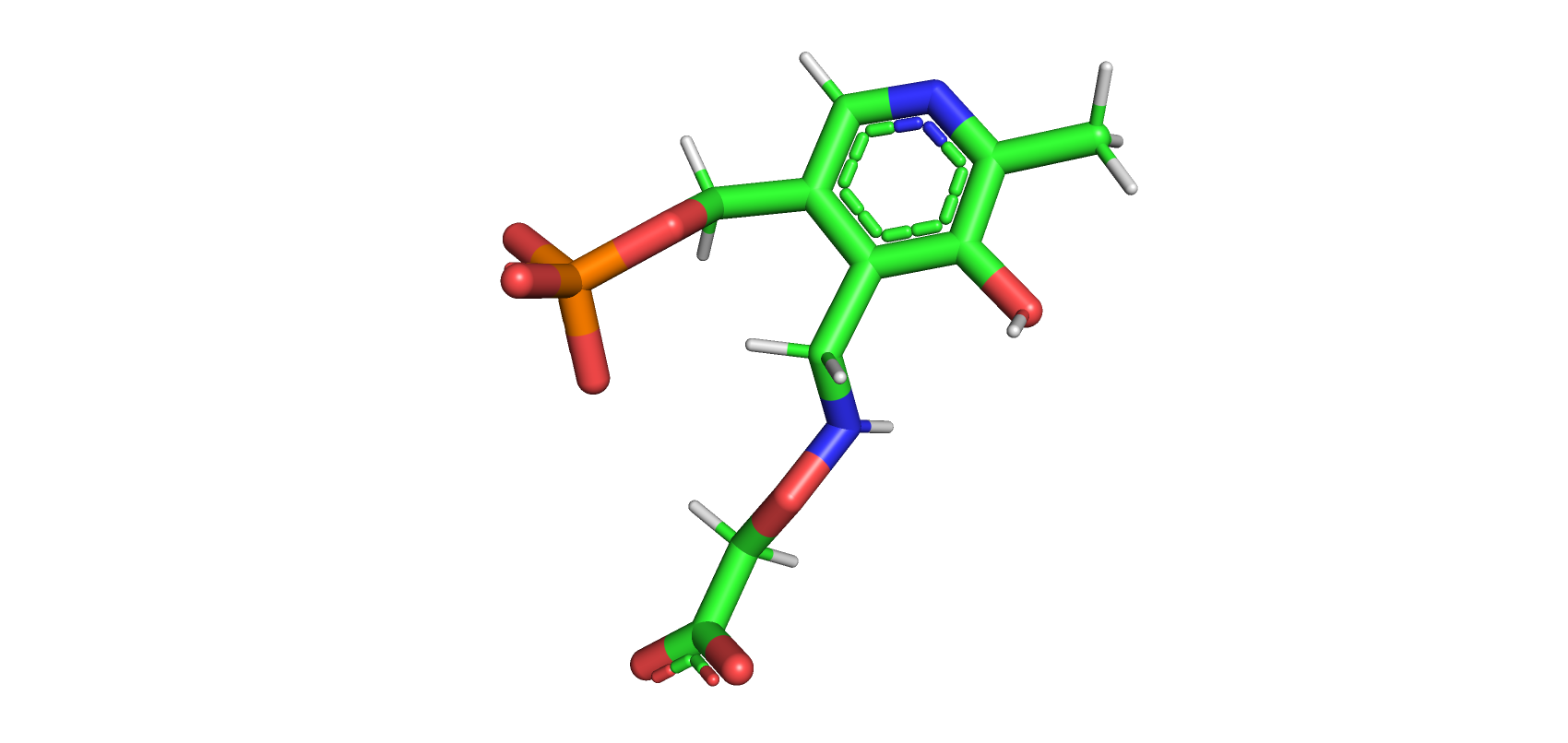
Перед докингом необходимо запротонировать белок и лиганд. Для протонирования белка использовался сервис PDB2PQR, а для лиганда программа SPORES. Структура лиганда до и после добавления водородов на картинках ниже.
Затем с помощью сервиса Webina был проведен докинг открытой формы белка и лиганда. Всего было получено 9 положений лиганда в кармане связывания. Лиганд окрашен желтым, а новые позы - голубым.
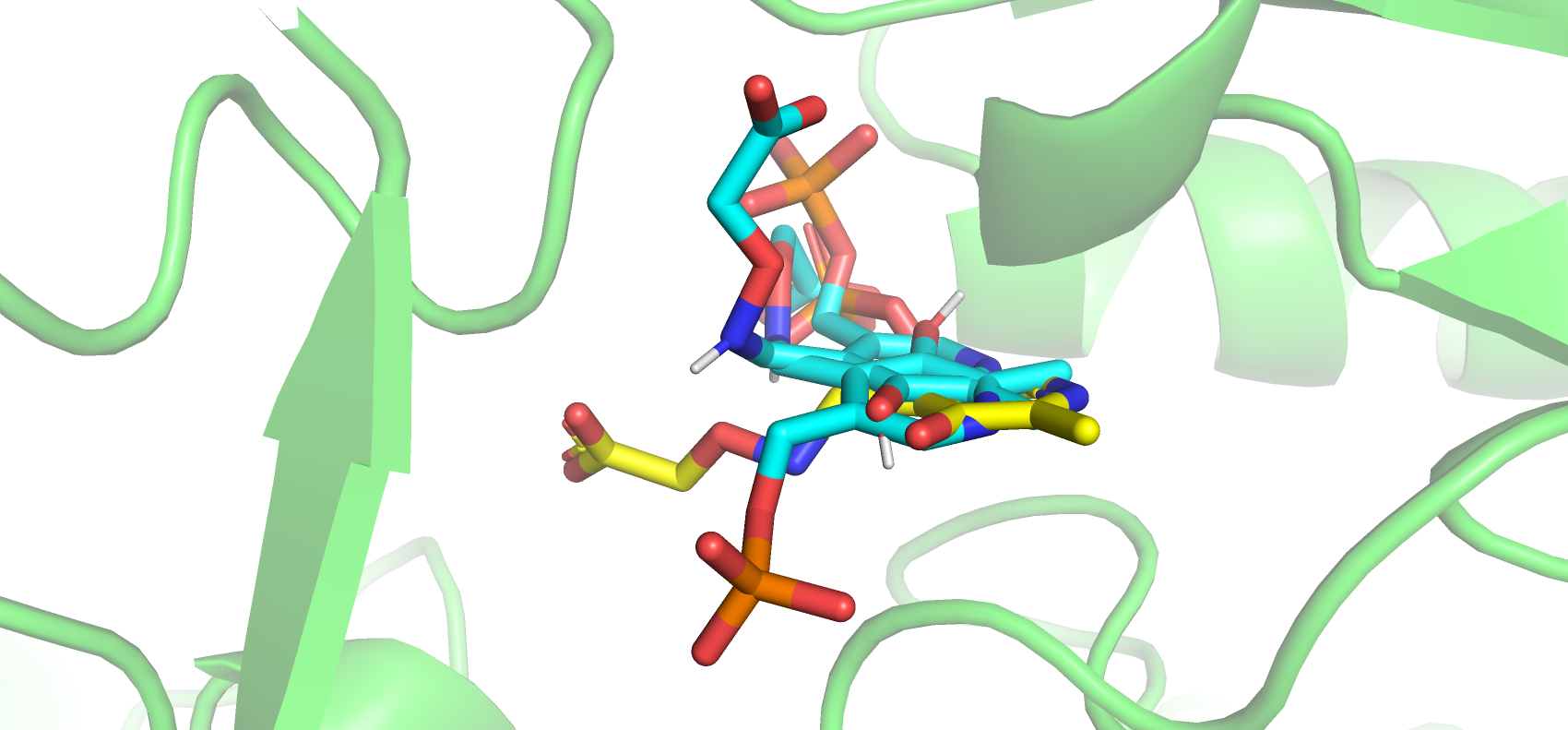
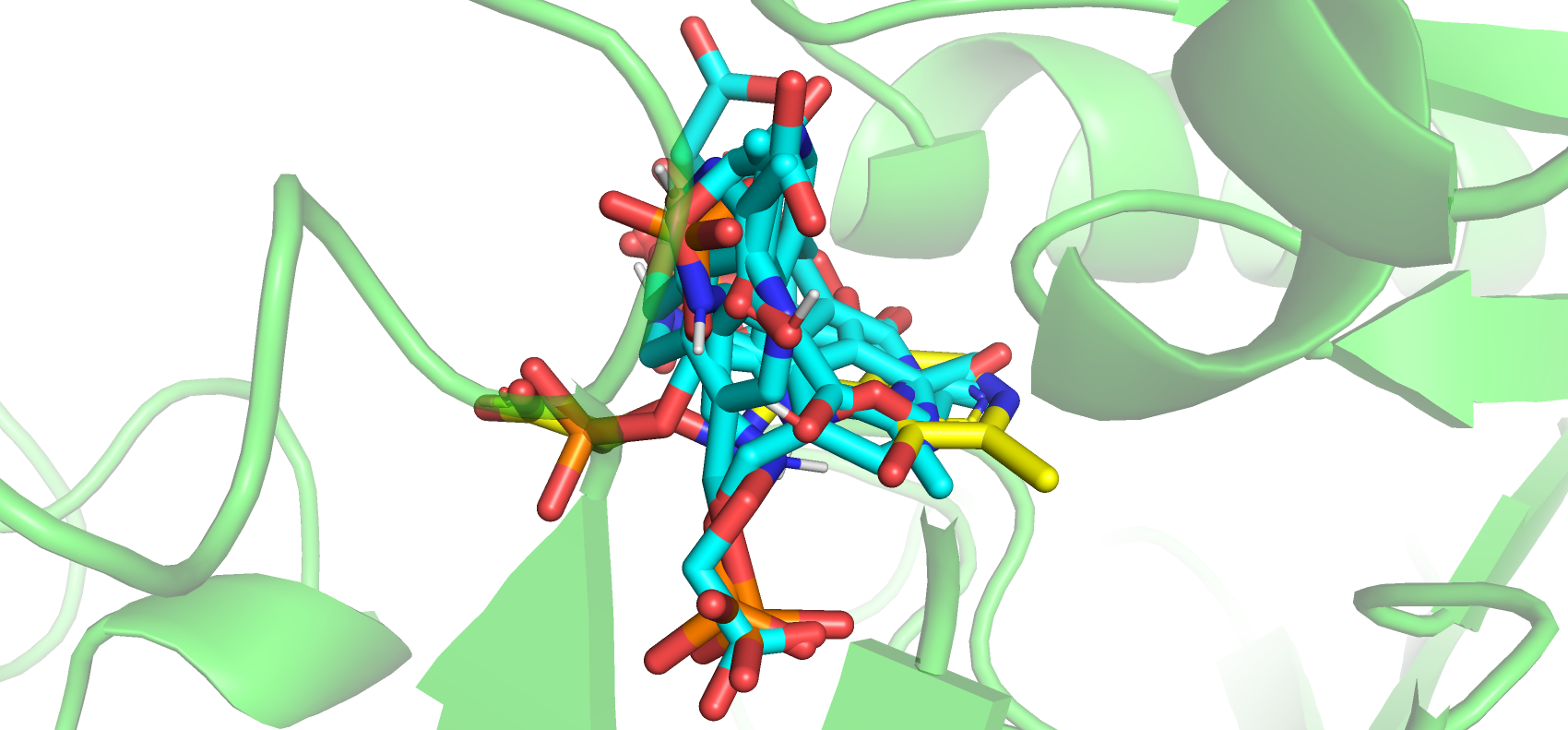
В целом полученные позы заметно отличаются от истинной, хотя для первых 3 поз примерно совпадает положение ароматических колец. Это вероятнее всего связано с отсутствием важных для связывания лиганда петли остатков 48-59 в свободной форме белка. Затем была получена визуализация всех взаимодействий между истинной позой лиганда и белком в закрытой форме и лучшей полученной формой лиганда и открытой формой.
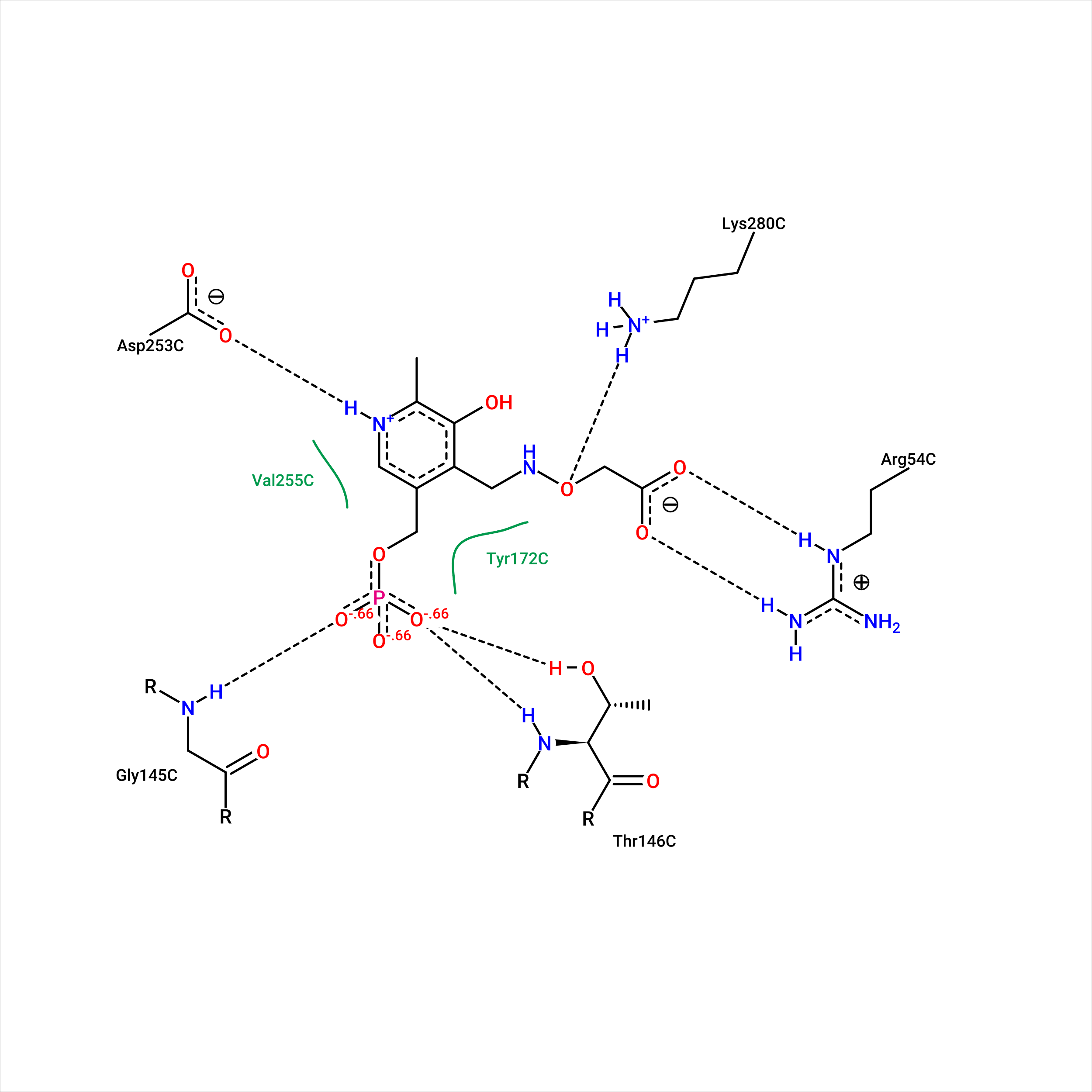
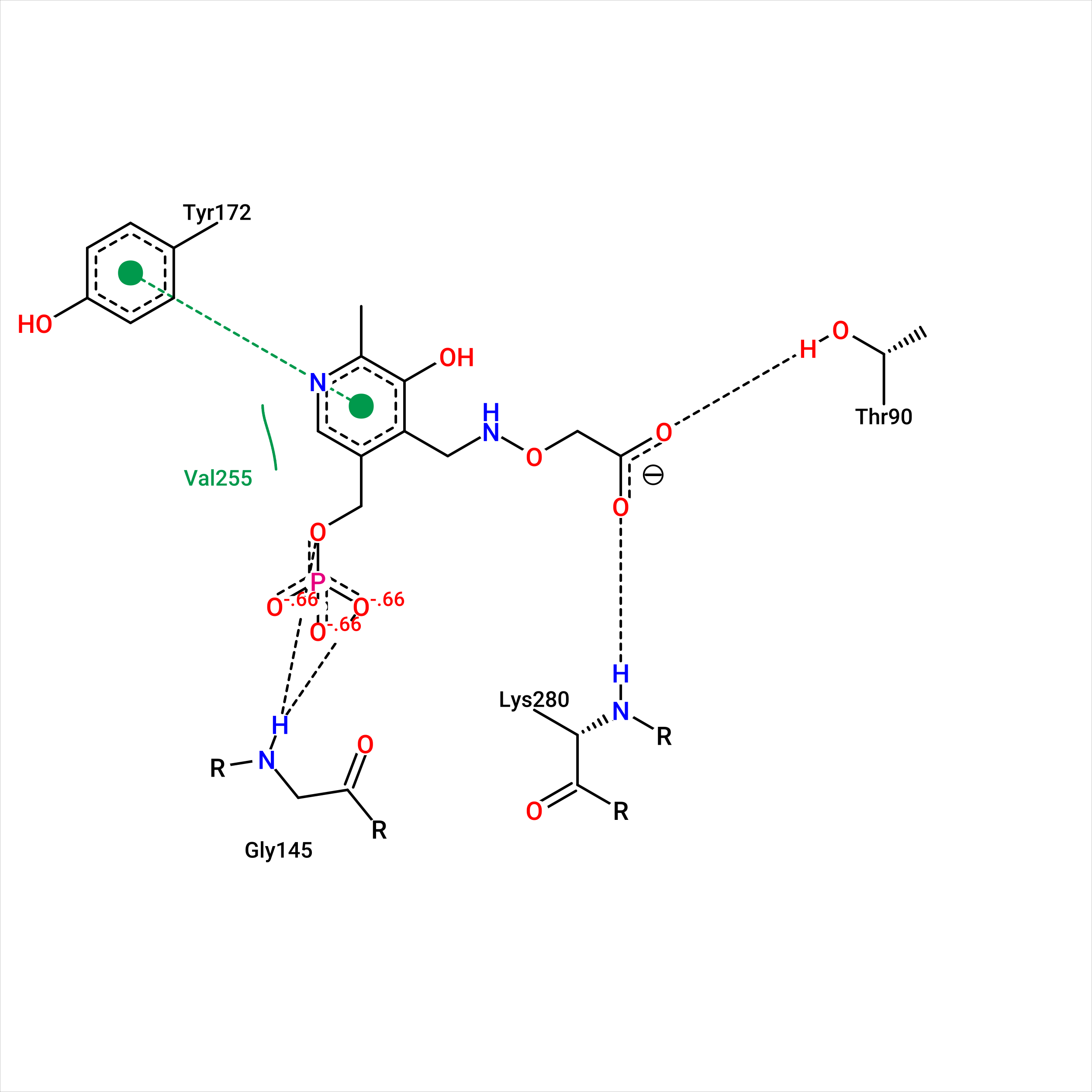
В обоих случаях есть водородные связи с Lys-280 и Gly-145, а также гидрофобные или стекинг взаимодействия с Tyr-172 и Val-255. Можно утверждать, что данные 4 остатка, а также Thr-146 и Asp-253 являются якорными и задерживуют диффундирующий лиганд, тем самым инициируя замыкание дополнительных связей. Так, происходит изменение положения петли остатков 48-59 и фиксирование положения Arg-54, благодаря изменению конформации Glu-88, что обеспечивает успешное связывание лиганда в кармане. Таким образом, можно говорить об эффекте индуцированного соответствия.
Назад