
В результате работы сервиса 2StrucCompare была получена аннотация вторичной структуры белка за счет работы алгоритмов DSSP и Stride. Так как с PDB ID из практикума 6 не работает алгоритм Stride, был взят третий PDB из 2 практикума (PDB ID: 7axk). Далее сравним выводы двух вышеупомянутых алгоритмов.

Различий оказалось не много, выдачи алгоритмов достаточно похожи. Рассмотрим некоторые различия более подробно.
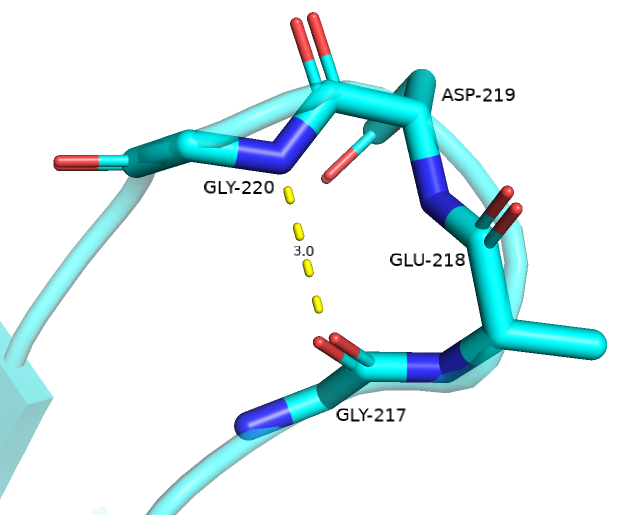
В первом случае позиции 217-220 Sride считает поворотом, тогда как DSSP нашел поворот на позициях 218-219 и bend (резкий поворот > 70°) на позиции 220. У алгоритма Stride отсутствует такой тип аннотации как bend, но если исходить из определения, он действительно там есть (поворот здесь почти на 90°). DSSP не включил в поворот Gly-217, хотя он образует важную для поддержания поворота водородную связь с Gly-220. Поэтому, в данном случае, я склоняюсь больше к аннотации Stride.
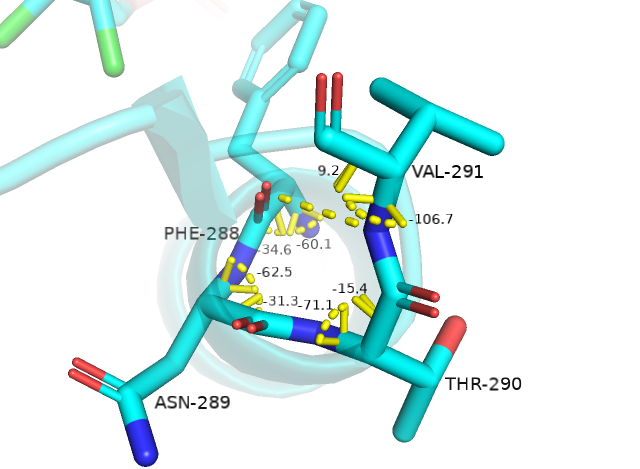
Во втором случае позиции 288-291 Stride считает альфа-спиралью, а DSSP относит остатки 290-291 к повороту. Были измерены углы ɸ и Ѱ для соответствующих остатков. Phe-288: ɸ=-60.1°, Ѱ=-34.6°; Asn-289: ɸ=-62.5°, Ѱ=-31.3°; Thr-290: ɸ=-71.1°, Ѱ=-15.4°; Val-291: ɸ=-106.7°, Ѱ=9.2°. Как видно, торсионные углы остатков 288 и 289 не соответствуют таким в альфа-спирали и, поэтому, могут считаться отстатками в составе поворота. Таким образом, в данном случае, я склоняюсь к аннотации DSSP.
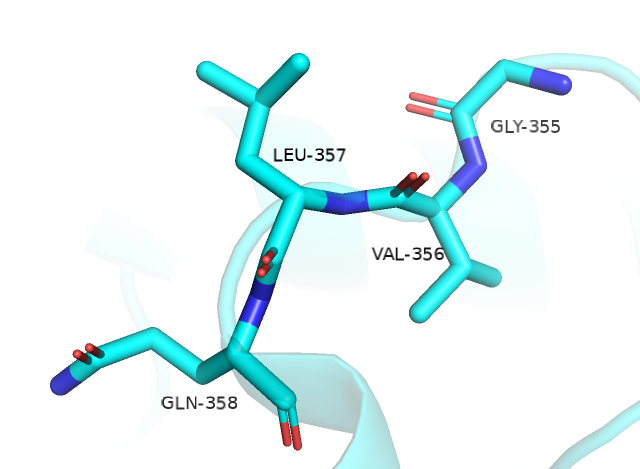
В последнем случае, Stride выделяет на позициях 355-358 поворот, тогда как DSSP считает участником поворота только остатки 354-355 и выделяет bend на позиции 357. В данном случае действительно есть bend (тут поворот больше, чем на 90°), однако отсутствуют водородные связи между остатками, которые могли бы удерживать поворот в пространстве. Поэтому, здесь я склоняюсь к аннотации DSSP, которая не указывала на поворот в данном месте. Возможно, Stride из-за определенной сложившейся комбинации торсионных углов сделал вывод о повороте в иначе неустойчивой вне кристалла петле.
Для исследования остатков, характерных для определенных вторичных структур, было проанализировано 30 белковых структур с разметкой DSSP. Склонность каждого аминокислотного остатка к образованию характерной вторичной структуры вычислялась по следующей формуле:
P_ik = (n_ik/n_i) / (N_k/N)
Где P_ik это propensity аминокислотного остатка i образовывать тип вторичной структуры j
n_ik это количество остатков i в датасете, образующих тип вторичной структуры j
n_i это общее количество остатков i в датасете
N_k это общее количество остатков, образующих тип вторичной структуры j во всем датасете
N это общее количество остатков в датасете
Была использована упрощенная классификация, при которой все, что не является бета-листом ('E') или альфа-спиралью ('H'), расценивается как петля ('C'). В итоге получилась сводная таблица (рис.5).
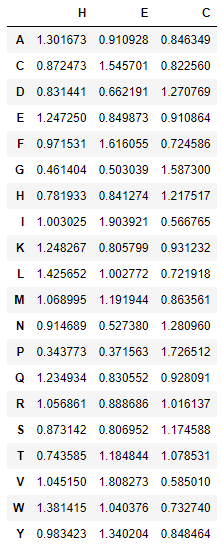
Из таблицы видно, что в альфа-спиралях чаще всего встречаются остатки лейцина, триптофана и аланина. В бета-листах самымим популярными являются изолейцин, валин и фенилаланин. Самыми частыми остатками в петлях являются пролин, глицин и аспарагин. Пролин часто встречается в петлях, т.к. не способен поддерживать вторичную структуру белка из-за отсутствия водорода у N и его не способность образовывать водородные связи. Глицин является небольшим и подвижным и поэтому склонен к образованию петель.
Назад