Целью данного практикума было исследование эффекта некоторых мутаций на структуру белка. Был выдан Rho-ГТФаза - активирующий белок золотой рыбки ( Carassius auratus ) A0A6P6KFY1 из Trembl и мутации для исследования - L411W, N400D и S285D.
С помощью Protein Blast по базе данных PDB для данного белка был найден самый близкий ортолог из другого организма. Им оказался Rho-ГТФаза-активирующий белок в комплексе с RhoA человека (PDB ID: 6R3V) с 61.34% совпадений. Нас интересует в данном случае цепь А (только активирующий белок).
Затем был проведен поиск позиций, в которых будет проводиться мутагенез. Остаток Leu-411 стал в PDB Leu-213, Asn-400 стал Asn-202, а Ser-285 - Ser-87.
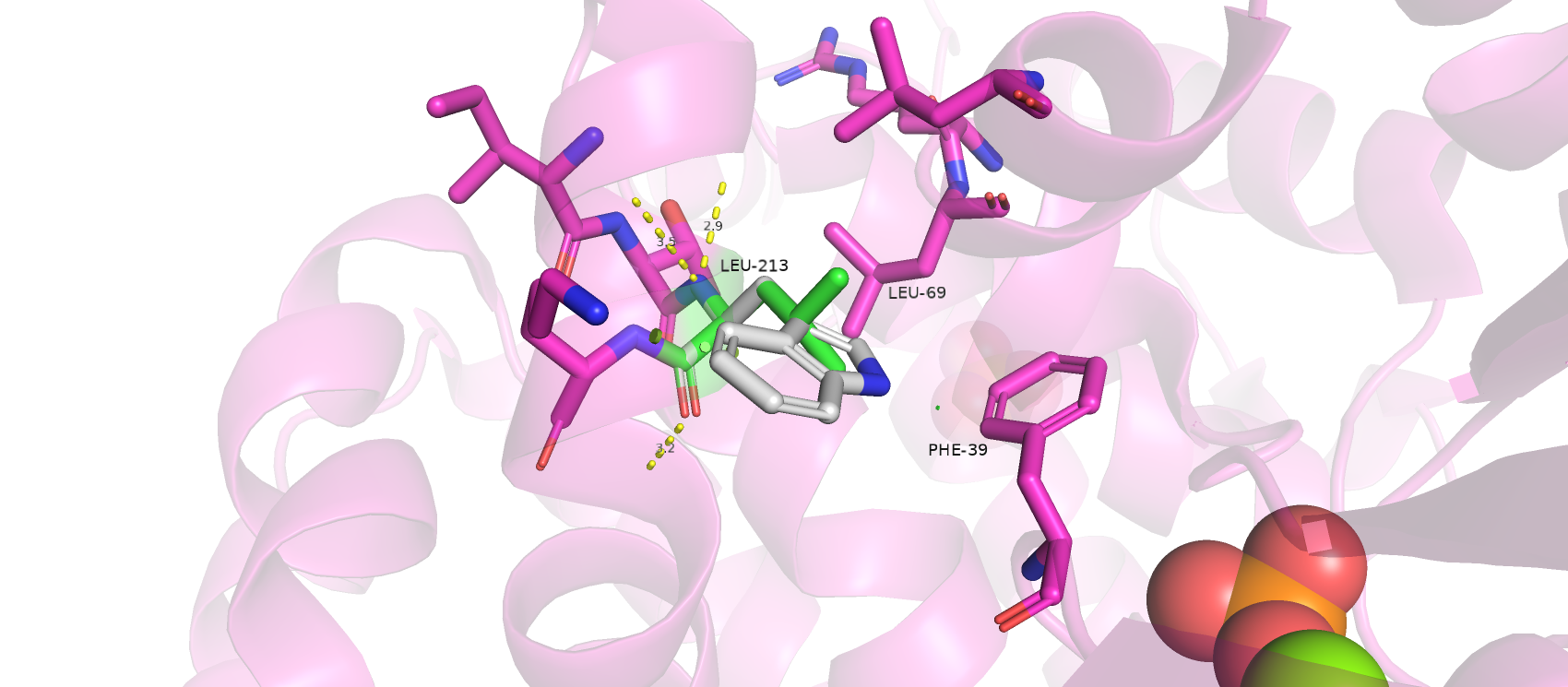
Leu-213 находится в альфа-спирали в месте плотных контактов (гидрофобных взаимодействий) с соседней цепью (ГТФ-азой RhoA). И лейцин, и триптофан являются гидрофобными соединениями, что позволяет сделать замену, не влияющую на укладку белка. Не смотря на то, что размер боковой цепи триптофана гораздо больше, чем у лейцина, в такой, казалось бы, плотной упаковке, нашлось место даже для такого большого радикала. Представленность самого лучшего ротамера - 26.9%, а strain - 23.36, что в пределах нормы.

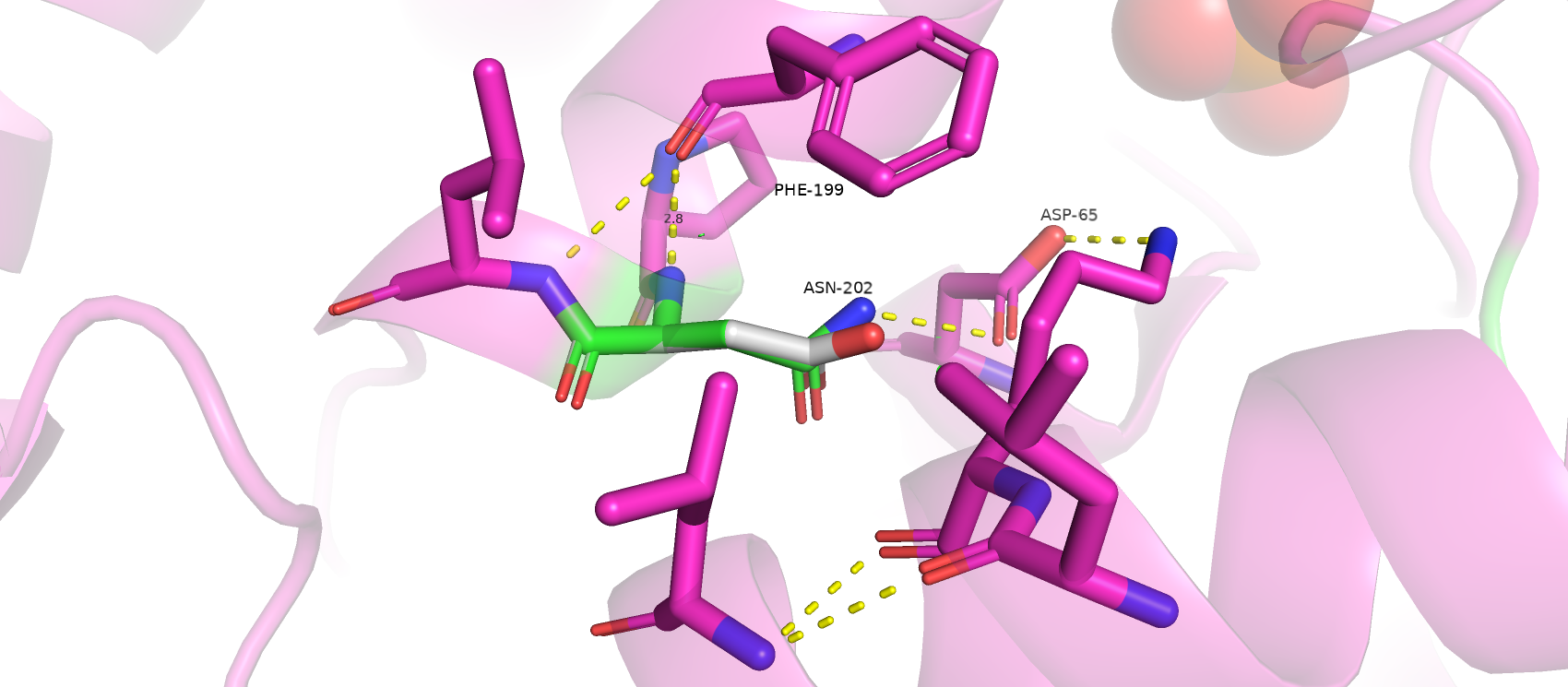
Asn-202 входит в состав альфа-спирали и имеет водородную связь атома азота боковой цепи с атомом кислорода радикала Asp-65 из соседней альфа-спирали. Замена Asn на Asp привнесет в место контакта большой отрицательный заряд, что станет причиной отталкивания. Атом кислорода нового Asp будет являться донором водородной связи только в условиях с низким pH. В большинстве же случаев связь с Asp-65 пропадет из-за отталкивания. Данные наблюдения не учитываются при подсчете strain, который оказался достаточно низким - 17.53 (представленность ротамера - 34.7%).
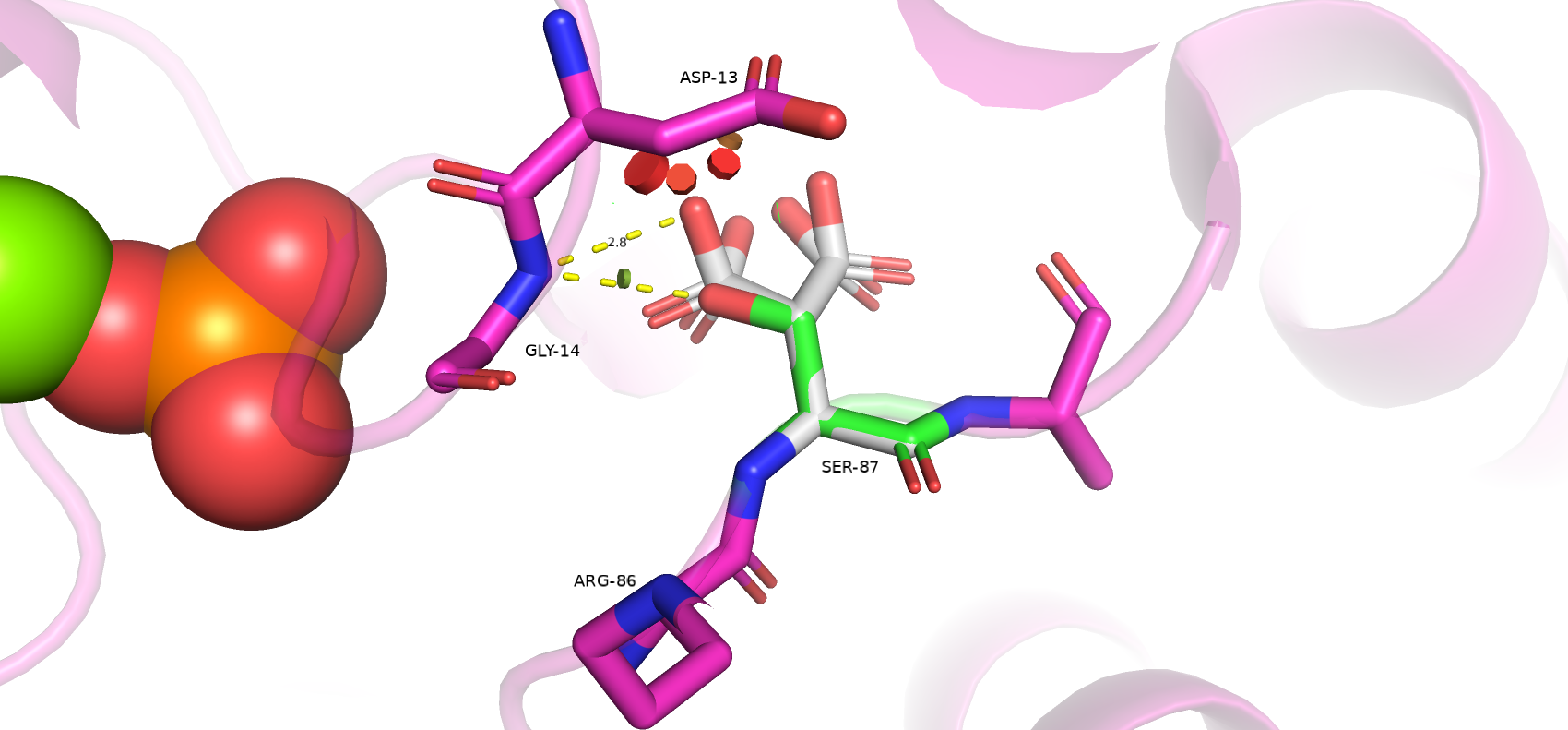
Ser-87 расположен в одной из петель белка и имеет водородную связь через свой атом кислорода радикала с азотом Gly-14. С первого взгляда замена Ser на Asp может показаться синонимичной. Это подтверждает и то, что strain 7 из 9 предложенных ротамеров < 25. Однако представленность подходящих ротамеров достаточно мала (< 19%). Такая замена также лишь в двух случаях дает водородную связь с Gly-14. Это важно, так как петля, в которой находится глицин непосредственно контактирует с лигандом, и положение этой петли в пространстве важно для его связывания. На рисунке ниже показаны 4 ротамера - 2 образующих нужную связь (смотрят влево) и 2 образующих водородные связи с другими остатками (смотрят вправо). Для двух левых ротамеров strain - 10.75 (для ротамера со связью длиной 2.8) и 6.95, а представленность - 19% и 1.4% соответственно. Наличие полного отрицательного заряда при замене на Asp также может спровоцировать отталкивание, например от близкорасположенной боковой группы Asp-13, что также может повлиять на укладку петли с Gly. Таким образом, замена Ser на более реакционно-способный Asp далеко не во всех случаях приведет к правильной укладке белка.