Практикум 6.
1.Получение последовательностей белков и построение множественного выравнивания
Исходный белок - AC UniProt B4EY22_PROMH, PDB Id - 2WSW.
Параметры выборки: поиск по БД UniProt Clusters на уровне идентичности 50%
Число находок = 200
e-value худшей находки 8.3E-53
Множественное выравнивание было построено программой MUSCLE.
Выравнивание само по себе было не очень хорошим. Я удалила 11 слишком коротких белков с большим количеством гэпов в консервативных местах, и еще несколько плохо выровненных с остальными.
Ссылка на выравнивание в формате FASTA
Затем я связала исходный белок с его 3D структурой и разметила вручную его трансмембранные участки в строке разметки TM_REAL (помечены буквой M). Хочется заметить, что в JalView это делать крайне неудобно.
Далее я сделала предсказание трансмембранных спиралей программой TMHMM для белка UniRef50_F4BKW0 (один из гомологов исходного белка, взят из множественного выравнивания). Затем вручную разметила предсказанные трансмембранные участки в строке разметки TM_PREDICTED (помечены буквой M).
В качестве цветовой схемы я выбрала раскраску по гидрофобности (Hydrophobicity) с порогом консервативности 10% (порог я подбирала экспериментально, чтобы окраска не была слишком тусклой, но при этом сильно консервативные места визуально легко отличались от менее консервативных). При этой раскраске гидрофобные а.о. выделены красным цветом, гидрофильные незаряженные - фиолетовым, гидрофильные заряженные - синим.
Ссылка на проект JalView с выравниванием
Также я получила требуемое изображение исходного белка:
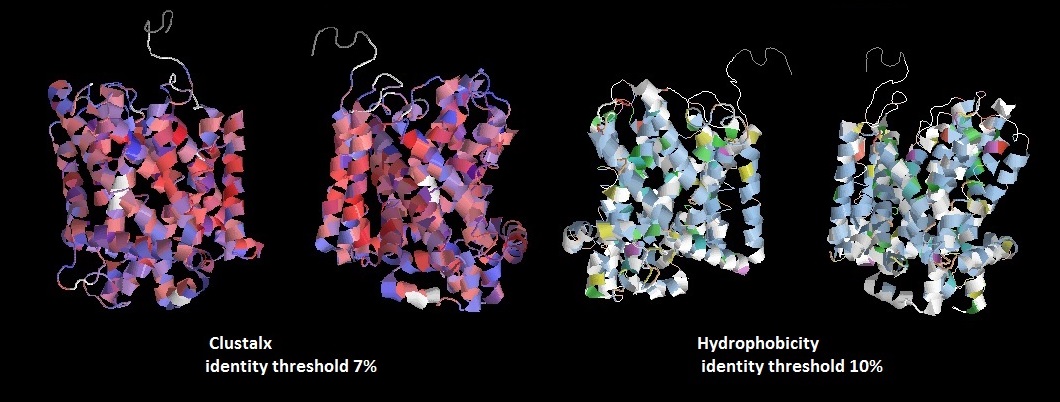
Рис.1 3D структура исходного белка (PDB Id - 2WSW). Ориентация P-стороной вниз (inside вверху, outside внизу). Раскраска на первых двух изображениях - Hydrophobicity (гидрофобные а.о. - красные, гидрофильные незаряженные - фиолетовые, гидрофильные заряженные - синие)
Раскраска на последних двух изображениях - Clustalx (порог консервативности 7%, гидрофобные а.о. - голубые, положительно заряженные - красные, отрицательно заряженные - лиловые, гидрофильные незаряженные - зеленые, желтый - пролин).
На изображении видно, что большая часть белка представляет из себя трансмембранные альфа-спирали. P- и n-стороны белка я определила исходя из присутствия положительно и отрицательно заряженных а.о. (результаты совпади с предсказанием TMHMM для гомолога данного белка).
В трансмембранных спиралях данного белка присутствует небольшое количество консервативных заряженных и полярных остатков, например, Glu 111 (обращен внутрь отверстия канала), Ser 332 (взаимодействует с гидрофильными остатками другой альфа-спирали внутри белка), и др.
В данном белке большая часть аминокислотных остатков, входящих в состав трансмембранных спиралей, относительно консервативна, особенно это касается ТМ в середине последовательности белка. Трансмембранные участки в целом существенно более консервативны, чем цитоплазматические и наружные (пример на рис.2). В составе ТМ чаще всего встречаются L,I,V,A,Y,G,F, реже T, S и другие гидрофильные а.о.

Рис.2 Часть множественного выравнивания, сравнение консервативности трансмембранных и цитоплазматических участков. Раскраска Hydrophobicity, порог консервативности 15%.
На качественном уровне нанесения результатов программы TMHMM и реальной структурной информации на выравнивании совпадают. TMHMM нашел все реально существующие спирали. Предсказанные границы не всегда совпадают с реальными, но здесь еще нужно учитывать, что предсказание делалось для гомолога данного белка, а не для него самого. В целом предсказание весьма хорошее.