Посмотреть все отдельные структуры биомолекулы можно по ссылке в сопроводительных материалах.
- Внутрибелковые контакты
Для начала была измерена средняя длина водородных связей. Для этого при помощи программы Jmol был получен список длин всех водородных связей, а потом посредством программы, написанной самостоятельно на языке Python, было посчитано среднее значение, оно составило 2.145 Å.
После изучения всей биомолекулы было получено то, что в ней нет бета листов, но зато почти все аминокислотные остатки расположены в альфа спиралях. Прочность этих структур обеспечивают водородные связи, о которых говорилось ранее, а также солевые мостики. Так как они являются комбинацией водородной связи и ионной связи, то их длина была учтена в предыдущем пункте, при этом они не сильно отличаются от среднего значения.
По итогу анализа биомолекулы было получено то, что в ней нет дисульфидных мостиков.
В данной биомолекуле были обнаружены несколько случаев Т-стэкинга и ни одного случая параллельно сдвинутого стекинга, что позволяет говорить о большей стабильности первого в сравнении со вторым.
Также было проанализировано гидрофобное ядро, центром которого является фенилаланин (являющийся 33 аминокислотным остатком на альфа-субъединице). Итогами анализа можно считать следующие результаты: данный аминокислотный остаток полностью покрывается атомами, расположенными на расстоянии 7Å от него; но также его можно считать почти покрытым уже для атомов, расположенных на расстоянии 4Å от него. Поэтому характерным расстоянием между соседними не связанными ковалентно атомами в белке можно считать примерно 4Å. Используя полученные результаты, мы можем посчитать, сможет ли поместиться молекула воды (которую будем считать просто кислородом, так как водороды не дают большого вклада в размер молекулы). Для рассмотрения крайнего случая возьмем атом углерода из фенилаланина и атом кислорода из окружения (так как у кислорода минимальный Ван-дер-Ваальсов радиус). Тогда получим, что между этими атомами расстояние составляет 0.75Å, что очевидно меньше диаметра кислорода, то есть и размеров молекулы воды.
- Контакты типа лиганд-белок и лиганд-лиганд
Оксигемоглобин имеет два лиганда: сам гем и молекулу кислорода; в то время, как у гемоглобина имеется только гем.
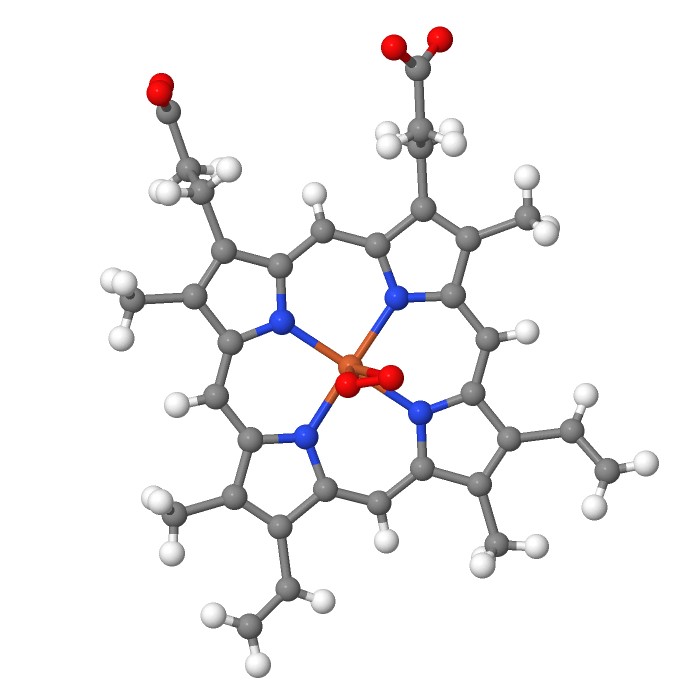
Рассмотрим контакт гем-белок. Данный контакт является координационным для атома железа, так как уже говорилось о том, что свою функцию гем выполняет благодаря октаэдрической координации железа. Также можно отметить, что рассмотрев расположение гема, можно убедиться в том, что он и вправду находится в окружении многих гидрофобных аминокислотных остатков, но в удержании гема участвуют напротив гидрофильные остатки.
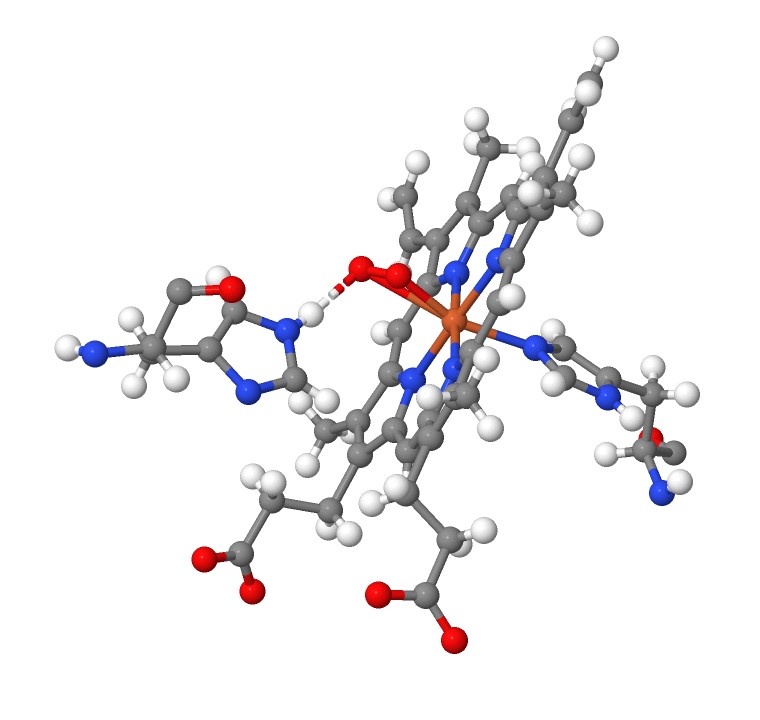
Также стоит рассмотреть еще один контакт, а именно способ удержания кислорода в оксигемоглобине. Сама молекула кислорода образует водородную связь с гистидином над гемом и ковалентнуб связь с железом. Такое связывание заставляет субъединицу изменять свою конформацию, что и является ключевым фактором в явлении кооперативности.