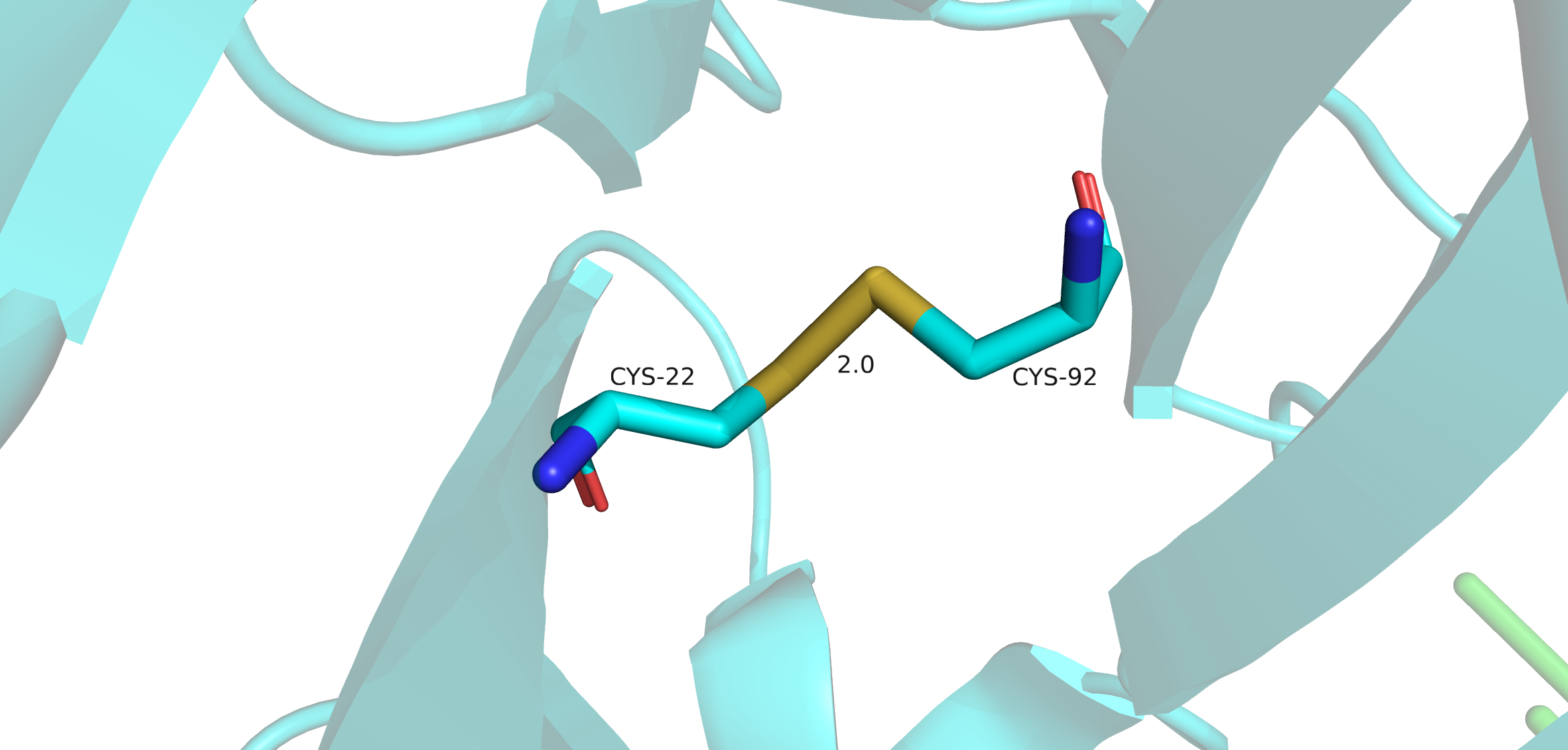Атлас контактов 1KEG
Введение
Идентификаторы: NDB ID: PD0276 PDB ID: 1KEG
Антигенсвязывающий фрагмент (Fab) антитела 64М-2 с dTT(6-4)TT
dTT(6-4)TT – эпитоп молекулы ДНК,которая возникает вследствие облучения НК ультрафиолетом и является причиной мутагенеза, особенно в период репликации ДНК. В данной моделе представленно монокланальное антитело 64М-2, высокоспецифичное только к данному виду повреждений: для идентификации (6-4) фотопродуктов и их количественного определения. [1],[2]
Данное искусственное антитело не несет биологических функций.
В этом обзоре рассматривается антигенсвязывающий участок, состоящий из 2 цепей: легкой (L) и тяжелой (H). Каждая цепь состоит из вариабельного домена (VL или VH, соответственно) и консервативного (CL или CH).
Вторичная структура Fab представлена преимущественно β-листами и соединяющими петлями, а также α-спиралями (рис. 1).
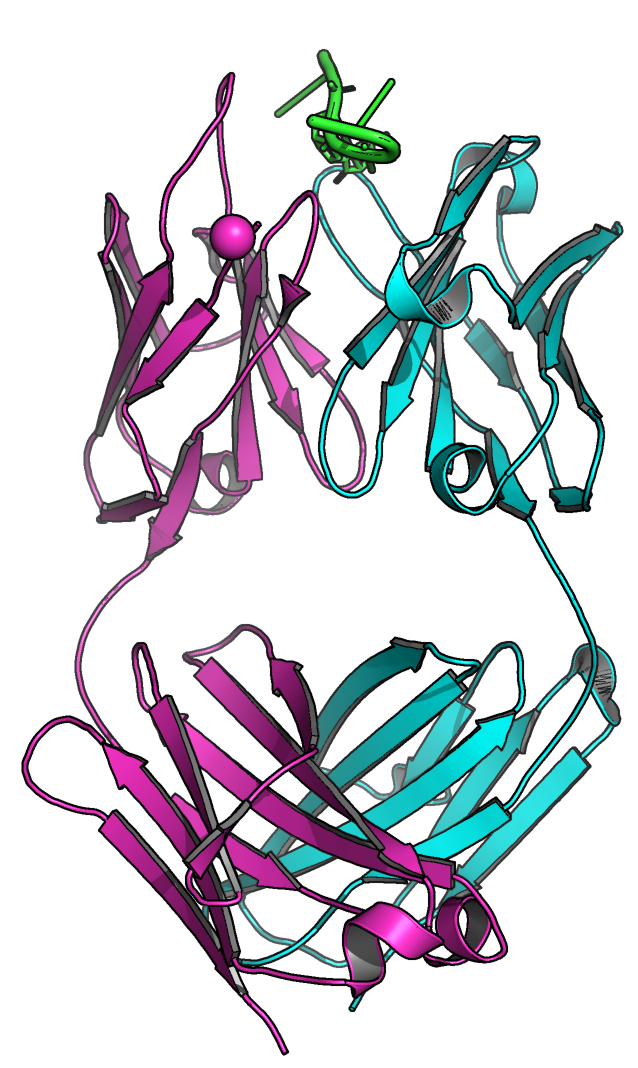
Рис. 1
Модель комплекса 1KEG.
Лиганды
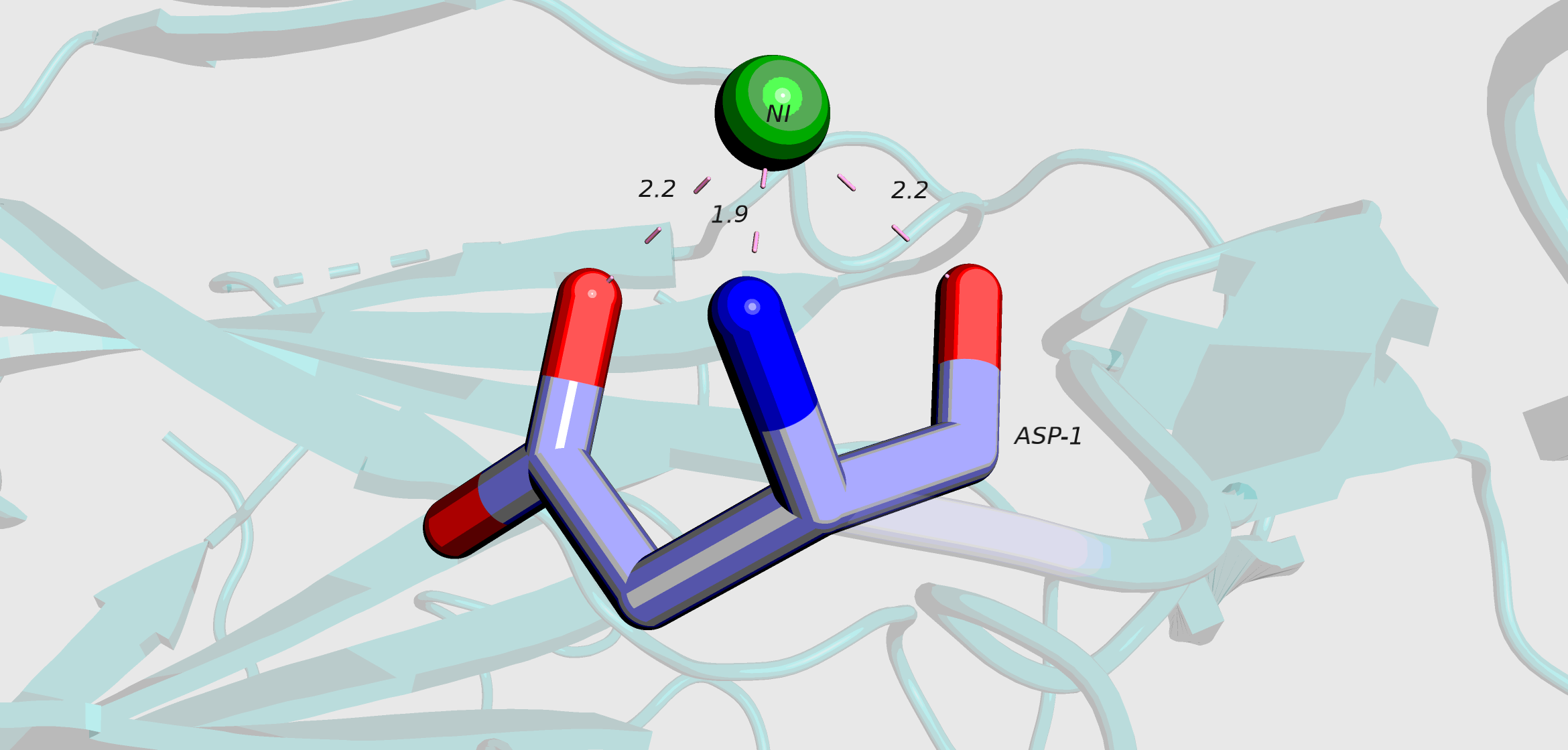
В моделе присутствуют два лиганда: ион никеля (Ni2+) и молекула dTT(6-4)TT.
Никель
Никель не является кофактором для антитела. В данном случае он присутсвует как примесь, которая появилась на стадии изготовления раствора для кристаллизации.[1]
Интересный момент:
В PDB файле в строках LINK у никеля присутствуют 4 связи (3 связи с Asp-1 и 1 связь с His-189), хотя внутри одного белка Ni образует связи только с Asp-1. Четвертая связь образуется с соседней молекулой белка, при образовании кристалла.
Название по IUPAC: Nickel ion
Химическая формула: Ni2+
Молярная масса: 59 г/моль
Индефикатор PubChem: 935

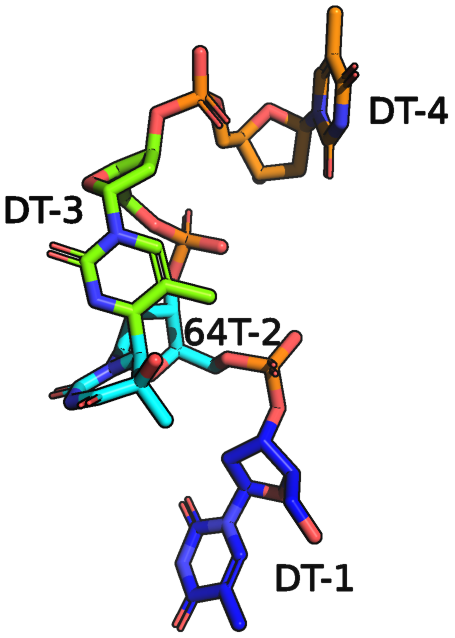
dTT(6-4)TT
dTT(6-4)TT, как уже говорилось выше, представляет из себя эпитоп поврежденной ультрафиолетом молекулы ДНК.
По строению dTT(6-4)TT является одноцепочечным олигонуклеотидом ДНК, содержащий четыре последовательных тимидильных остатка, Т1, Т2, Т3 и Т4, расположенных в направлении от 5'-конца к 3'-концу, с образованием пиримидинового димера между T2 и T3 - (6-4).[2]
Название по IUPAC: [(2R,4S,5R,10S,11R,13R,18R,19S)-8,18-dihydroxy-4-[hydroxy-[[(2R,3S,5R)-3-hydroxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy]phosphoryl]oxy-18,24-dimethyl-8,15,17,22-tetraoxo-7,9,12,26-tetraoxa-1,14,16,21-tetraza-8λ5-phosphapentacyclo[18.2.2.12,5.110,13.014,19]hexacosa-20,23-dien-11-yl]methyl [(2R,3S,5R)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)-2-(phosphonooxymethyl)oxolan-3-yl] hydrogen phosphate
Химическая формула: C40H54N8O29P4
Молярная масса: 1235 г/моль
Индефикатор PubChem: 71627169
|
Никель связывается с Asp-1 легкой цепи Fab за счет координационных связей.
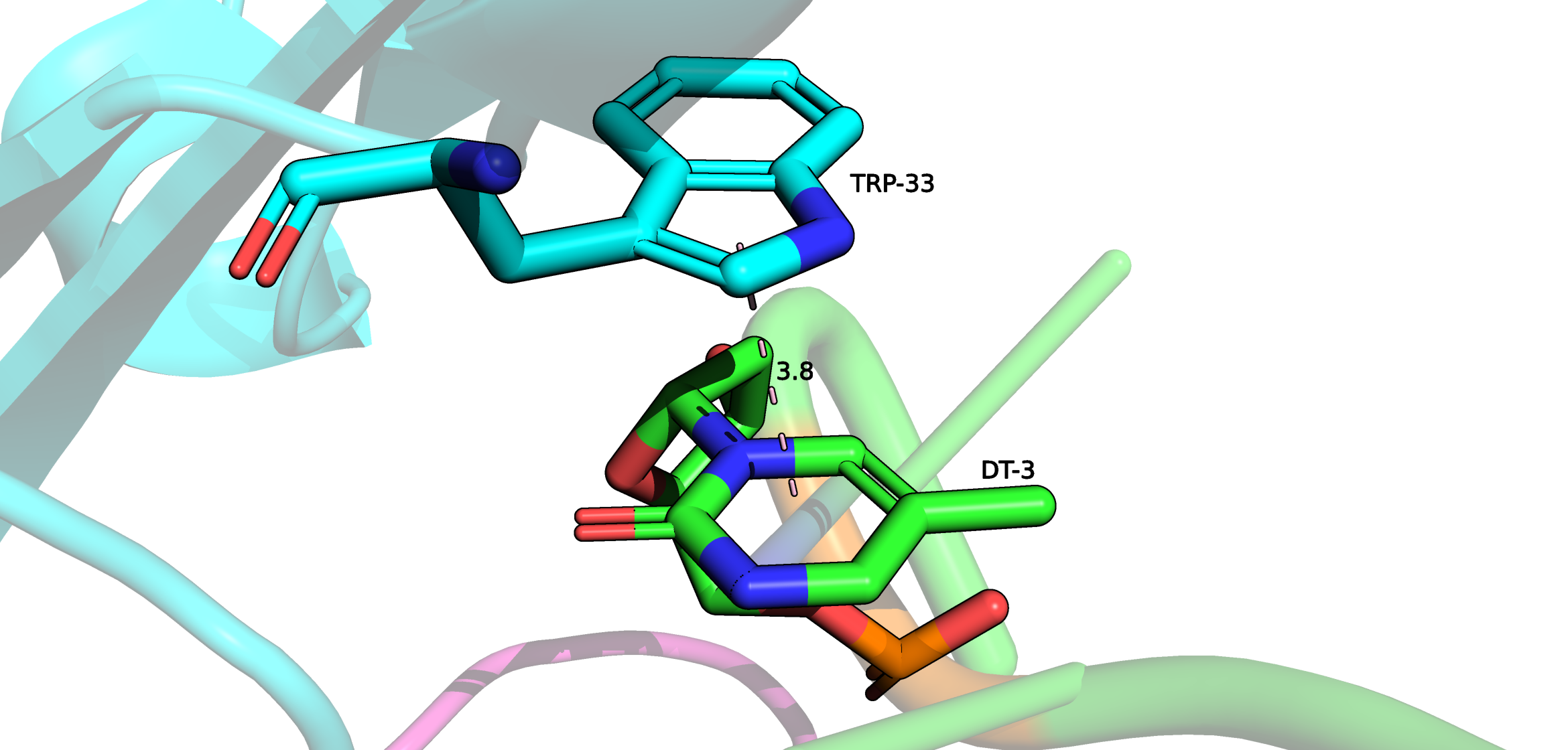
1. Взаимодействие DT-3 и боковой цепи Trp-33 параллельным стэкингом.
1. Водородное взаимодействие между DT-3 и His-35.
|
Внутри белковые взаимодействия
Солевые мостики
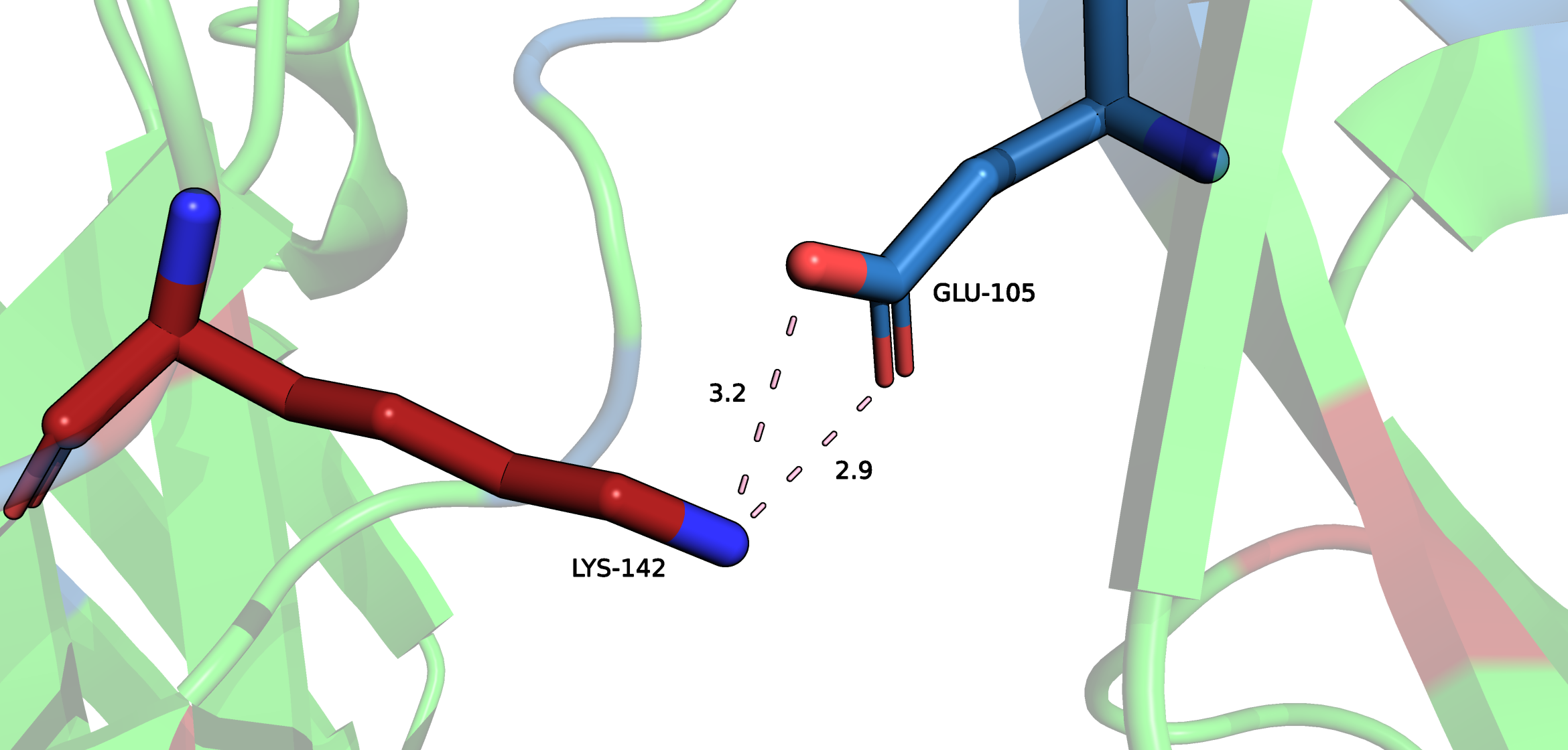
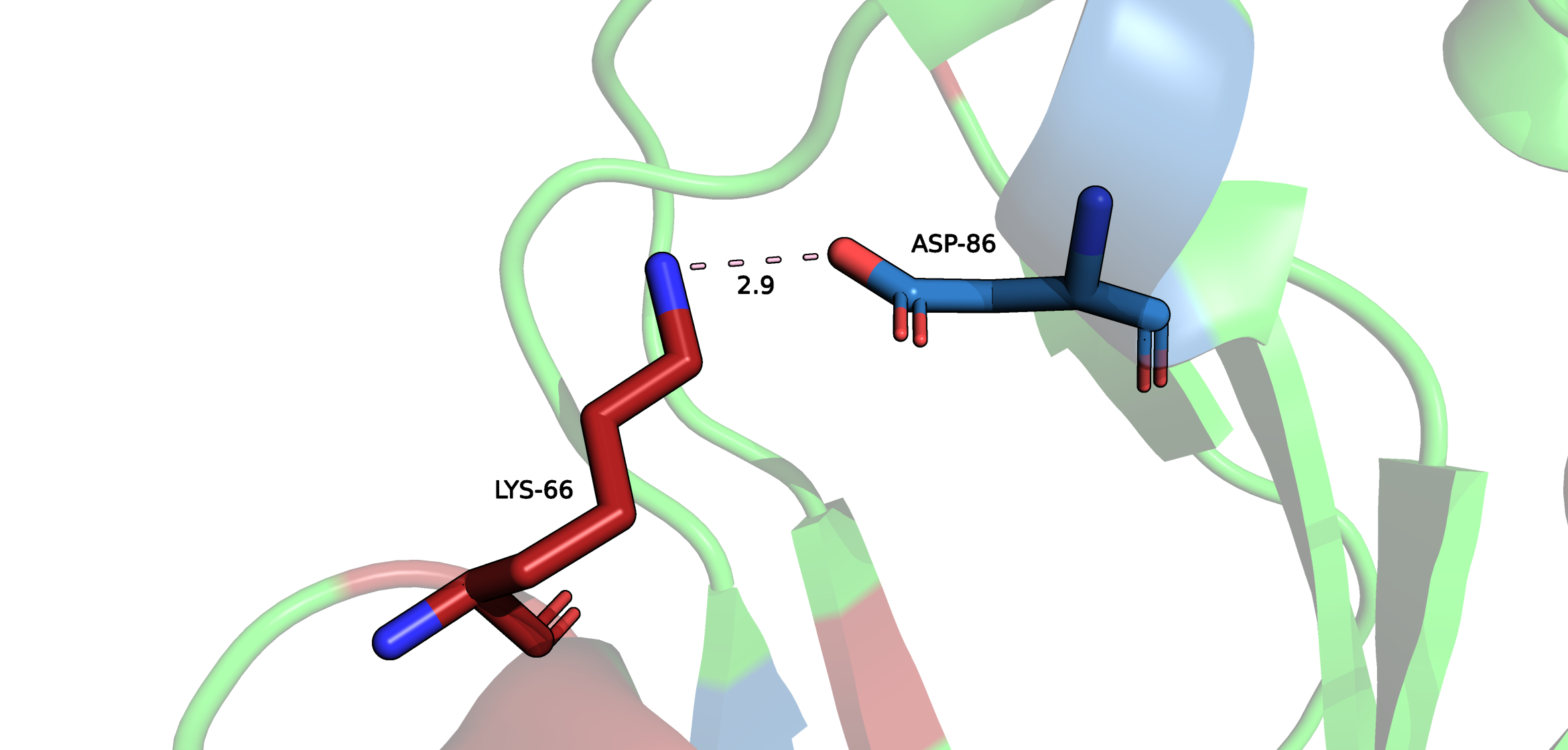
Поиск солевых мостиков происходил с помощью выделения всех аминокислот, которые способны ионизироваться по бокой цепи (положительные - Lys, Arg, His; отрицательные - Asp, Glu), а далее поиска в ручном режиме аминокислот, боковые цепи которых находятся на расстоянии не более, чем 3.5 Å. Также важно отметить, что между рассмотренными остатками также образуются и водородные связи.
При изучении структуры удалось обнаружить большое количество солевых мостиков внутри белка, однако в этом проекте рассмотренны только 2 мостика. Подробнее в апплете внизу.
Дисульфидные мостики
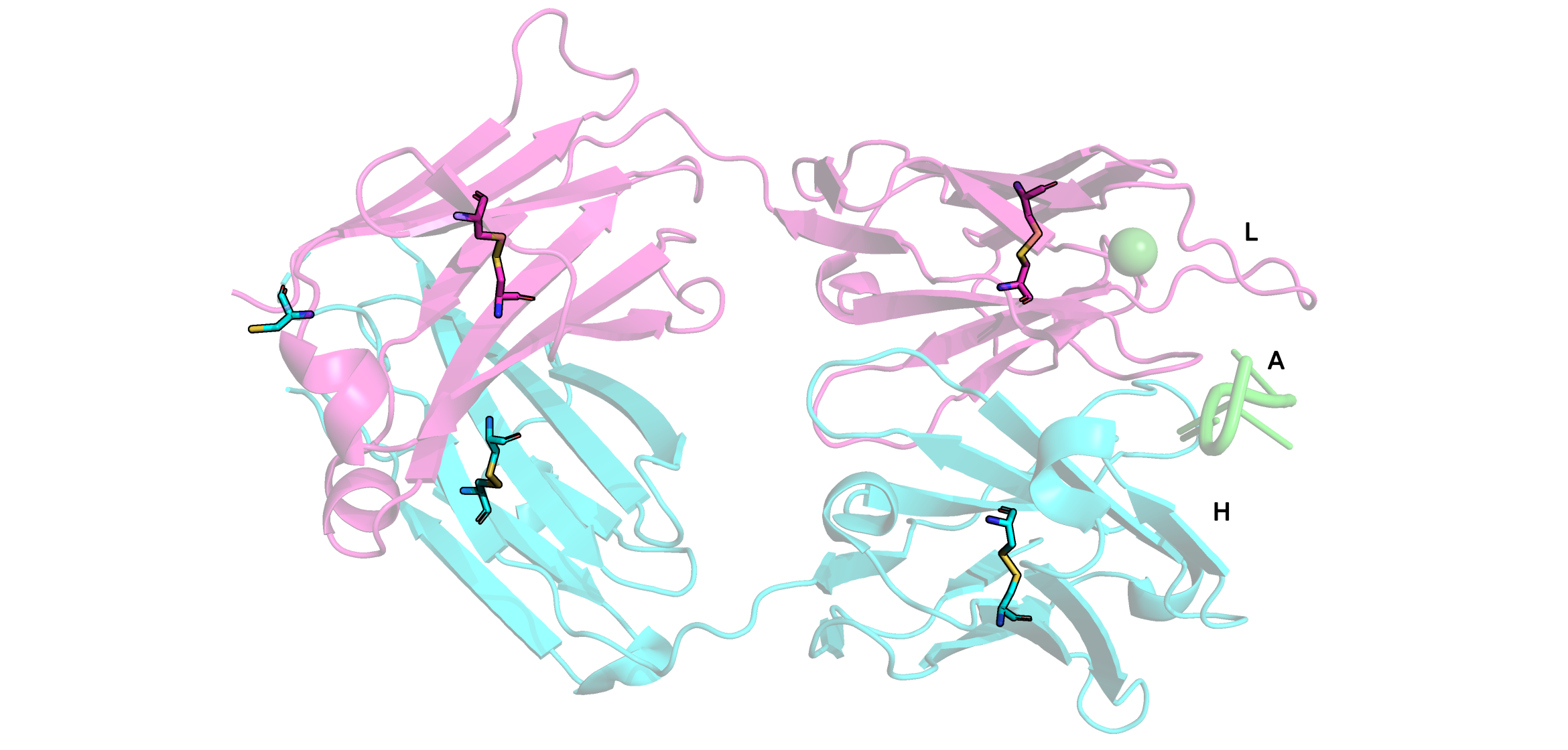
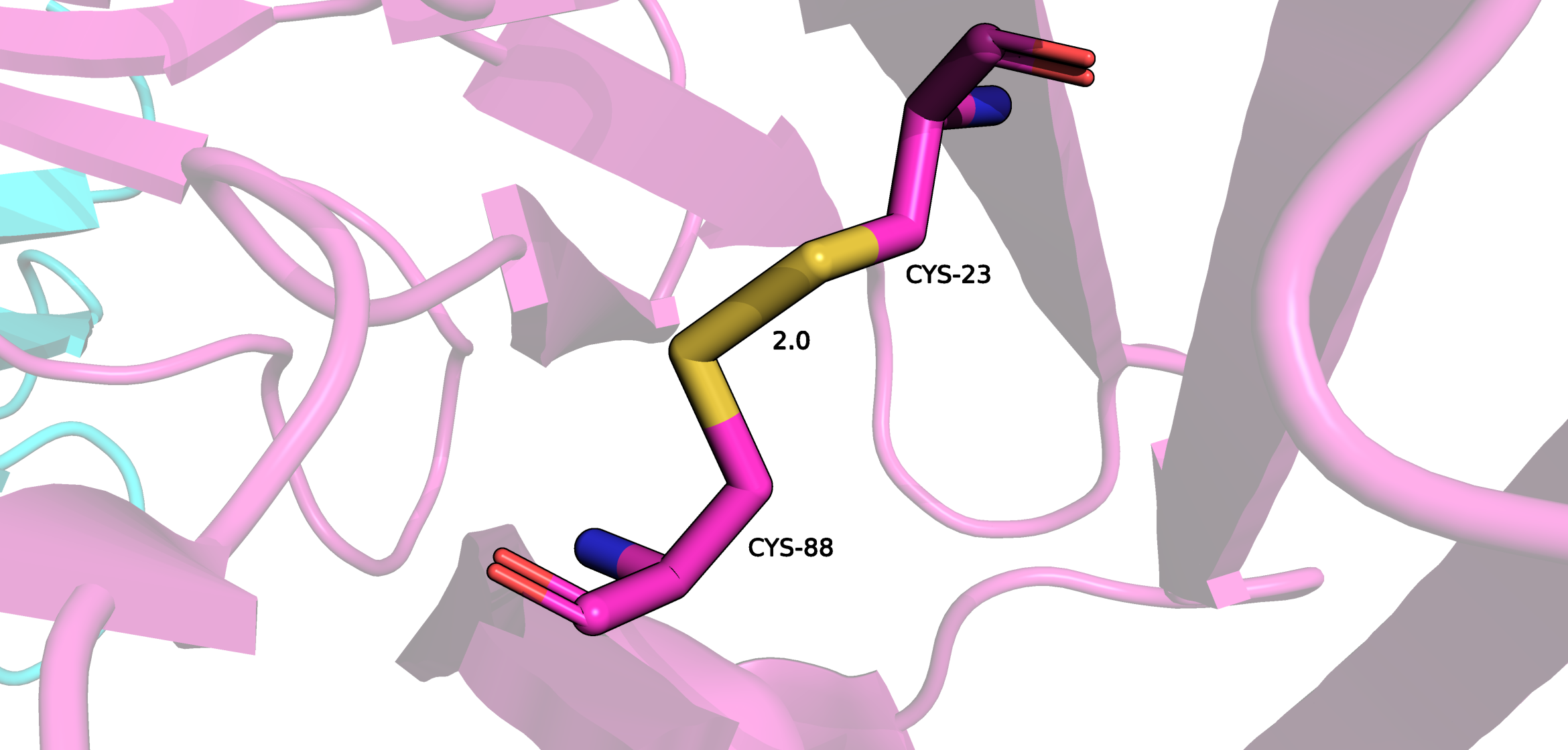
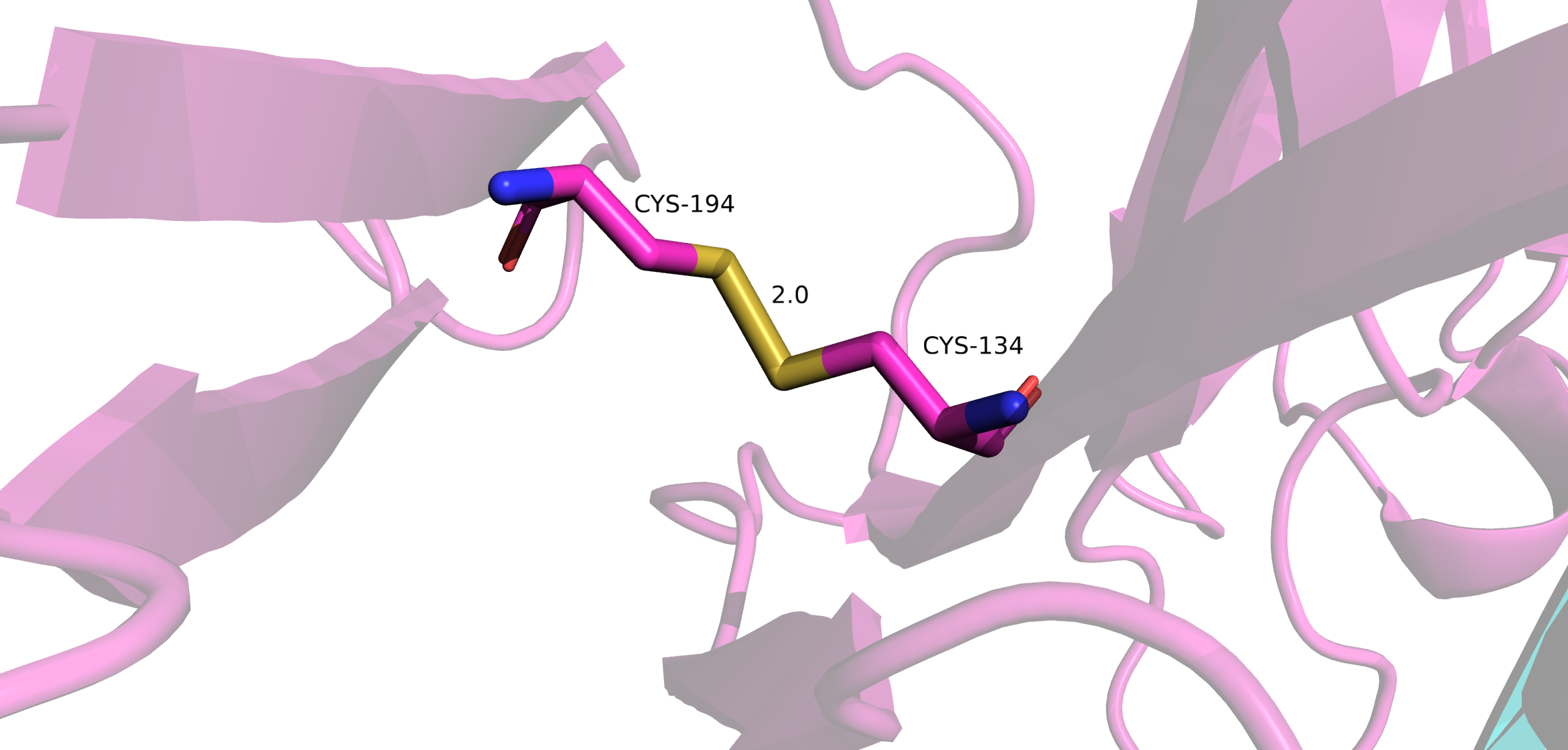
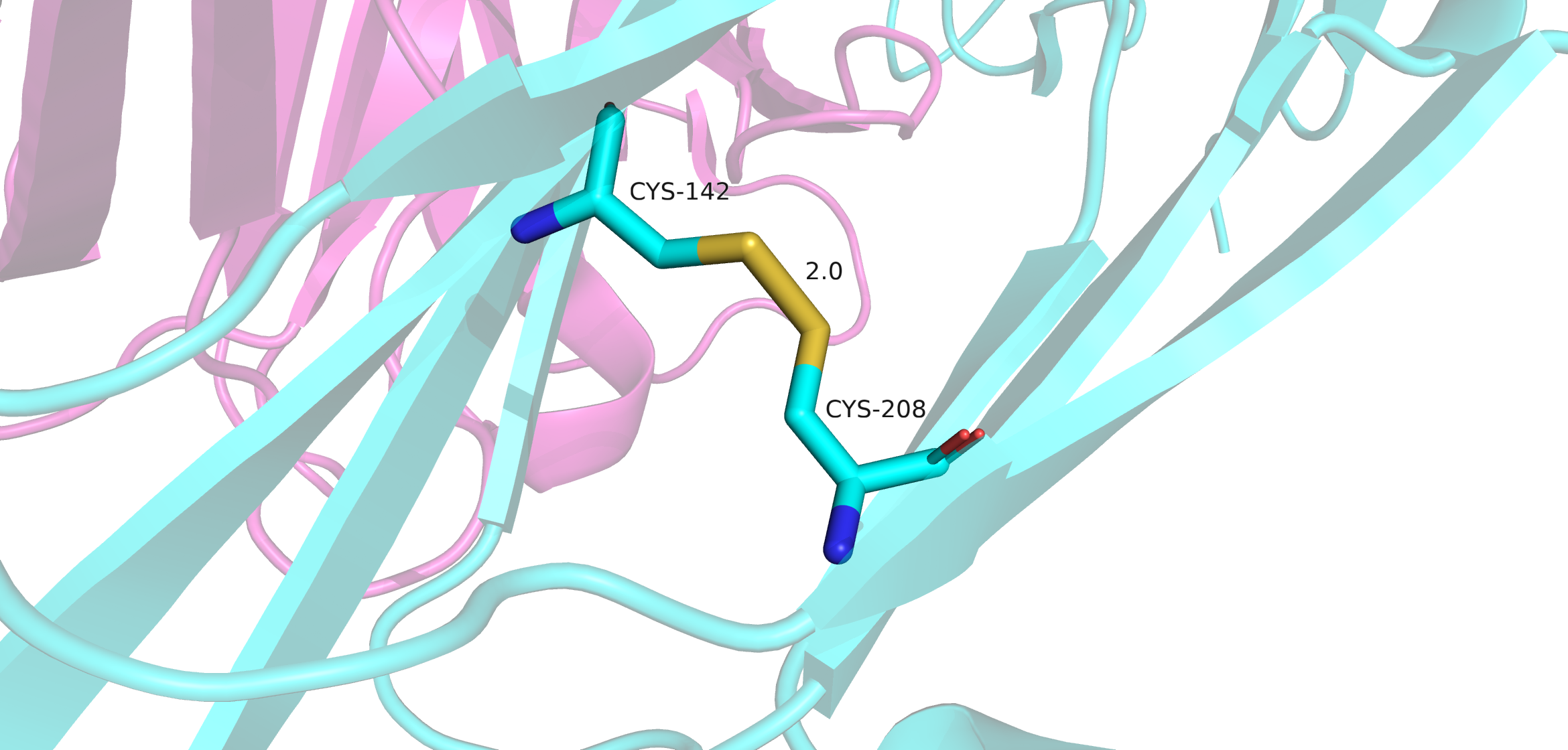
Поиск дисульфидных мостиков проводился двумя методами. Первый - выделение всех цисцеинов (Cys), всего в Fab их девять штук, а после - просмотр тех cys, которые ковалентно связаны между собой. Таковых оказалось восемь штук. Девятый цисцеин находится внтури L цепи Fab. Он нужен для связывания легкой цепи с десятым цисцеиным тяжелой цепи, который не попал в модель. Второй метод - в PDB файле найти строки SSBOND. Таких строк оказалось четыре, это значит, что в структуре присутвуют 8 цисцеинов, которые образуют дисульфидные мостики.
В апплете доступны 4 дисульфидных мостика для рассмотрения.
Гидрофобные взаимодействия
Гидрофобные взаимодействия между H и L цепями были найдены при помощи выделения всех гидрофобных аминокислот (Gly, Val, Leu, Ile, Trp, Fhe, Met, Pro, Ala) и удаления атомов остова. Далее были найдены скопления гидрофобных боковых цепей.
Результаты поиска представлены в апплете ниже.
Водородные связи
Водородные связи были найдены в структуре с помощью команды "hbonds calculate".
В апплете представлены водородные связи поддерживающие α-спирали и β-листы.
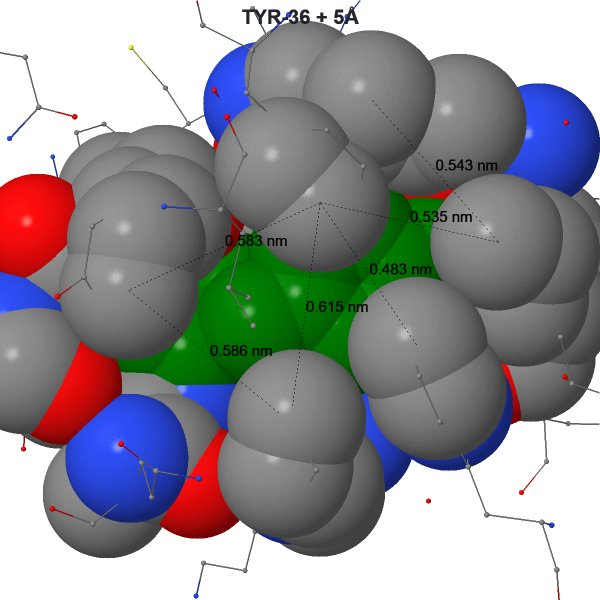
Гидрофобное ядро
Основным объектом ядра стал выбран Tyr-36.
Для скрытия Tyr-36 - 5 ангстрем, хотя с одной из сторон есть большой пустой участок. Среднее расстояние между ядрами не связанных ковалентно атомов составляет, примерно, 5.18Å. Если сделать допущение, что молекула воды имеет диаметр в 3Å, то можно говорить о том, что между в этот пустой учаток может поместиться молекула воды.
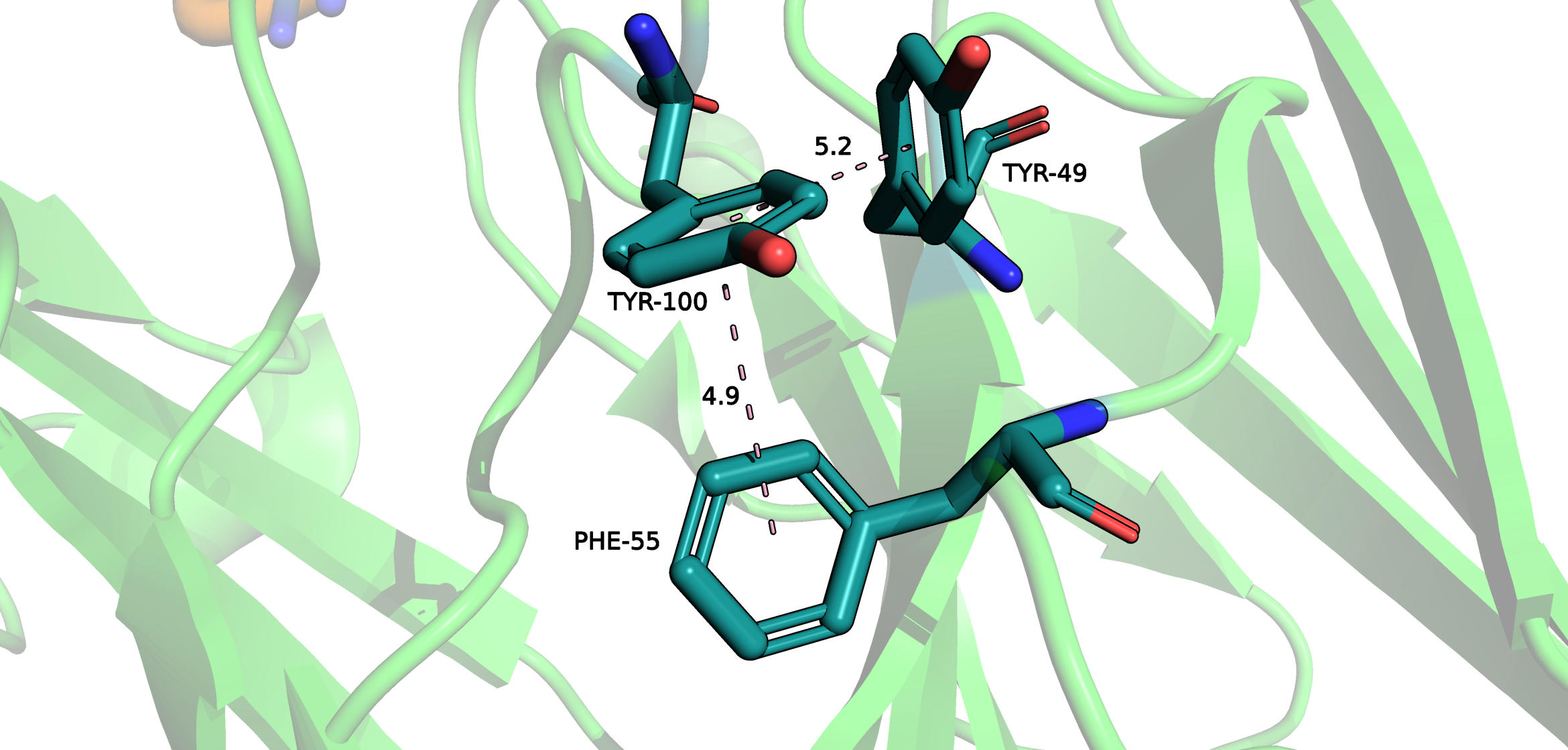
Двойной-стэкинг
При изучении структуры очень интересным оказалось взаимодействие между остатками Tyr-49, Tyr-100 и Phe-55.
В данном взаимодействии Tyr-100 одновременно учавствует в двух Т-стэкинг взаимодействиях. В первом случае, с Tyr-49, как ножка буквы Т, а во втором случае как шляпка.
|
1. Солевой мостик между атомом азота (NZ) Lys-66 и атомом кислорода (OD2) Asp-86.
Гидрофобные взаимодействия между легкой (красная) и тяжелой (синяя) цепями.
Ядро строится вокруг Tyr-36
1. Дисульфидный мостик между Cys-22 и Cys-92
1. α-спираль от Lys-183 до Arg-188 легкой цепи.
|
Красивые картинки
Ниже представлены красивые иллюстрации, сделанные в программе PyMol
Личные вклады участников
Гуков Борис
Написание сценариев для апплетов, а также техничегое оформление сайта.
Каштан Ангелина
Анализ литературных источников
Литвинова Анастасия
Анализ литературных источников и текстовое оформление задания

Список литературы
[1]-Yokoyama, H.; Mizutani, R.; Satow, Y.; Sato, K.; Komatsu, Y.; Ohtsuka, E.; Nikaido, O. Structure of the DNA (6-4) photoproduct dTT(6-4)TT in complex with the 64M-2 antibody Fab fragment implies increased antibody-binding affinity by the flanking nucleotide. Acta Crystallogr. Sect. D Biol. Crystallogr. 2012, 68, 232–238
https://doi.org/10.1107/S0907444912000327
[2]- Yokoyama, H.; Mizutani, R. Structural Biology of DNA (6-4) Photoproducts Formed by Ultraviolet Radiation and Interactions with Their Binding Proteins. Int. J. Mol. Sci. 2014, 15, 20321-20338.
https://doi.org/10.3390/ijms151120321