Альфа-спираль номер 1
2-17 остатки цепи B.Изображение альфа-спирали номер 1
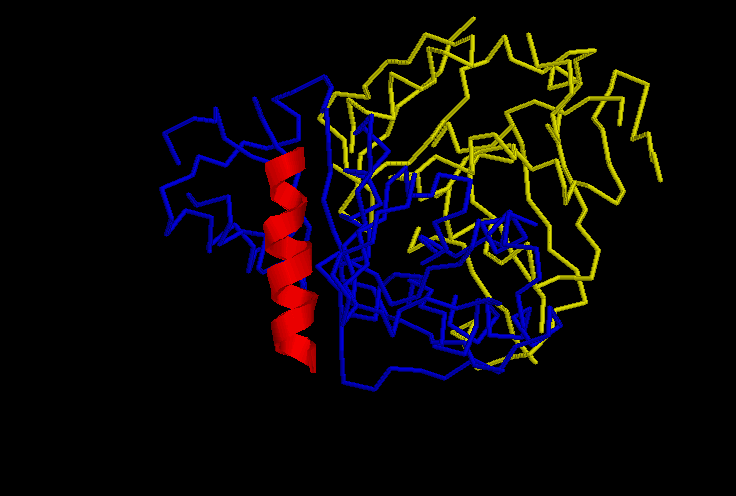
На рисунке в остовной моделе изображена структура белка. Желтый - цепь A. Синий - цепь B. Красным цветом и в ленточной форме изображена первая альфа спираль цепи B.
Примечание: в PDB файле отсутствуют некоторые участки белковой структуры, поэтому видно несколько не соединенных фрагментов.
Торсионные углы
| остаток | Phi | Psi |
| THR 2 | 164.5 | |
| GLN 3 | -57.6 | -39.0 |
| ASP 4 | -64.8 | -33.3 |
| GLU 5 | -72.1 | -30.2 |
| LEU 6 | -65.0 | -41.3 |
| LYS 7 | -63.1 | -42.2 |
| LYS 8 | -61.9 | -42.7 |
| ALA 9 | -57.3 | -44.6 |
| VAL 10 | -77.5 | -34.4 |
| GLY 11 | -61.4 | -41.4 |
| TRP 12 | -76.6 | -34.5 |
| ALA 13 | -60.8 | -27.8 |
| ALA 14 | -65.5 | -17.8 |
| LEU 15 | -61.2 | -27.3 |
| GLN 16 | -50.6 | -29.8 |
| TYR 17 | -88.8 | 129.4 |
| max | 164.5 | 129.4 |
| min | -88.8 | -44.6 |
| среднее | -51.2 | -23.8 |
Паттерн водородных связей между атомами элементов вторичной структуры
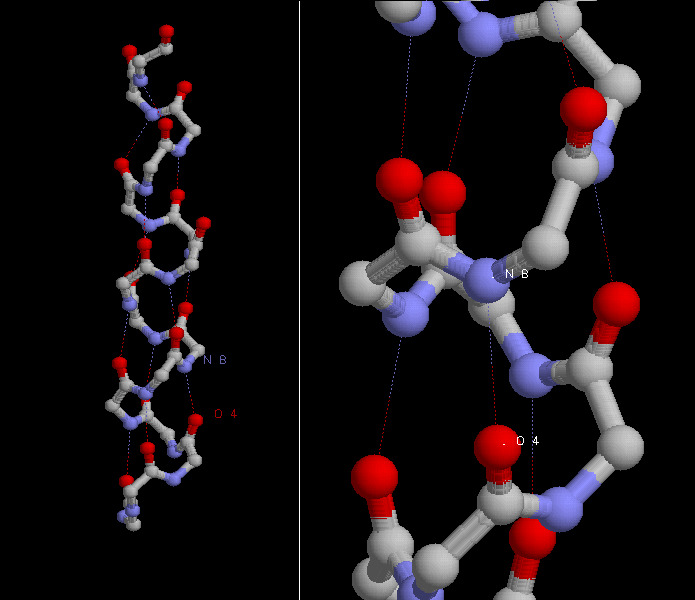
Водородные связи образуются между кислородом i-итого остатка и азотом i+4 остатка.
Контакты альфа-спирали 1 с остальной частью цепи А
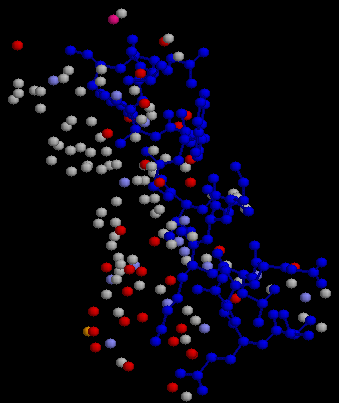
Альфа спираль изображена синим в проволочной модели. Окружающие ее атомы, удаленные не более, чем на 5.4 А- в шариковой.
Видно из рисунка, что только часть альфа-спирали контактирует с остальным белком. Другая часть обращена к белковому окружению.
Таблица. Контакты альфа-спирали 1 с остальной частью цепи А белка из записи PDB 1RG9.
| Имя атома остатка спирали | Имя контактирующего атома | Расстояние в А | Предположительная природа контакта |
| ala9b.c | val214b.cg2 | 3.86 | гидрофобное взаимодействие |
| val10b.cg1 | ile208b.c | 3.6 | гидрофобное взаимодействие |
| asp4b.OD1 | his34b.ne2 | 2.81 | Водородные связи |
| gln3b.ne2 | asp116b.OD2 | 2.82 | Водородные связи |