№1.Общее описание вторичной структуры белка BACSU_1W5D
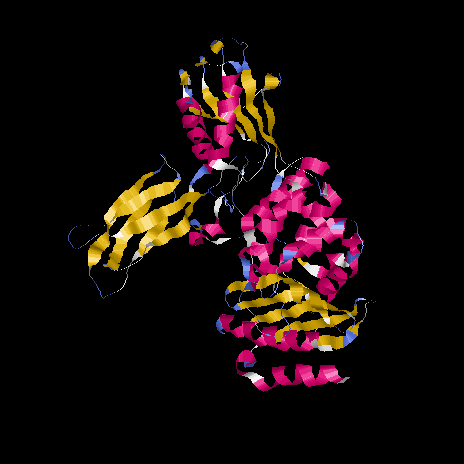
| Количество водородных связей | Коичетво альфа-спиралей | Количество бета-складок | Количество бета-поворотов |
Данный белок относится к α+β белкам, т.к. отсутствует строгое чередование α-спиралей и β-тяжей.
№2.Выбор элементов вторичной структуры белка
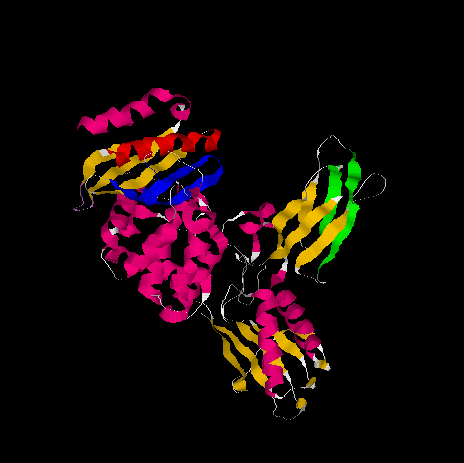
1)С помощью команды select 443-461:A выбрала длинную альфа-спираль(на рисунке выделена красным).
2)Выбор параллельных бета-тяжей(на рисунке-зеленые):
select 195-205:A
select 221-230:A
3)Выбор антипараллельных бета-тяжей(отмечены голубым):
select 404-416:A
select 417-427:A
4)Петля, в которой полипепидная цепь круто разворачивается на 180°(выделено светло-филетовым на рисунке):
select 33-37:A
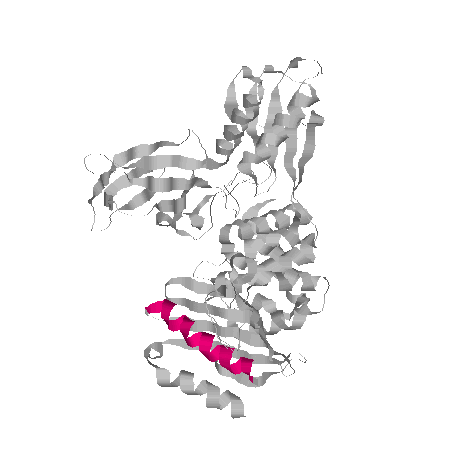
№3.Картинки, иллюстрирующие свойства выбранной альфа-спирали
1)Вся цепь в ленточной модели, выбранная спираль выделена цветом
3)Остов альфа-спирали с водородными связями и указанием номеров остатков
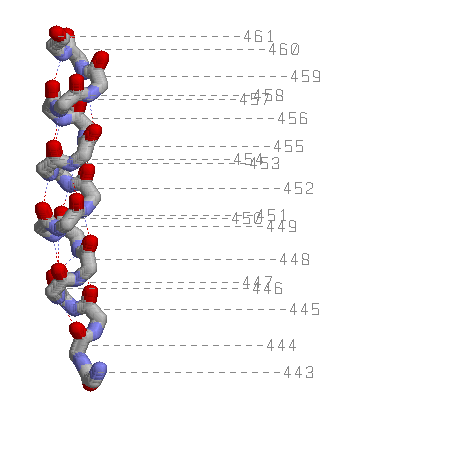
4)Тот же остов с водородными связями, Cβ атомы показаны красными шариками.
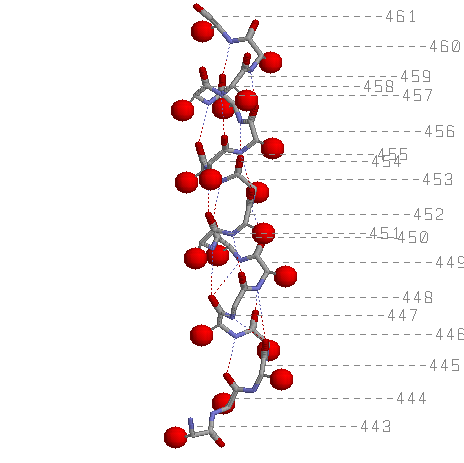
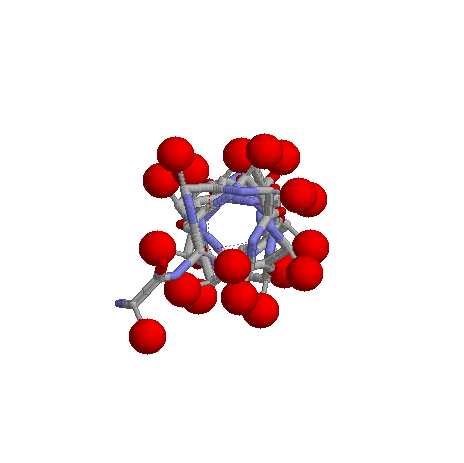
Расположение атомов Сβ относительно плоскости листа
Скрипт
№3.Исследование пары соседних параллельных β-тяжей 195-205:A, 221-230:A
1)Остов β-тяжей с водородными связями и номерами остатков
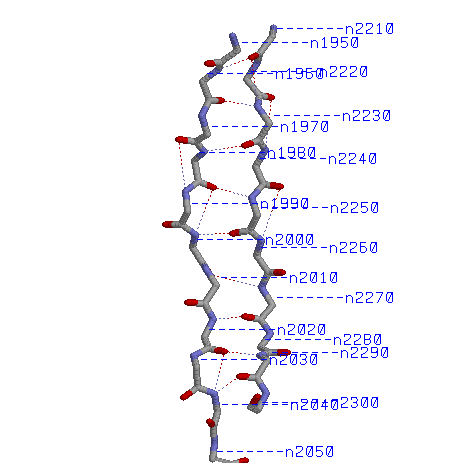
2)Остов β-тяжей с водородными связями и атомами Сβ
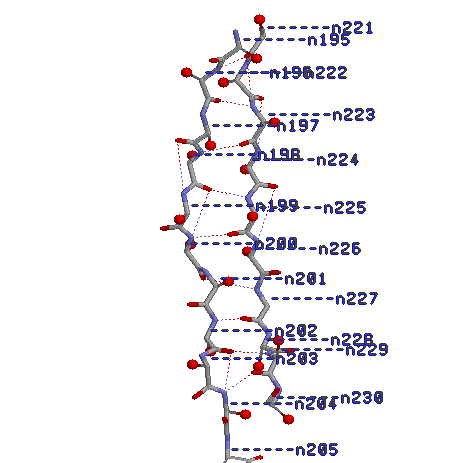
Атомы CСβ в одном Сβ-тяже выходят из листа поочерёдно в разные стороны, можно сказать, перпендикулярно к плоскости листа.
Скрипт
№4.Исследование пары соседних антипараллельных β-тяжей 404-416:A, 417-427:A
1)Остов β-тяжей с водородными связями и номерами остатков
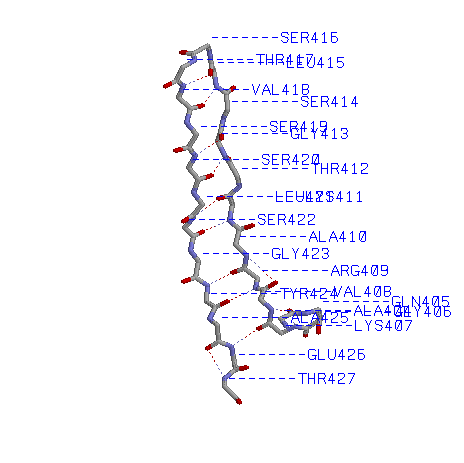
2)Остов β-тяжей с водородными связями и атомами Сβ
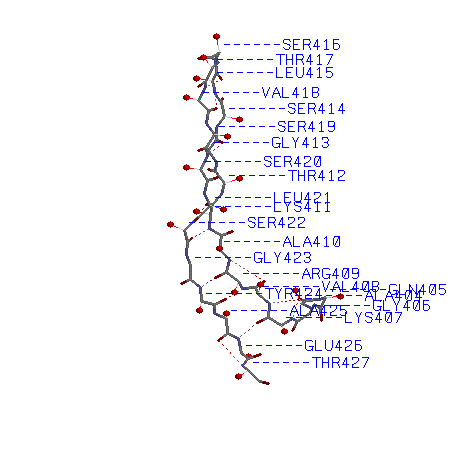
Скрипт
№5.Изображение реверсивного поворота 33-37:A
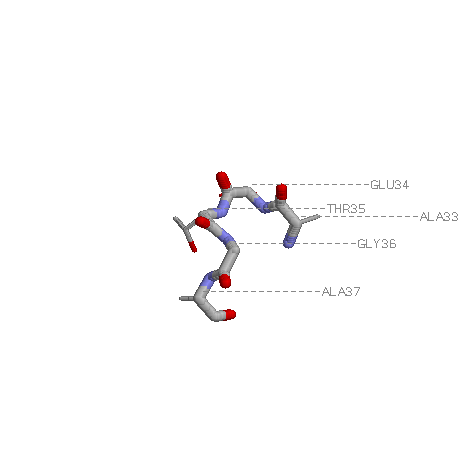
Выбранный поворот: GLU34-ALA33-THR35-GLY36-ALA37
В поворое есть Н-связь, способная его "скрепить".
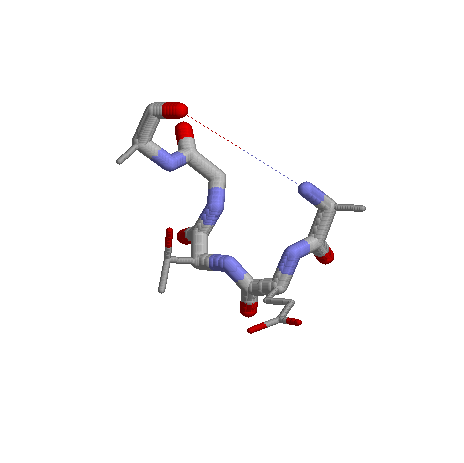
Скрипт
©Eliseeva Julia