"Исследование ДНК-белковых взаимодействий в структуре комплекса Дифтерия-токсичного ингибитора и Днк-содержащего оператора токсина"
- Краткое описание структуры в файле 1DDN.pdb
Этот днк комплекс из организма Corynebacterium diphtheriae (экспрессируется из Escherichia coli).
В файле приведены координаты атомов следующих молекул: 2 цепи основной ДНК, содержащей оператор токсина, и 4 цепи дифтерия-токсичного репрессора.
Для исследования были выбраны D цепь белка и цепи E и F, представляющие ДНК со следующей последовательностью:
цепь E [301] 5' -ATATAATTAGGATAGCTTTACCTAATTATTTTA- 3' [333]
||||||||||||||||||||||||||||||||
цепь F [433] 3' - ATATTAATCCTATCGAAATGGATTAATAAAATT- 5' [401],
где
301-333 и 401-433 - номера первого и последнего нуклеотида соответственно.
- Функции белка, структура которого представлена в файле 1DDN.pdb
Из документа UniProt получим информацию о белке, в файле pdb он полностью представлен- 226АА.
Его accession number P33120.
Функции:Железо-связывающий репрессор экспрессии гена токсина дифтерии.
Может использоваться как глобальный регулятор экспресии генов.
Так же подавляет ripA под действием избытка железа.
Белок располагается в цитоплазме, является гомодимером. Содержит в себе 1 HTH dtxR-типа ДНК-связывающий домен.
Регулирует процесс транскрипции, а именно является репрессором этого процесса.
- Исследование структуры ДНК
С помощью программ find_pair и analyze определим
тип формы ДНК. Для этого определим средние значения торсионных углов для внутренних нуклеотидах (для всех, кроме краевых).
Найдем самый "кривой" нуклеотид со значениями торсионных углов, наиболее отклоняющимися от средних.
Получили файл.Конвертируем его в файл EXcEL.
Лист rab содержит исходные данные. На листе isp содержатся преобразованные данные.
|
| альфа P-O5’
| бетта O5’-C5’
| гамма C5’-C4’
| дельта C4’-C3’
| эпсилон C3’-O3’
| зета O3’-P
| чи C1’-N
|
| 1DDN
| -63,985
| 151,825
| 77,487
| 151,16
| 162,022
| -107,78
| -113,722
|
| ДНК A
| -62
| 173
| 52
| 88 / 3
| 178
| -50
| -160
|
| ДНК B
| -63
| 171
| 54
| 123 / 131
| 155
| -90
| -117
|
Получается, что соответствует форме B. наиболее кривым, мне показался, A7 из второй цепи.
- Исследование природы ДНК-белковых контактов
1DDN.pdb
Скрипт
Используя скрипт, мы просмотрим все необходимые множества.
Будем считать полярными атомы кислорода и азота, а неполярными – атомы углерода, фосфора и серы.
Назовем полярным контактом ситуацию, в которой расстояние между полярным атомом белка и полярным атомом ДНК меньше 3.5A.
Аналогично, неполярным контактом будем считать пару неполярных атомов на расстоянии меньше 4.5A.
Таблица. Контакты разного типа в комплексе 1DDN.pdb
| Контакты атомов белка с |
Полярные |
Неполярные |
Всего |
| остатками 2'-дезоксирибозы |
1 |
10 |
11 |
| остатками фосфорной кислоты |
11 |
5 |
16 |
| остатками азотистых оснований со стороны большой бороздки |
1 |
7 |
8 |
| остатками азотистых оснований со стороны малой бороздки |
0 |
0 |
0 |
Всего полярных контактов 12 и неполярных 22.
Неполярных контактов больше, чем полярных.
С азотистимы основаниями белок контактирует со стороны большой бороздки.
Возможно, причиной является больший размер и глубина большой бороздки, а так же место контакта белка и ДНК.
Белок контактирует с сахаро-фосфатным остовом намного больше, чем с азотистыми основаниями.
Возможно, это обьясняется внешнем расположением 2'-дезоксирибозы и фосфата.
- Получение популярной схемы ДНК-белковых контактов с помощью nucplot
Для получения схемы выполним команду nucplot kill.pdb.
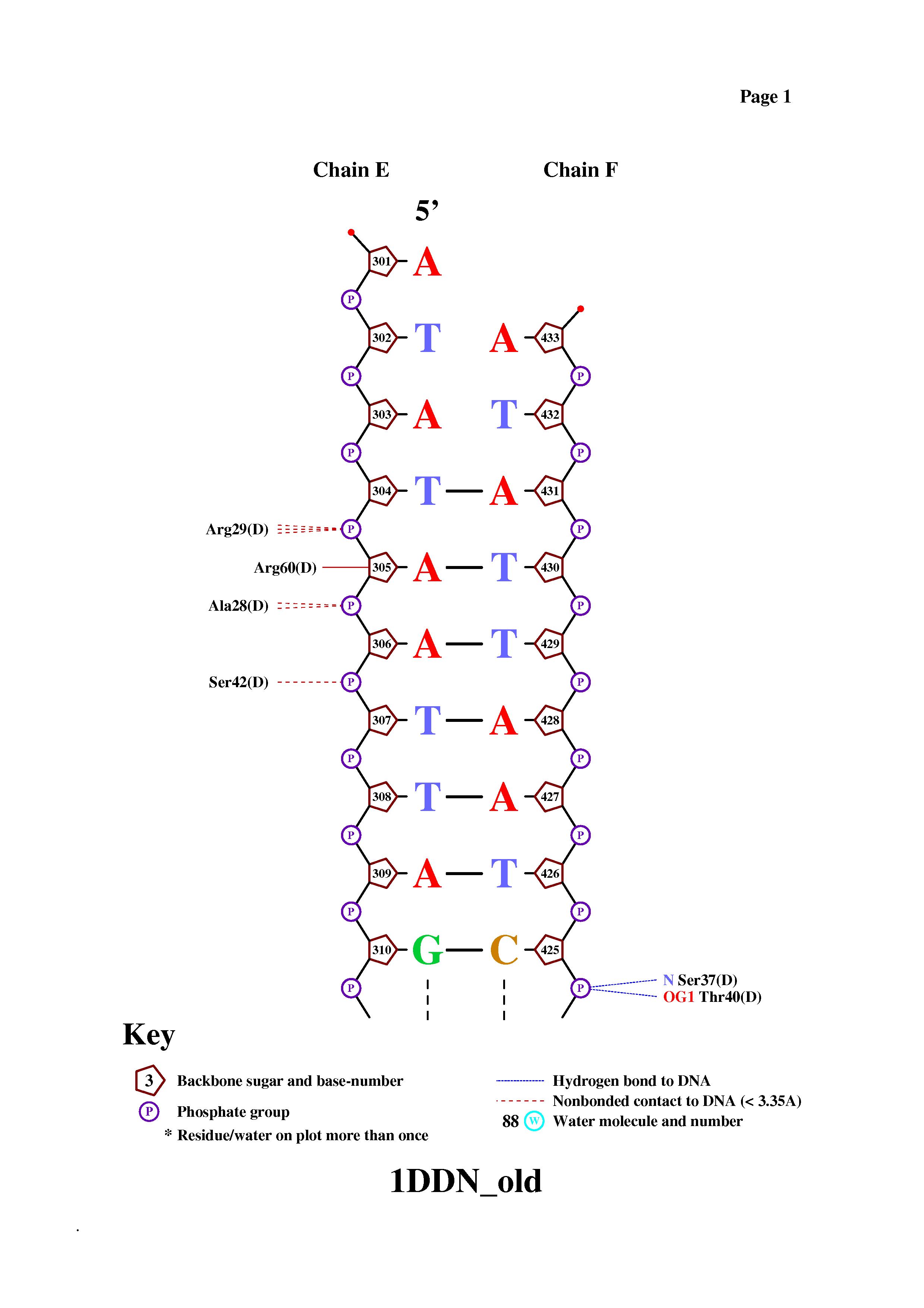
Возможно заметить, что многие деформированные нуклеотиды не образуют контактов с белком.
Вероятно, деформируются не только сами контактирующие нуклеотиды, но и их соседи.
Заметим, полученные результаты совпали с результатами исследования природы ДНК-белковых контактов.
С белком контактируют начало и середина обеих цепочек.
- Возможный(е) распознающий(е) контакт(ы)
Укажите, контакт какого аминокислотного остатка с каким нуклеотидом представляется вам хорошим кандидатом
на роль распознающего контакта. Приведите обоснование вашего выбора. Приведите картинку, полученную
с помощью RasMol, на которой изображены выбранные контактирующие остатки.
- Характеристика ДНК-связывающего домена ___(UniProt ID)________
С помощью инструментов Pfam определите доменную структуру белка из исследуемого комплекса.
Приведите картинку, иллюстрирующую доменную структуру. Приведите полное название ДНК-связывающего
домена и его краткую аннотацию в InterPro.
|
