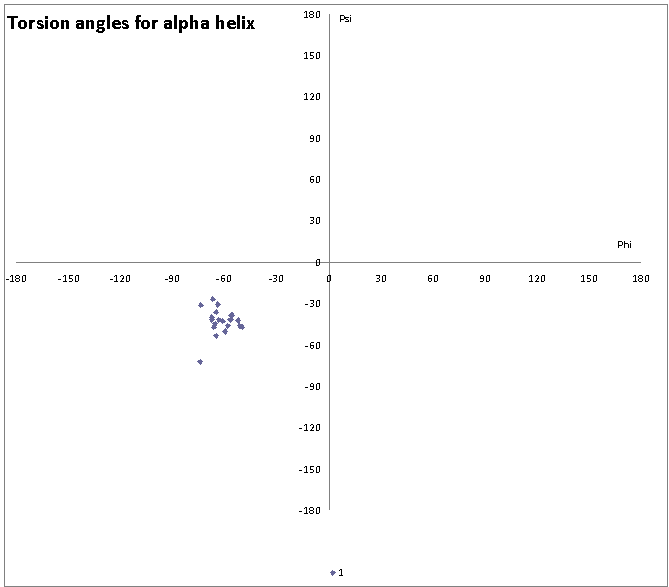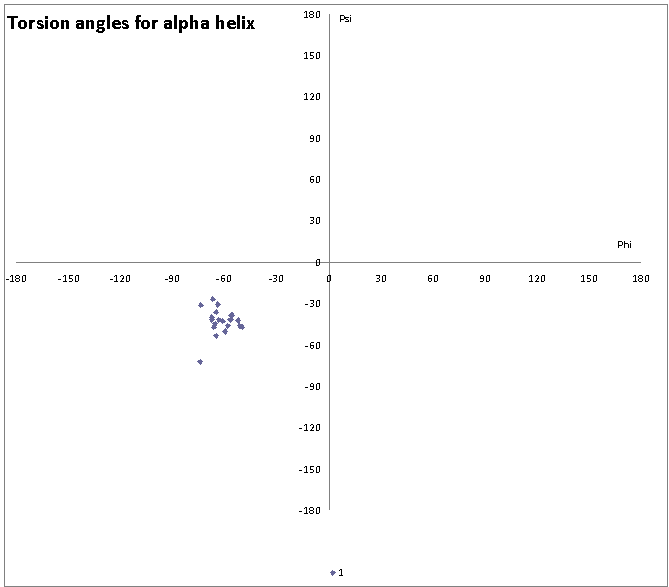Торсионные углы
Каждый аминокислотный остаток (за исключением концевых) принимает участие в образовании двух пептидных связей. Вращение вокруг связи С-N затруднены,поэтому происходит вращение вокруг N-Ca и Ca-C(O) связей. Эти повороты измеряются двухгранными углами. Эти углы соответственно называются Phi и Psi. Для отсчета этих углов прибегают к следующему приему. Представляем,что смотрим вдоль связи N-Ca,то связь Ca-C(O) отклоняется до полного наложения "предыдущей" связью на определенный угол-Phi. Аналогично действуем для угла Psi-смотрим вдоль связи Ca-C(O). Значения этих углов определяет положение аминокислоты во вторичной структуре белка. Если указать значения для всей последовательности,то определится свертывание белка в пространстве. Карты Рамачандрана помогают описать стериохимию аминокислотных остатков в белках,они строятся на основании данных торсионных углов. По одной из осей отмечаются значения угла Phi от -180 до 180,по другой-угла Psi. Построем карты Рамачандрана для альфа-спирали и всего белка.
Для этого выполним следующие действия:
select structure (выбираем альфа-спираль или цепь А в этом случае)
phipsi (далее путь для сохранения)
Затем полученные данные переносим в Exсel,там создаем точечную диаграмму из значений углов Phi и Psi.
Распределение углов в альфа-спирали(352-372) цепи А белка 1LI5:
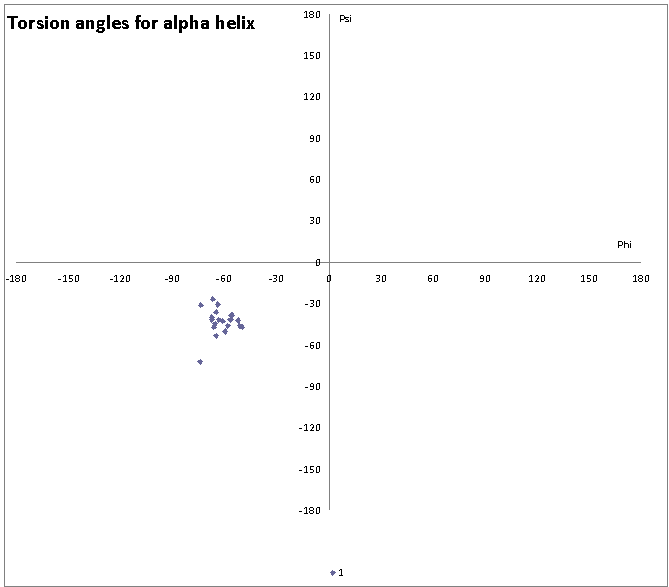
|
|
Для выбранной мной альфа-спирали наиболее типичные значения торсионных углов Phi=-61.6 и Psi=-43.06
|
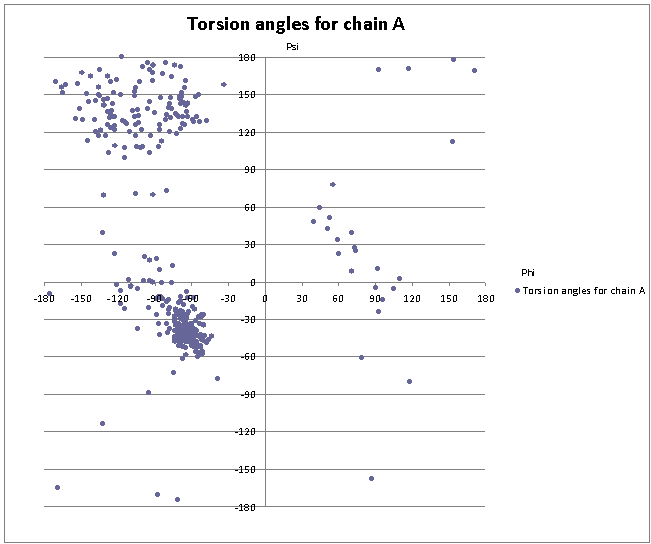
Распределение углов в цепи А белка 1LI5:
|
Из диаграммы видно, что основными элементами вторичной структуры являются альфа-спирали (углы в верхнем правом углу третьей четверти координатной плоскости) и бета-тяжи (углы в верхней части второй четверти координатной плоскости).
Структура белка 1LI5
К начальной странице
©Пискунова Юлия 2008