Обзор белка
структура в целом
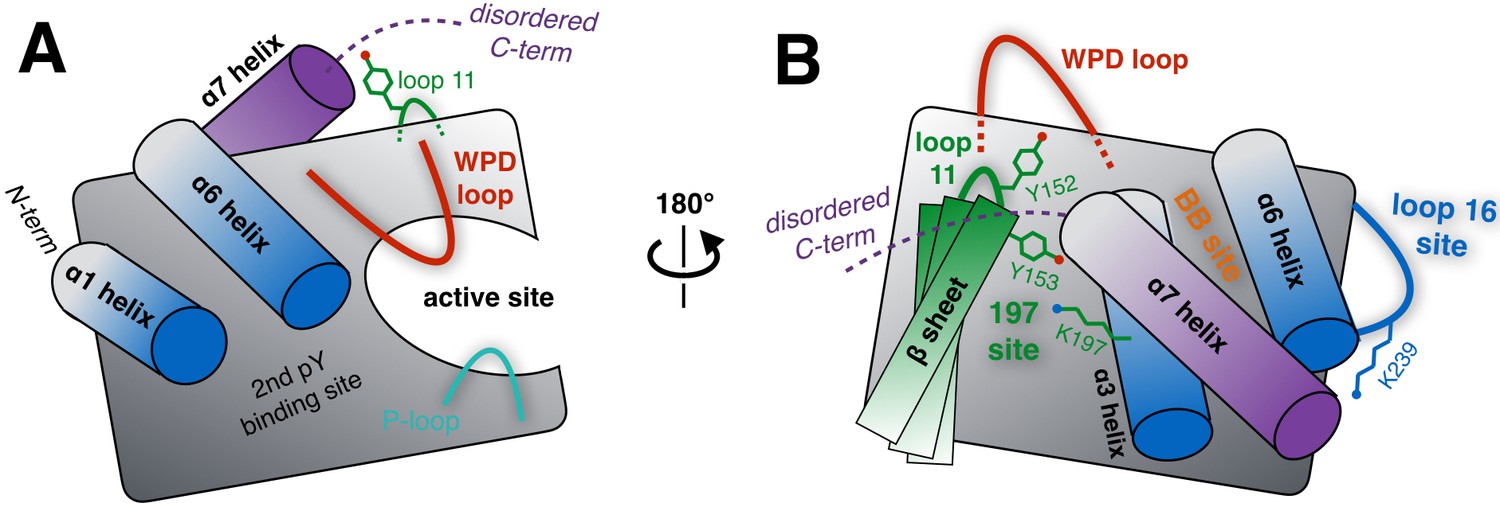
В базе данных PDB идентификатор 7FQW имеет белок класса гидролаз (3.1.3.48) тирозин-протеинфосфотаза, нерецепторный тип 1 (Tyrosine-protein phosphatase non-receptor type 1, PTP1B). Этот белок снижает чувствительность клеток к инсулину, является негативным регулятором передачи сигнала. Он подвержен аллостерической регуляции [1], и создание лекарств, которые были бы способны связываться с его аллостерическими сайтами и "выключать" фермент, потенциально позволило бы лечить диабет.
Структура состоит из одной полимерной цепи, которая представляет собой одну биологическую единицу. Общая длинна последовательности составляет 321 а.о., но остатки с 283 по 321 отмечены как немоделируемые и не показаны в структуре. Белок синтезируется человеком.
Uniprot ID: PTN1_HUMAN
Тирозин-протеин фозфата катализирует реакцию дефосфорилирования тирозина протеинкиназы R (EIF2AK3/PERK), инактивируя ее (а функция протеин-киназы — фосфорилирование фактора инициации трансляции эукариот, что подавляет трансляцию). Также может участвовать в сигнальных каскадах.
В последовательности есть мутации относительно референса на PDB: два mismatch'a на позициях 32 и 92, они отмечены как "engineered". Модифицированных аминокислотных остатков нет.
вторичная структура и взаимодействия
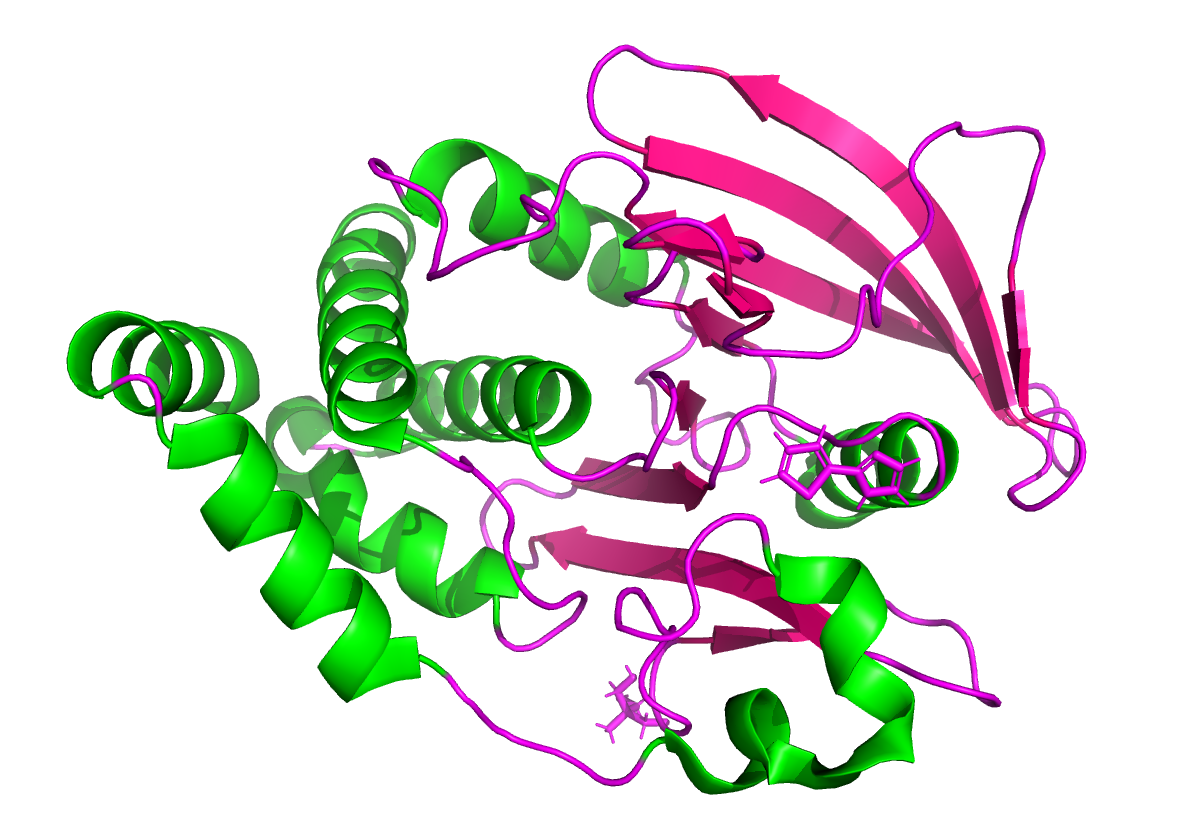
Белок со смешанной вторичной структурой, содержит в одинаковом соотношении как альфа-спирали, так и бета-листы, также есть много цепей-поворотов без водородных связей.
малые молекулы
Помимо воды, в белке присутствуют следующие малые молекулы: JG4 — 2-(тиофен-2-ил)-1H-имидазол, C7H6N2S и TRS — 2-амино-2-гидроксиметил-пропан-1,3-диол, C4H12NO3. Судя по статье, эти молекулы добавлены для исследования отличий криокристаллографии от кристаллографии при комнатной температуре: авторы брали множество различных лигандов и смотрели, как отличаются структуры, полученные при разных температурах.