| № связи | N | O | Длина связи, ангстрем | Угол между атомами N, O и C |
| 1 | Asp 94:B | Ser 55:B | 2.81 | 137 |
| 2 | His 57:B | Ala 92:B | 2.83 | 165.4 |
| 3 | Ala 92:B | His 57:B | 2.81 | 154.7 |
| 4 | Phe 90:B | Val 59:B | 2.88 | 142 |
| 5 | Val 59:B | Phe 90:B | 2.81 | 155.2 |
| 6 | Ile 88:B | Val 61:B | 2.73 | 148.5 |
| 7 | Val 61:B | Ile 88:B | 2.86 | 162.5 |
| № связи | N | O | Длина связи, ангстрем | Угол между атомами N, O и C |
| 1 | Gln 38:B | Arg 34:B | 2.92 | 142.8 |
| 2 | Lys 39:B | Asp 35:B | 3.08 | 146.8 |
| 3 | Met 40:B | Glu 36:B | 2.85 | 159.7 |
| 4 | Ile 41:B | Leu 37:B | 2.94 | 154.1 |
| 5 | Ala 42:B | Gln 38:B | 2.89 | 151.1 |
| 6 | Glu 43:B | Lys 39:B | 2.93 | 153.6 |
| 7 | Ala 44:B | Met 40:B | 2.90 | 153.6 |
| 8 | Ala 45:B | Ile 41:B | 2.89 | 136.2 |
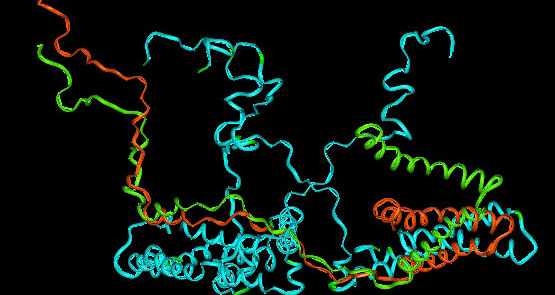
С помощью апплета программы Jmol получено несколько изображений вышеуказанного белка, элементов его вторичной, третичной и
четвертичной структуры. Далее мы измерили длины водородных связей в одной из альфа-спиралей и в 2 бета-тяжах, а так же угол N-O-C.
Попытаемся проанализировать полученные результаты.
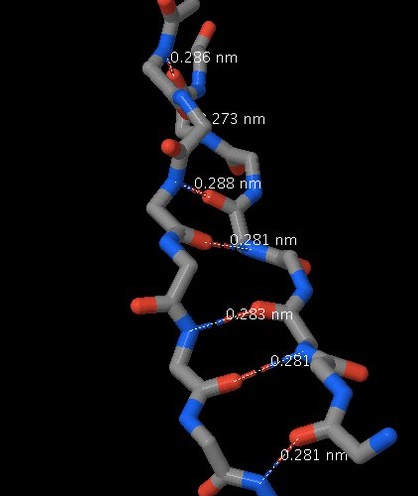
Структура двух бета-тяжей данного белка с обозначением водородных связей между ними
Основная часть β-тяжей расположена по соседству с другими тяжами и образует с ними обширную систему водородных связей между C=O; и N-H группами пептидных остовов. В полностью вытянутом β-листе соседние β-тяжи идут вверх, затем вниз, затем опять вверх и т. д. Соседние β-тяжи в β-листе расположены таким образом, что их Cα атомы находятся рядом и их боковые цепи указывают в одном направлении. Складчатая структура β-тяжа объясняется тем, что углы φ и ψ (между Cα и С=О и Cα и N-H, соответственно) меньше, чем 180° (−139° и +135°), что приводит к зигзагоподобной форме цепи[1].
Энергетически более предпочитаемой является бета-альфа-складчатая структура с почти линейными Н-мостиками. В растянутых складчатых листах отдельные цепи чазе всего не параллельны, а несколько изогнуты друг относительно друга. Боковые цепи ориентированы почти перпендикулярно средней плоскости листа. Для того, чтобы бета-тяж образовался, необходимы бета-петли[3].
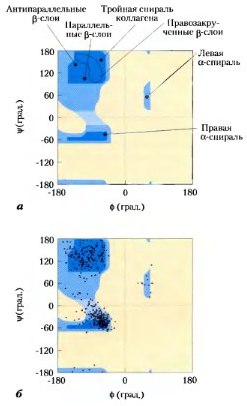
Карта Рамачандрана для различных белковых структур, а) На график, представленный на рис. 4-3. нанесены значения ф и пси для различных вторичных структур. Хотя левые альфа-спирали длиной в несколько аминокислот теоретически могут существовать в белках такой структуры не обнаружено, б) На карте разрешенных конформаций нанесены значения ф и v для всех аминокислотных остатков (за исключением глицина) пнруваткиназы кролика. Небольшие и способные принимать различные конфигурации остатки Gly исключены из рассмотрения, поскольку они часто выпадают из разрешенного диапазона (синего цвета).
На устойчивость альфа-спирали влияют пять типов различных факторов:
1).склонность аминокислотных остатков образовывать альфа-спираль;
2).взаимодействия между R-группами, особенно между находящимися на расстоянии трех (или четырех) аминокислотных остатков;
3).близкое расположение аминокислотных остатков с R-группами большого размера;
4).наличие остатков Cly и Pro;
5).взаимодействие между аминокислотными остатками на N- и C-концах спирального участка и электрическим диполем, возникающем в спирали (каждая пептидная связь имеет небольшой электрический диполь. Эти диполи связаны через водородные связи, возникающие в спирали, в результате чего вся структура представляет собой диполь, причем его величина возрастает с увеличением длины спирали; 4 аминокислоты на каждом конце спирали не полностью вовлечены в образование водородных связей, частичный положительный и частичный отрицательный заряды диполя обычно локалихованы на пептидной аминогруппе и карбонильной группе в близи соответствующих концов спирали. Отрицательно заряженные аминокислоты способны нейтрализовать положительный заряд диполя и наоборот).
Таким образом, способность конкретного участка полипептидной цепи образовывать альфа-спираль зависит от того, какие аминокислоты и в каком порядке расположены на этом участке[2].

Электрический диполь который существует на каждой пептидной связи, по водородным связям распространяется на воо длину «-спирального участка. На рисунке аминогруппы и карбонильные группы каждой пептидной связи обозначены знаками + и - соответственно. N- и С-концевые амино- и карбонильные остатки пептидных групп, не задействованные полностью в образовании водородных связей, показаны красным цветом [3].
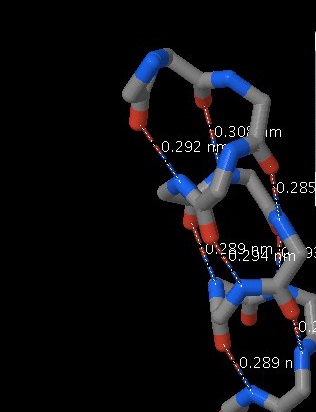
По отдельности водородные связи очень слабы, но за счёт того, что в белке они образуются в огромных количествах, суммарно их вклад в поддержание вторичной структуры очень велик. Верхний предел длины водородных связей в белках - 3,5 А. По данным из Таблицы 1.2 можно заметить, что максимумы длин водородных связей наблюдаются в альфа-спиралях (3,08А). В данном белке преобладают альфа-спирали, что скорее всего коррелирует с его функциями (может связываться с ДНК). Среднее значение длины связи в бета-тяжах - 2,82А.
Структура остова альфа-спирали с обозначением водородных связей данного белка
Склонность аминокислот принимать конформацию альфа-спирали
- Источники: