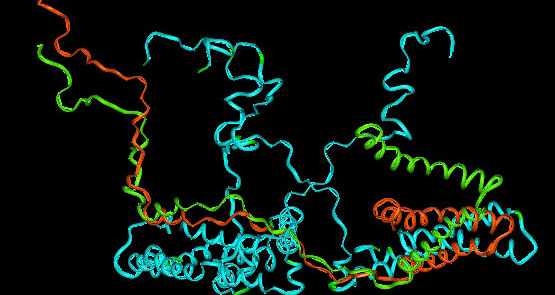
Задание 1. Гидрофобное ядро белка 4QLX
Для того, чтобы запустить скрипт, нажмите "Start script".
Для просмотра следующего изображения нажмите "Resume".
Задание 2. Плотность упаковки атомов в гидрофобном ядре белка 4QLX
Задание 3. Изображение белка 5CYS в комплексе с ДНК
Задание 4a. Части ДНК и расположение доноров и акцетпоров протонов на ее поверхности
Задания 4bc.
Комментарии о гидрофобном ядре белка 4QLX
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса (в органической жидкости доля пространства, занимаемая атомами составляет от 0,4 до 0,6, в типичном кристалле -0,70-0,78, а в глобулярном белке-0,75[1]) между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка. Как можно видеть из программы, запускаемой первым на данной странице скриптом, большинство гидрофобных R-групп сосредоточены внутри молекулы нитратредуктазы и поэтому не контактируют с водной средой (812 из 3363 атомов принадлежат гидрофобному ядру, что составляет 24,15%), R-группы занимают почти все свободное место внутри свернутой молекулы белка (что очевидно из первого изображения, зеленый цвет). Вероятно, наличие протяженных гидрофобных участков на поверхности напрямую связано локализацией белка. Обратный пример тому – миоглобин – здесь крайне мало участков ядра, выходящего на поверхность – во- первых, это связано с тем, что белок постоянно контактирует с кровью, находясь в мышечных клетках; возможность окисления железа супероксидными радикалами (вследствие высокого метаболизма), по-видимому, снижается за счет нахождения в «недрах белка». Таким образом, наличие протяженных гидрофобных участков на поверхности может означать нахождение этой части в плотной среде, в которой практически нет колебаний состава – например, находиться в мембране или являться площадками для посадки некоего ион-активируемого белка с ныне открытыми гидрофобными поверхностями. Действительно, такие белки есть, например, те, функции которых регулируются кальмодулином. Под действием Са2 + в структуре кальмодулина появились две гидрофобные области, пространственно удаленные друг от друга, стремящиеся избежать контакта с водой и ищущие партнера, имеющего такие же неприкрытые гидрофобные участки. Очевидно, что в таком состоянии кальмодулин будет охотно взаимодействовать с гидрофобной поверхностью амфифильной спирали белка-мишени. Особенно прочный контакт между белком-мишенью и кальмодулином (имеющим гидрофобные центры, пространственно удаленные друг от друга) станет возможным в том случае, если центральная спираль кальмодулина «расплавится» и изогнется, а две гидрофобные поверхности кальмодулина как бы «обнимут» амфифильную спираль белка-мишени. При таком расположении гидрофильная, положительно заряженная поверхность амфифильной a-спирали белка-мишени сможет контактировать с отрицательно заряженными остатками «расплавленной» и изогнутой центральной спирали кальмодулина[2].
Функции кальмодулина[3]При сближении атомов на расстояние, меньшее суммы их ван-дер-ваальсовых радиусов, возникает сильное межатомное отталкивание. Поэтому ван-дер-ваальсовы радиусы характеризуют минимальные допустимые контакты атомов, принадлежащих разным молекулам [4]. Минимальное расстояние, на котором расположены атомы, полностью покрывающие поверхность данного остатка составляет менее 6 А. Условимся, что связи длины более 1,6А – нековалентные. Измеряя расстояния, можно отметить, что значения, на котором появляется большинство атомов, которые почти полностью закрывают выбранный остаток, колеблются от 3,96 до 4,97 (примерно 4 и 5А), что соотносится с данными из литературы. Как известно, гидрофобные ядра состоят остатков, взаимодействие воды с которыми бы разрушило структуру белка («вывернуло наизнанку»). То есть, нахождение молекул воды в гидрофобном ядре представляется крайне нежелательным. Однако, рассчитаем, насколько это возможно в принципе и какой эффект может оказывать на функционирование белка. Ван-дер-ваальсов радиус приблизительно равен радиусу кислорода, т.е. 1,4 ангстрема. Следовательно, диаметр молекулы примерно равен 2,8 ангстрема, что в среднем составляет примерно половину характерного расстояния между атомами белка, а в этом промежутке (4-5 ангстрем) должны помещаться также и половины соседних атомов белка, в том числе и не входящих в ядро. Данный результат не может однозначно отвечать, есть ли в ядре конкретного белка молекулы воды (еще и потому, что ван-дер-ваальсов радиус не является константой). Во всяком случае, можно утверждать, что поместятся небольшие неполярные атомы. Видимо, 1-2 молекулы воды действительно могут попасть в гидрофобное ядро, но, скорее всего, это суммарно не вносит вклада в функционирование белка и определение вероятности этого события не входило в рамки исследования.
Заключение о взаимодействии белка 5CYS с ДНК
Данный белок связан с сахаро-фосфатным остовом ДНК (является лигазой (по международному каталогу ферментов)) и взаимодействует с малой бороздкой молекулы ДНК, что можно определить визуально на модели задания 4. Своей бета-петлей он встраивается в остов ДНК, вынося один нуклеотид за пределы ДНК, внутрь самого себя. У данного белка есть мотив цинковые пальцы (что подтверждается вхождением в его состав лиганда - цинка), включающий в себя альфа-спирали, взаимодействующие с ДНК. Также можно отметить, что белок образует довольно много водородных связей вне основного участка связывания с ДНК и неясно, является ли это причиной его прочного удержания или лишь следствием выполняемой функции (это можно наблюдать на Ван-дер-Ваальсовой модели)(на расстоянии образования водородной связи (около 5 А) расположены атомы одной из альфа спиралей, не входящих в участок взаимодействия с остовом). Вообще говоря, существуют различные белки, взаимодействующие с разными частями ДНК:
- гистоны, составляющие нуклеосомы вместе с ДНК,
- белки, метилирующие ДНК (метилтрансферазы),
- реплицирующие (ДНК-полимеразы),
- РНК-полимеразы, обеспечивающие транскрипцию,
- транскрипционные факторы ,
- регулирующие работу РНК-полимеразы,
- хеликазы, разрывающие водородные связи между цепочками нуклеотидов в молекуле ДНК,
- разрезающие её (рестриктазы),
- белки, осуществляющие репарацию ДНК.
Можно ли по расположению доноров и акцепторов в большой бороздке определить последовательность ДНК
Пропуская через ДНК поток электронов или протонов, можно зарегистрировать координаты доноров и акцепторов, т.е. в конечном итоге, всей последовательности ДНК. Сначала будет поялвяться лишь смутная картина (в виде своеобразных облаков), затем, вероятно, необходимо скорректировать координаты некоторыми точными методами и дополнительными измерениями параметров (углов и связей между атомами, рассчет сил взаимодействий). На данных принципах основан метод рентгеноструктурного анализа [1].
[1]Объяснение механизма реакции из видео
Данная реакция относится к реакциям нуклеофильного замещения, а именно (как видно из описания видео) sn2.
Справка
Реакции нуклеофильного замещения (англ. nucleophilic substitution reaction) — реакции замещения, в которых атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару[5]. Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг.
Все нуклеофилы являются основаниями Льюиса.
Общий вид реакций нуклеофильного замещения:
R-X + Y- > R-Y + X- (где Y- анионный нуклеофил)
R-X + Y-Z > R-Y + X-Z (где Y-Z нейтральный нуклеофил)
Выделяют реакции алифатического (широко распространены) и ароматического (мало распространены) нуклеофильного замещения. Реакции алифатического нуклеофильного замещения играют крайне важную роль в органическом синтезе и широко используются как в лабораторной практике, так и промышленности.
Стройную теорию, описывающую механизм реакций нуклеофильного замещения, обобщив имеющиеся факты и наблюдения, разработали в 1935 году английские учёные Эдвард Хьюз и Кристофер Ингольд. Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения (англ. substitution nucleophilic bimolecular ) происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
R-X + Y- > [Y-R-X]- > R-Y + X-
Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата:
Скорость реакции = k [RX] - [Y]
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.
Ещё в 1895 году году этот эффект обнаружил латышский химик Пауль Вальден («обращение Вальдена»), однако он не смог его объяснить. В 1935 году Хьюз исследуя реакцию оптически активного 2-йодоктана с йодид-ионом обнаружил, что реакция имеет общий второй кинетический порядок и первый по каждому из реагентов, а также, что скорость рацемизации в два раза выше скорости внедрения йода в молекулу йодоктана. Так было сформулировано стереохимическое SN2 правило:
В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стереохимически инвертирует молекулу, в которой он замещает уходящую группу.
Рассмотрим механизм данной реакции.
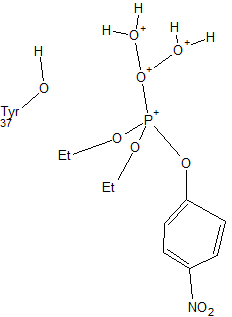
Нуклеофилом в данной реакции является соединение 3-O-этаноламин-паранитробензолфосфат. В целом, схема реакции имеет вид
R-X + Y- > [Y-R-X]- > R-Y + X-где Х-тирозин, Y-3-O-этаноламин-паранитробензолфосфат, R-фосфат
| *Начальное состояние[6] | Первый этап[6] |
| Второй этап[6] | Третий этап[6] |
Первый этап
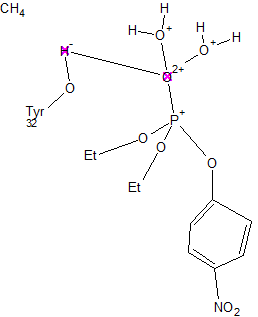
Y атакует ОН-группу тирозина белка, прикрепляяськ бета-петле в районе верхней фосфоангидридной связи, где происходит перераспределение электронной плотности (но степень окисления не меняется - делокализация электронов, эффект резонанса). При этом сначала происходит прикрепление тирозина через ОН-группу.Отрицательный заряд на кислороде стабилизируется водородными связями в оксианионовой дыре
Второй этап
Связь переносится на кислород в соседнем положении.
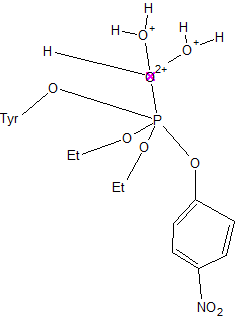
Третий этап
Комплекс приобретает сильный вращательный момент, видимо, это необходимо для переориентации, в результате которой он становится почти перпендикулярен бета-слоям. В данном процессе принимают участие петли. Как можно заметить, также изменяется углы, под которыми расположены бета-тяжи и петли относительно плоскостей. Происходит много, кажущихся на первый взгляд незначительными, сдвигов данных структур. В результате, равновесие в процессе устанавливается, когда последний сдвиг приводит к тому, что кольца тирозина и бензольное кольцо Y находятся в параллельных плоскостях – напряжение вследствие данного нехарактерного расположения возрастает (стереохимическая инверсия [7])
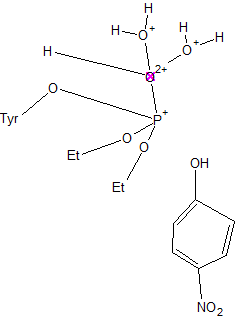
Когда кольцо комплекса почти ориентировано к нам, фосфоангидридная связь (здесь она сильно изогнута) разрывается и претерпевает вращение (с этого момента комплекс всего белка становится неустойчивым (вероятно, какая-то другая молекула должна занять место паранитрофенола или же снова происходит делокализация электронов, что не отражено в данном видео) Нитро-группа на очень короткое время связывается с бета-слоем, затем паранитрофенол отщепляется.
[1] Lehninger, Albert L., David L. Nelson, and Michael M. Cox. 2000. Lehninger principles of biochemistry. New York: Worth Publishers.
[2] Переплет [Электронный ресурс] // URL: http://www.pereplet.ru/obrazovanie/stsoros/540.html
[3]VMEDE [Электронный ресурс] // URL: http://vmede.org/sait/?page=4&id=Fiziologiya_atlas_kamakin_2010&menu=Fiziologiya_atlas_kamakin_2010
[4] Википедия [Электронный ресурс] // URL: https://ru.wikipedia.org/wiki/Радиус_Ван-дер-Ваальса
[5] Википедия [Электронный ресурс] // URL: https://ru.wikipedia.org/wiki/Реакции_нуклеофильного_замещения
[6] YouTube [Электронный ресурс] // URL: https://www.youtube.com/watch?v=UsPbXu_gU44
[7] Химик [Электронный ресурс] // URL: http://www.xumuk.ru/encyklopedia/1360.html
*- изображения получены с помощью программы ChemSketch
© Yuliia Preobrazhenskaya, 2015-2016