Идентификатор PDB: 2HMV
Название белка: "на русском" (Dinoroseobacter shibae)
Количество цепей в PDB-файле: 2 (А и В цепи)
В PDB-файле присутствуют координаты атомов отличных от белка и воды.
Это 2 молекулы аденозиндифосфата(ADP).
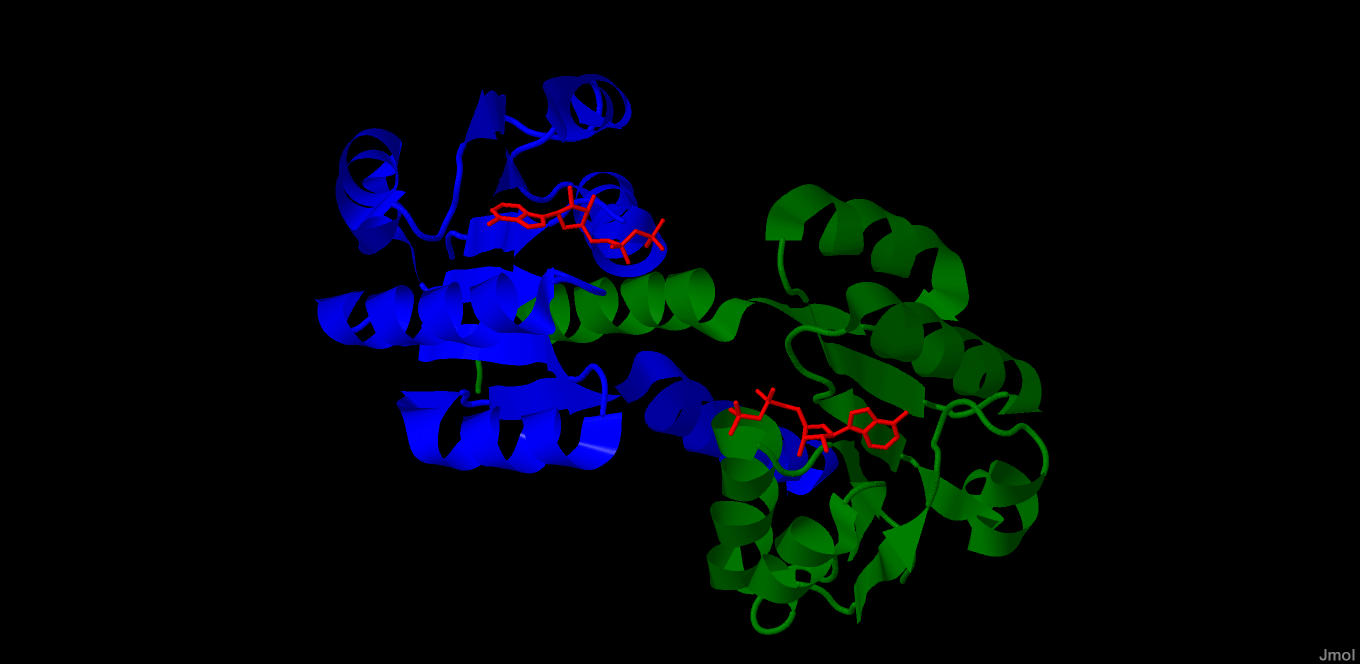 Рис.1. Зеленым цветом выделена цепь A (является
N-концом),синим - цепь В(С-конец), а красным -
молекулы аденозиндифосфата.
Пептидная цепь имеет одно направление и два разных конца — N-конец, несущий свободную
аминогруппу первой аминокислоты, и С-конец, несущий карбоксильную группу последней аминокислоты.
Рис.1. Зеленым цветом выделена цепь A (является
N-концом),синим - цепь В(С-конец), а красным -
молекулы аденозиндифосфата.
Пептидная цепь имеет одно направление и два разных конца — N-конец, несущий свободную
аминогруппу первой аминокислоты, и С-конец, несущий карбоксильную группу последней аминокислоты.
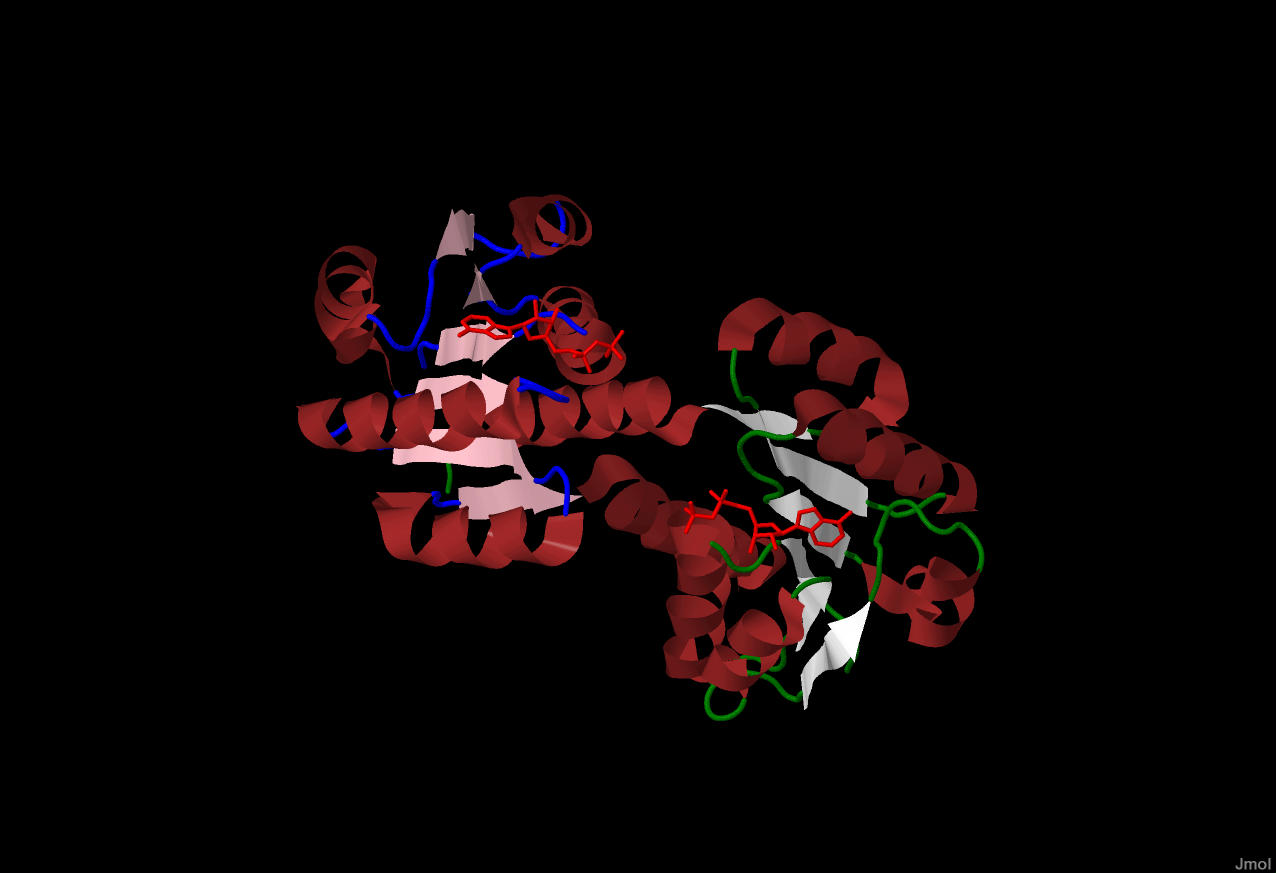 Рис.2. Бардовым цветом показаны альфа-спирали,
белым - бета-лист цепочки А, розовым - бета
лист цепочки В.
Рис.2. Бардовым цветом показаны альфа-спирали,
белым - бета-лист цепочки А, розовым - бета
лист цепочки В.
Анализ структуры альфа-спиралей и бета-листов в цепи А белка с кодом PDB: 2HMV
Рассмотрим их строение на примере альфа-спиралей и бета листа цепи А.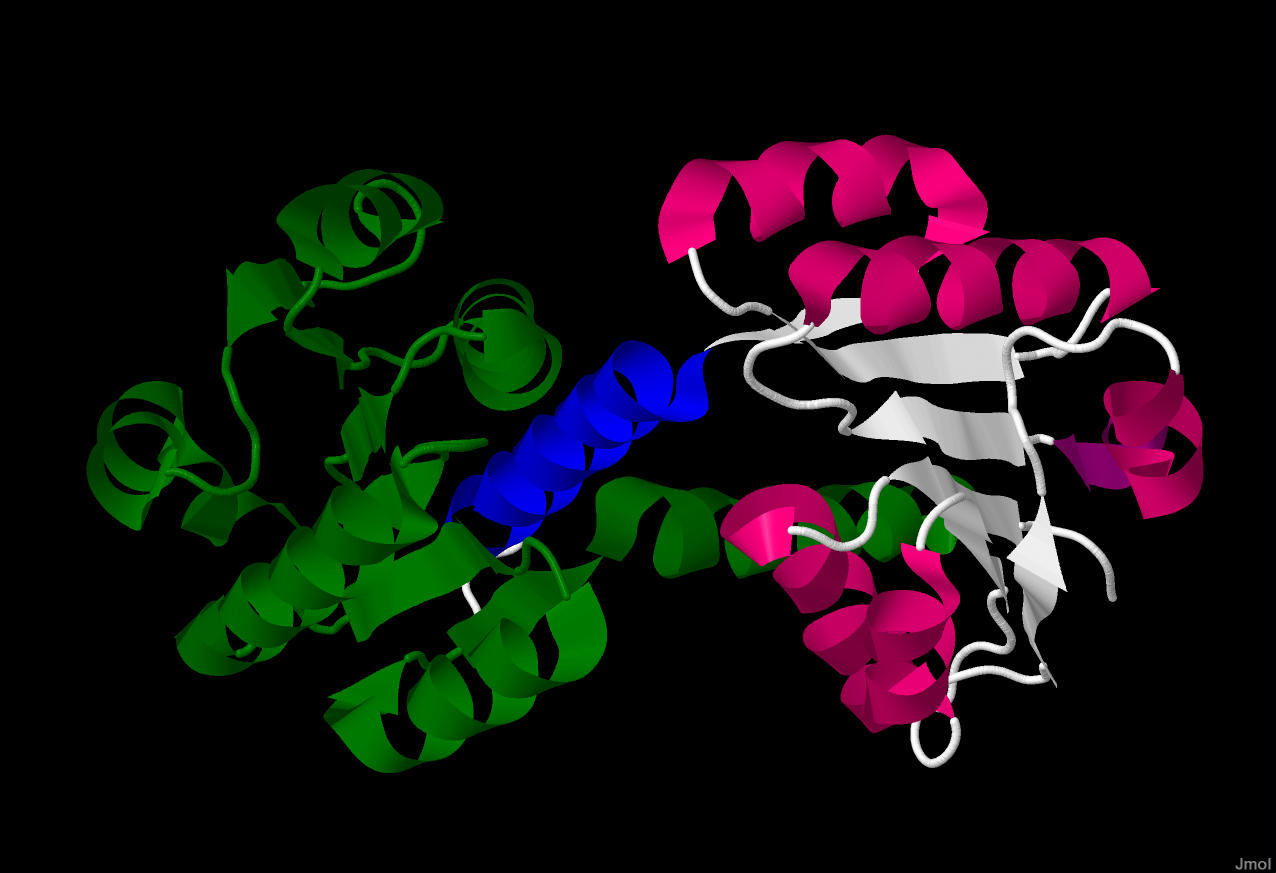 Рис.3. Розовым цветом выделена цепь А, зеленым -
цепь Б. Белым и синим выделены соответственно
бета-лист и одна из альфа-спиралей цепи А.
Выделим отдельно одну альфа-спираль и бета лист цепи А.
Рис.3. Розовым цветом выделена цепь А, зеленым -
цепь Б. Белым и синим выделены соответственно
бета-лист и одна из альфа-спиралей цепи А.
Выделим отдельно одну альфа-спираль и бета лист цепи А.
 Рис.4. Альфа-спираль и бета-лист.
Рис.4. Альфа-спираль и бета-лист.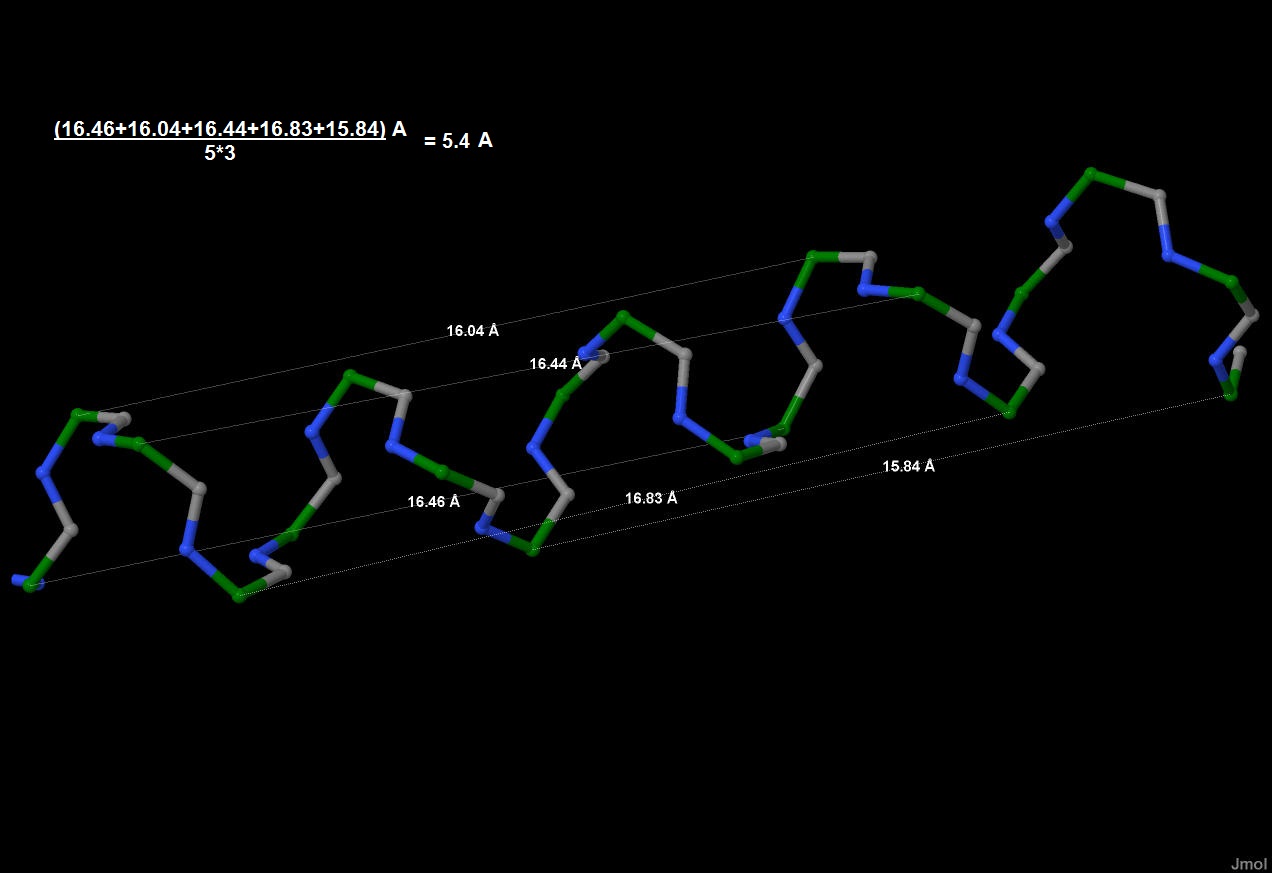 Рис.5.Измерение шага альфа-спирали. Зеленым цветом
выделены С-альфа атомы, серым - атомы углерода
карбонильных групп, синим - азот в аминогруппах,
боковые радикалы цепи не показаны.
Рис.5.Измерение шага альфа-спирали. Зеленым цветом
выделены С-альфа атомы, серым - атомы углерода
карбонильных групп, синим - азот в аминогруппах,
боковые радикалы цепи не показаны.
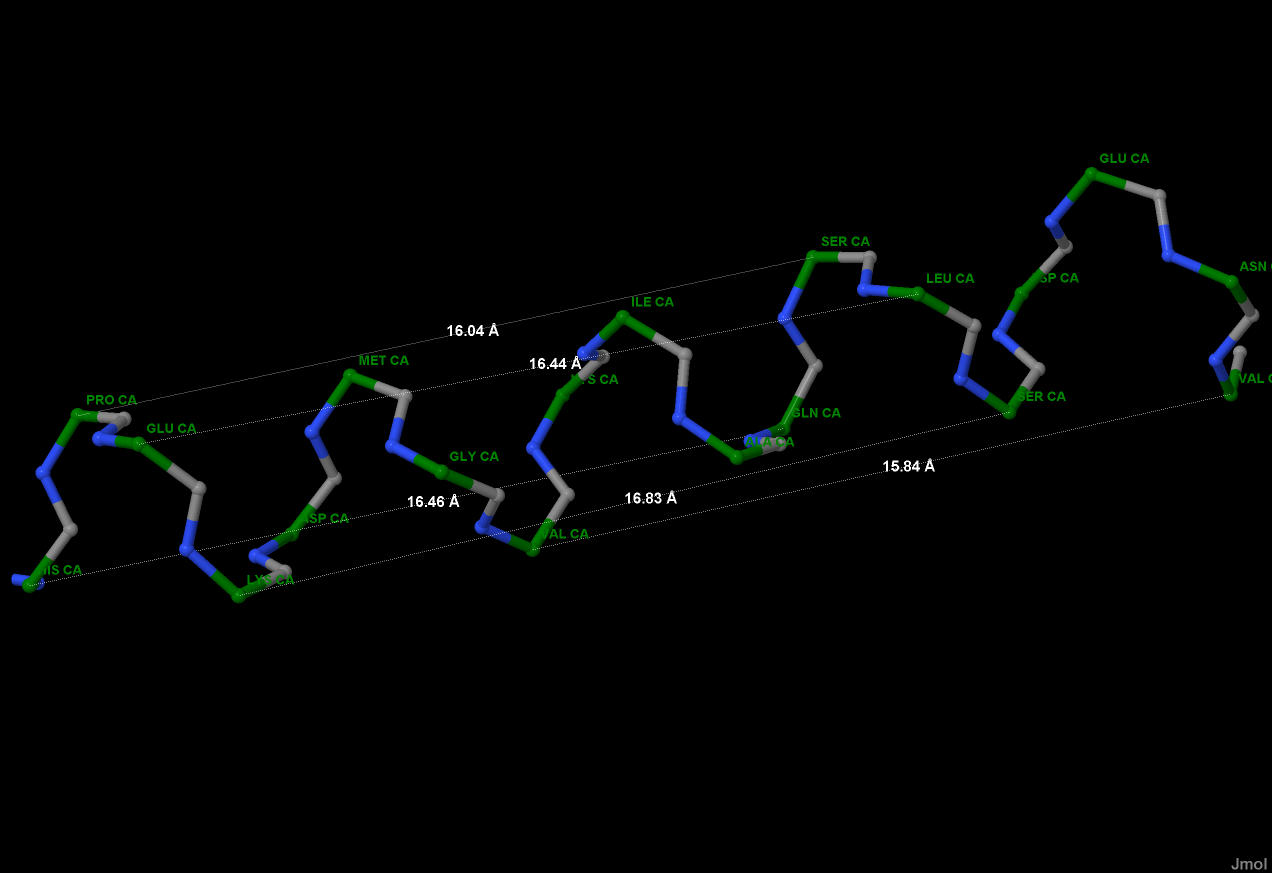 Рис.6.Измерение числа аминокислотных остатков в одном
витке спирали. Показаны трехбуквенные обозначения
остатков, находящихся в альфа-спирали в одинаковом
положении. Зеленый - С-альфа атомы, серый - атомы
углерода карбонильных групп, синий - азот в аминогруппах,
боковые радикалы цепи не показаны.
Рис.6.Измерение числа аминокислотных остатков в одном
витке спирали. Показаны трехбуквенные обозначения
остатков, находящихся в альфа-спирали в одинаковом
положении. Зеленый - С-альфа атомы, серый - атомы
углерода карбонильных групп, синий - азот в аминогруппах,
боковые радикалы цепи не показаны.
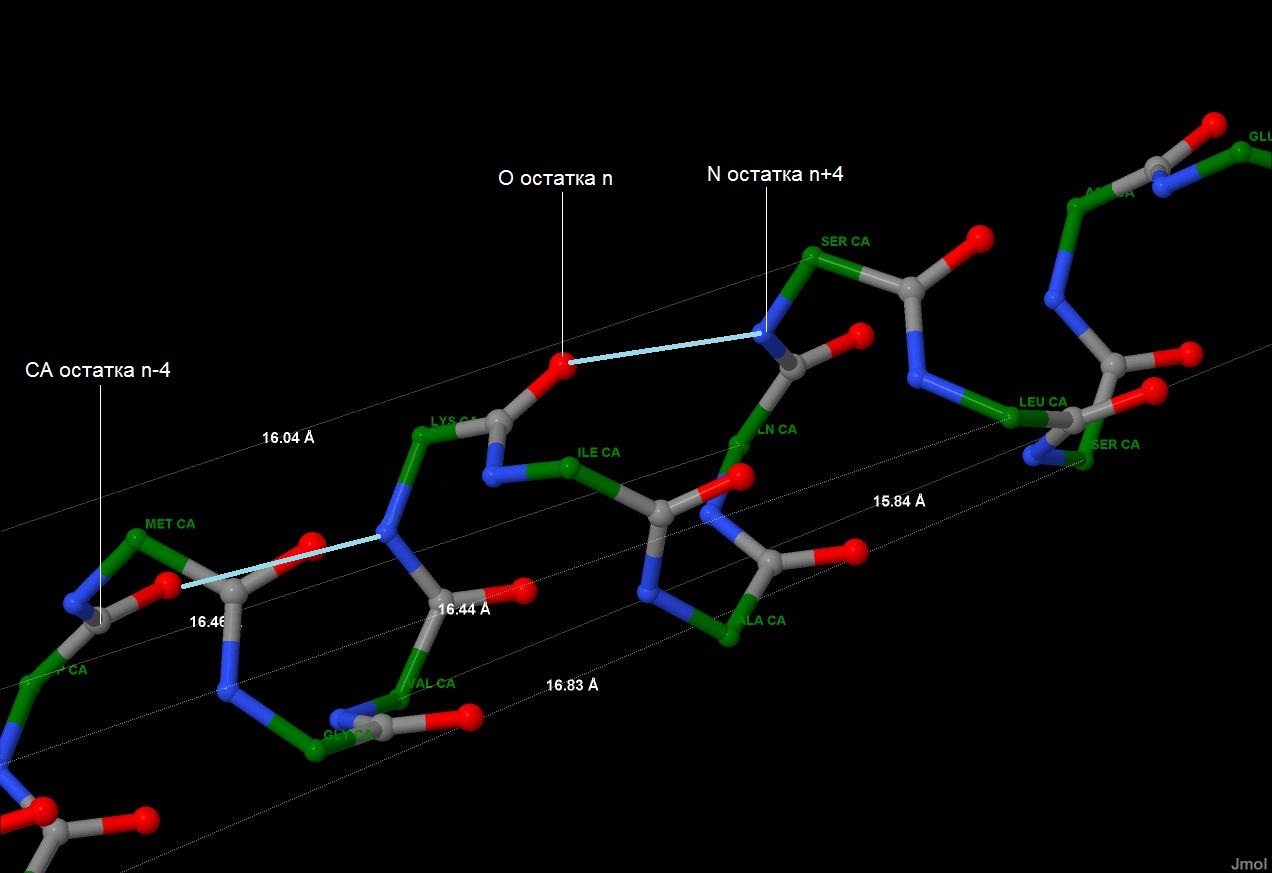 Рис.7. Расположение водородных связей при n-ом
аминокислотном остатке в альфа-спирали. Голубыми
линиями связаны азот и кислород, эти линии
олицетворяют ось водородной связи. Атомы покрашены
стандартными цветами.
Далее мы рассмотрим веба-лист: в данном вета-листе располагаются только параллельных бета-тяжей.
Рис.7. Расположение водородных связей при n-ом
аминокислотном остатке в альфа-спирали. Голубыми
линиями связаны азот и кислород, эти линии
олицетворяют ось водородной связи. Атомы покрашены
стандартными цветами.
Далее мы рассмотрим веба-лист: в данном вета-листе располагаются только параллельных бета-тяжей.
 Рис.8. Бета-тяж с параллельными бета-тяжами.
Вета-лист образует выпукло-выгнутую поверхность.
Рис.8. Бета-тяж с параллельными бета-тяжами.
Вета-лист образует выпукло-выгнутую поверхность.Внутримолекулярные взаимодействия боковых групп белка в цепи А структуры 2HMV
Чтобы узнать, есть ли в моем белке цистеиновые остатки и образуют ли они дисульфидные мостики, надо постараться найти, для начала, в белке цистеин. Я проделаю это с помощью следующего скрипта: select cys на что мне JMol отвечает: 0 atoms selected Это значит, что цистеина в данном белке нет, следовательно некому образовывать дисульфидные мостики. Попытаем свою удачу теперь в обнаружении солевых мостиков. Их образуют положительно- и отрицательнозаряженные аминокислоты. К положительным относятся: лизин, аргинин и гистидин, а к отрицательнозаряженным: аспартат и глутамат.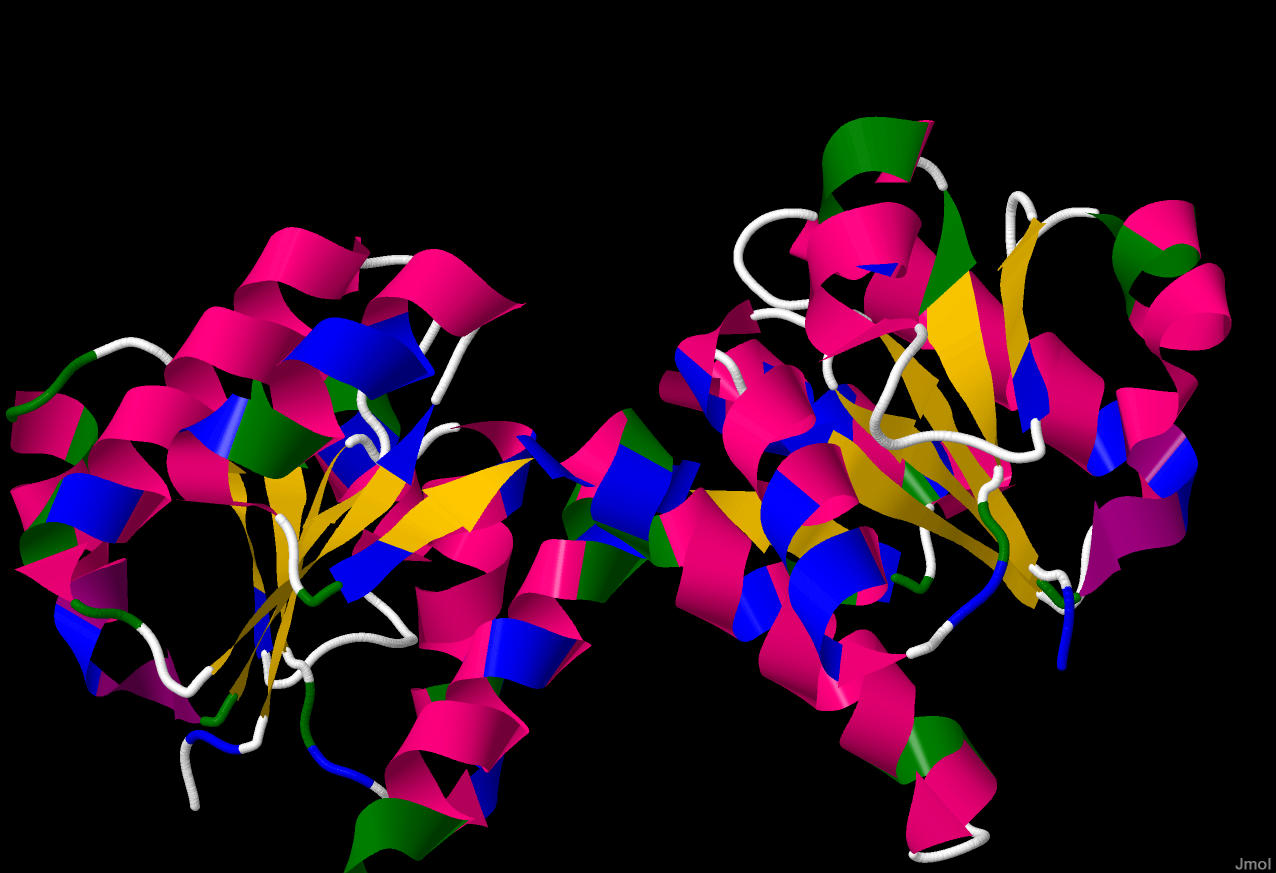 Рис.9. В общей структуре белка синим цветом выделены
положительнозаряженные аминокислоты, зеленым -
отрицательнозаряженные.
Рис.9. В общей структуре белка синим цветом выделены
положительнозаряженные аминокислоты, зеленым -
отрицательнозаряженные.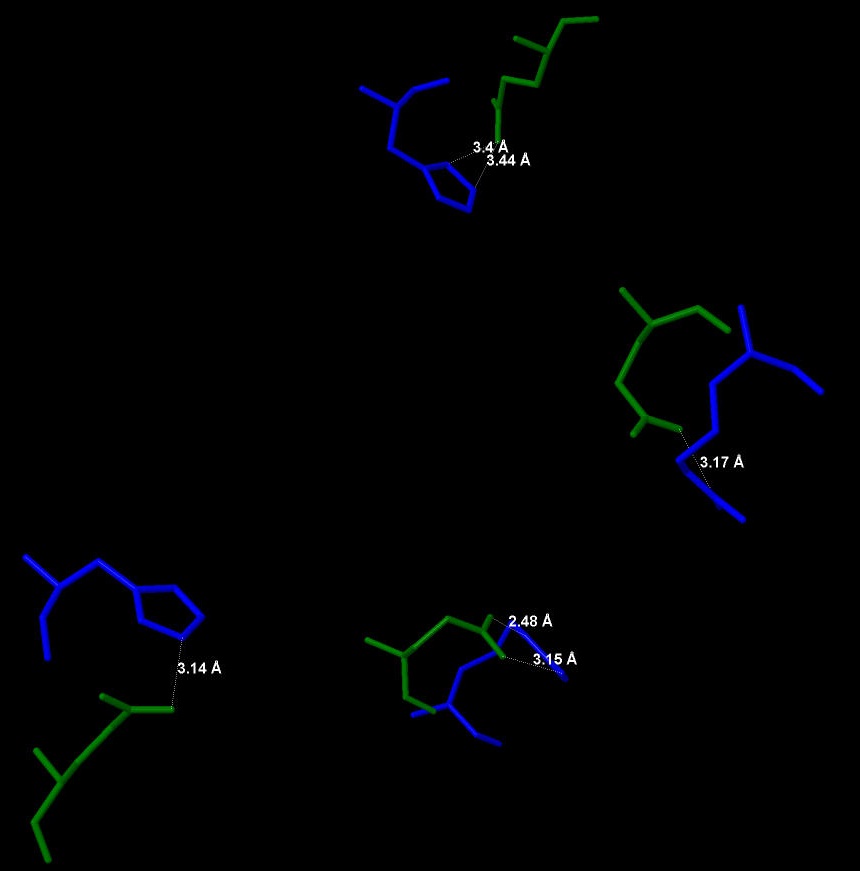 Рис. 10. Четыре солевых мостика в белке K(+)-uptake protein KtrA.
Рассмотрим 2 аминокислоты из цепи А: глутамат( зеленого цвета) и гистидин( синего ).
Рис. 10. Четыре солевых мостика в белке K(+)-uptake protein KtrA.
Рассмотрим 2 аминокислоты из цепи А: глутамат( зеленого цвета) и гистидин( синего ).
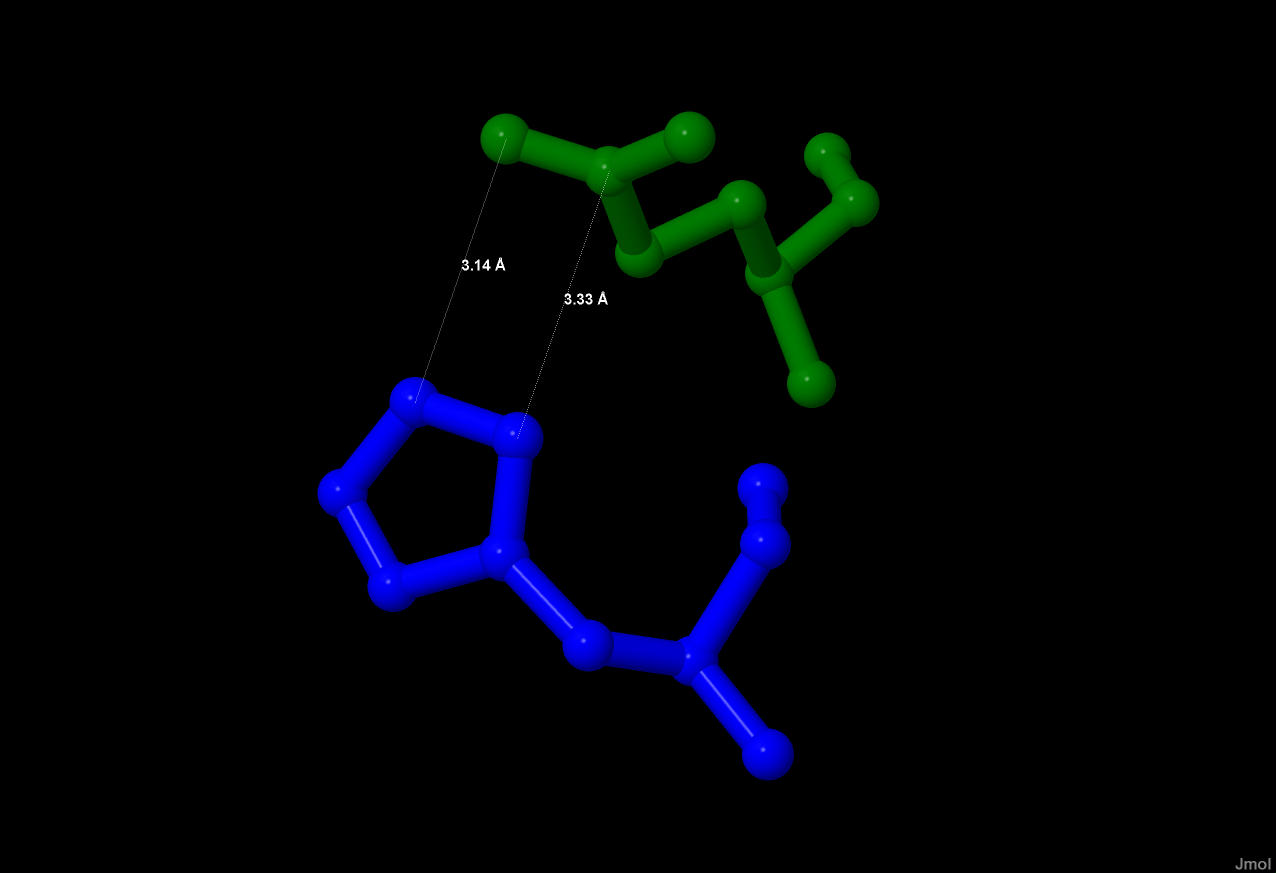 Рис.11. Глутамат и гистидин, образующие солевой мостик(3.23 Анг).
Рис.11. Глутамат и гистидин, образующие солевой мостик(3.23 Анг).