У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа.
Она называется лиганд (лат. ligo - связываю), то есть молекула, связанная с белком.
В роли лиганда могут выступать любые молекулы:
1)молекулы, выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные
элементы, какие-либо другие органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК
и РНК в нуклеопротеинах и т.д.
2)переносимые белками молекулы: железо в трансферрине, гемоглобин в гаптоглобине, гем в гемопексине,
3)субстраты для ферментов – любые молекулы и даже другие белки.
Функции лиганда в составе сложного белка разнообразны:
1)изменяет свойства белков (заряд, растворимость, термолабильность)
2)защищает белок от протеолиза вне и внутри клетки, например углеводная часть в гликопротеинах
3)в виде лиганда обеспечивается транспорт нерастворимых в воде соединений, например,
перенос жиров липопротеинами
4)придает биологическую активность и определяет функцию белка, например, гем в гемоглобине,
углевод в рецепторных белках
5)влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и секрецию белков.
Это выполняет, как правило, углеводный остаток. (Биохимия для студента)
Рассматриваемый нами белок имеет 2 одинаковых лиганда - АДНЕОЗИН-5'-ДИФОСФАТа (сокращенно ADP).
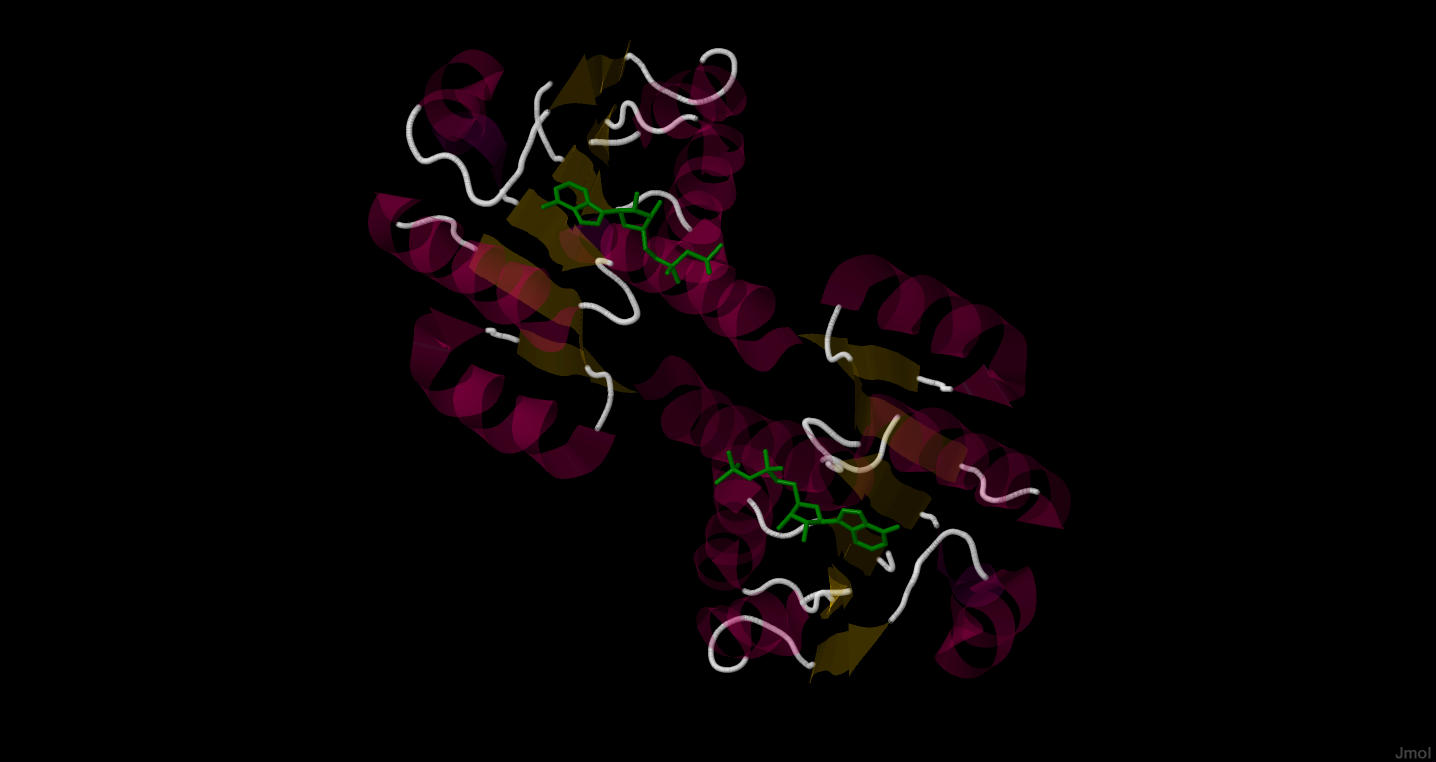 Рис.1. Расположение лигандов - ADP (выделено зеленым)
в структуре 2HMV. Сам белок показан на рисунке
полупрозрачным, чтобы четко видеть расположение ADP
в структуре белка.
Рис.1. Расположение лигандов - ADP (выделено зеленым)
в структуре 2HMV. Сам белок показан на рисунке
полупрозрачным, чтобы четко видеть расположение ADP
в структуре белка.
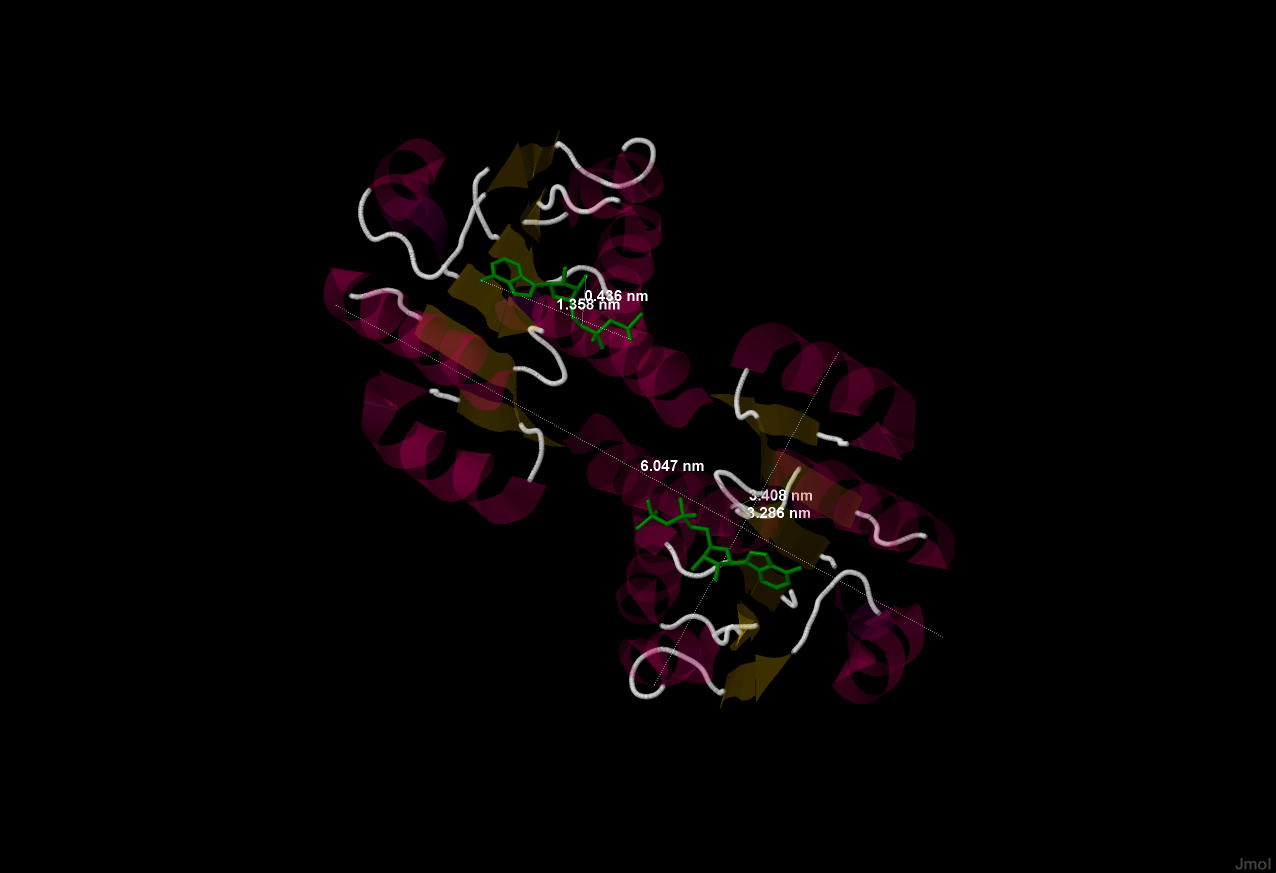 Рис.2. Расчет габаритов белка и лиганда (в нанометрах).
1 nm = 10 Å (ангстрем) = 10^(-10) m (метров).
Рис.2. Расчет габаритов белка и лиганда (в нанометрах).
1 nm = 10 Å (ангстрем) = 10^(-10) m (метров). Анализ области контакта белка из структуры PDB 2HMV и лиганда ADP
Для выявления мест связывания и связей между белком и лигандом, вокруг ADP (принадлежащей цепочки А), средствами программы JMol, была ограничена область пространства, удаленная от любого атома ADP менее, чем на 5 ангстрем. В результате, было найдено 6 предполагаемых связей между молекулами (см.рис. 3)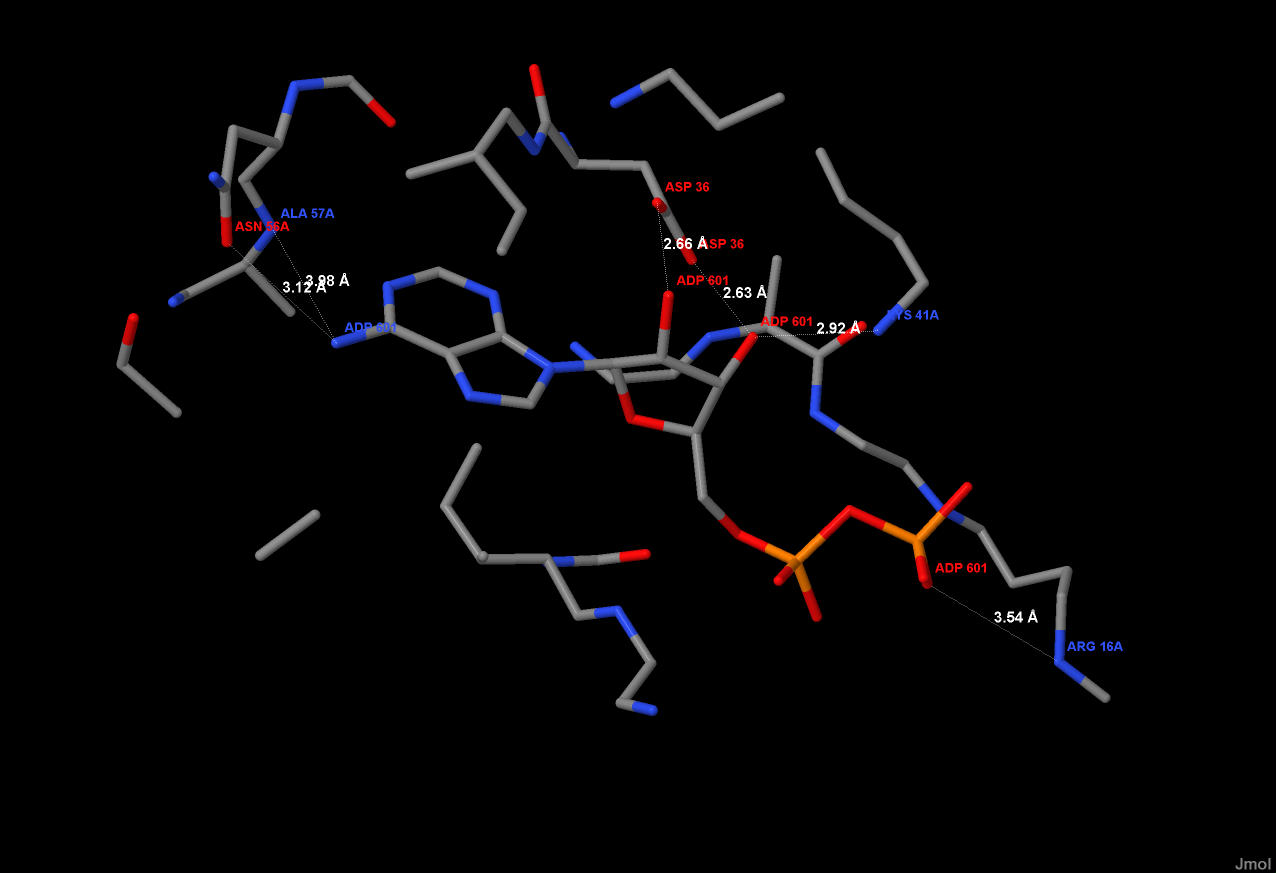 Рис.3. Взаимодействие белка(если быть точнее, цепи А) с ADP. Белок и ADP отображены
с помощью wireframe. Предполагаемые связи показаны пунктиром, длины связей даны в nm.
Атомы имеют стандартную окраску (углерод - серый, азот - синий,кислород - красный,
сера - желтая, фосфор - оранжевый). Подписаны номера остаткаов и трехбуквенное название
аминокислот, образующих химические связи.
Связи:
Рис.3. Взаимодействие белка(если быть точнее, цепи А) с ADP. Белок и ADP отображены
с помощью wireframe. Предполагаемые связи показаны пунктиром, длины связей даны в nm.
Атомы имеют стандартную окраску (углерод - серый, азот - синий,кислород - красный,
сера - желтая, фосфор - оранжевый). Подписаны номера остаткаов и трехбуквенное название
аминокислот, образующих химические связи.
Связи:
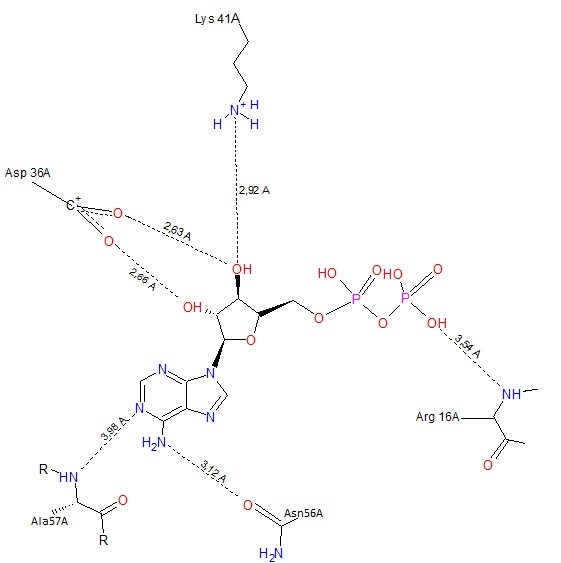 Рис.4. Структурная формула ADP с изображением химических связей с белком.
Черные пунктирные линии - водородные связи, солевые мосты(между ADP и Asp36A, Lys41A).
Если изложенная информация показалась Вам интересной и заслуживающей дополнительного
самостоятельного изучения, предлагаю воспользоваться готовым текстом скрипта JMol, с
помощью которого были получены опубликованные выше изображения(Рис.1 и Рис.3).
Скрипт:
select water
color translucent 1.0
rotate z 50
select adp
wireframe 50
color green
select protein and not adp
color translucent 0.8
rotate x 90
zoom 65
pause
restrict *A
restrict within (5.0, adp)
color cpk
cartoons off
wireframe 30
restrict within (5.0, adp) and *a
select water
color translucent 1.0
select 41:A.NZ or 16:A.NE or 56:A.OD1 or 57:A.N or 36:A.OD1 or 36:A.OD2
label %n %rA
select 601:A.O2' or 601:A.O3' or 601:A.O2B or 601:A.N6
label %n %r
zoom 270
Рис.4. Структурная формула ADP с изображением химических связей с белком.
Черные пунктирные линии - водородные связи, солевые мосты(между ADP и Asp36A, Lys41A).
Если изложенная информация показалась Вам интересной и заслуживающей дополнительного
самостоятельного изучения, предлагаю воспользоваться готовым текстом скрипта JMol, с
помощью которого были получены опубликованные выше изображения(Рис.1 и Рис.3).
Скрипт:
select water
color translucent 1.0
rotate z 50
select adp
wireframe 50
color green
select protein and not adp
color translucent 0.8
rotate x 90
zoom 65
pause
restrict *A
restrict within (5.0, adp)
color cpk
cartoons off
wireframe 30
restrict within (5.0, adp) and *a
select water
color translucent 1.0
select 41:A.NZ or 16:A.NE or 56:A.OD1 or 57:A.N or 36:A.OD1 or 36:A.OD2
label %n %rA
select 601:A.O2' or 601:A.O3' or 601:A.O2B or 601:A.N6
label %n %r
zoom 270