Мною был выбран код в классификации ферментов ЕС: 2.3.3.8
Это означает, что фермент относится к следующим классам:
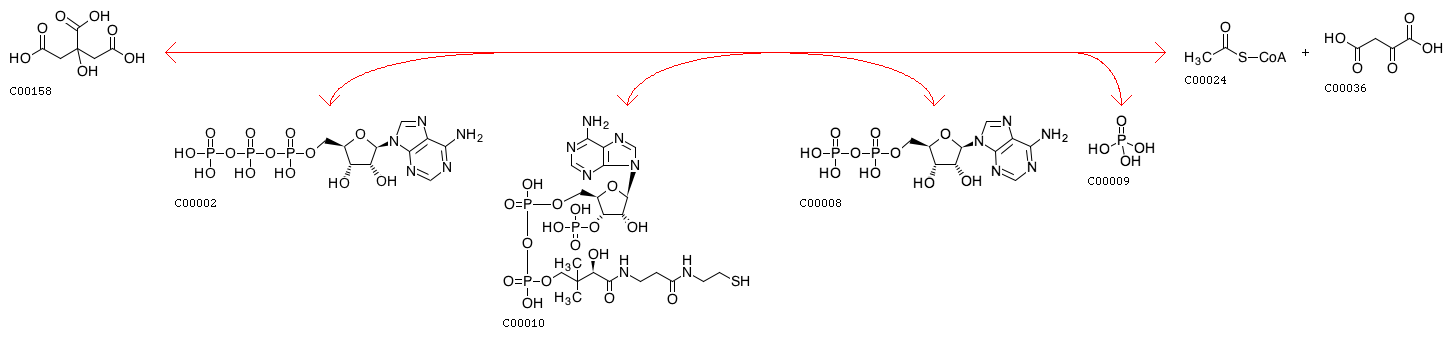
Citrate(C00158) + ATP(C00002) + CoA(C00010) <=> ADP(C00008) + Orthophosphate(C00009) + Acetyl-CoA(C00024) + Oxaloacetate(C00036)

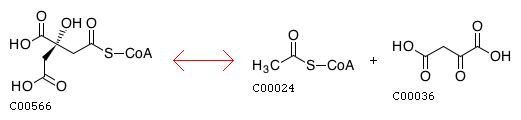
(3S)-Citryl-CoA(C00566) <=> Acetyl-CoA(C00024) + Oxaloacetate(C00036)
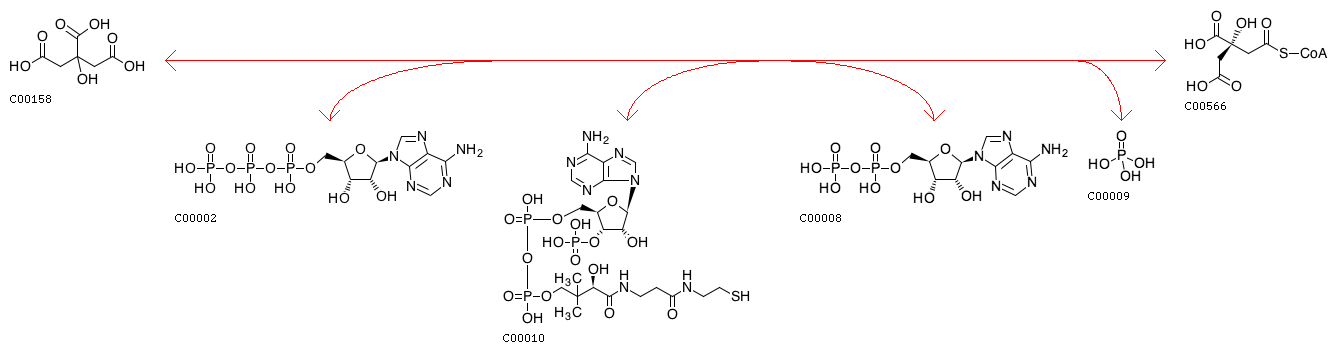
Citrate(C00158) + ATP(C00002) + CoA(C00010) <=> ADP(C00008) + Orthophosphate(C00009) + (3S)-Citryl-CoA(C00566)
Т.е. можем сделать вывод, что Oxaloacetate – кофермент.
Продуктами данной ферментативной реакции являются ATP, citrate, CoA.
Субстраты данной ферментативной реакции: ADP, phosphate, acetyl-CoA, oxaloacetate.
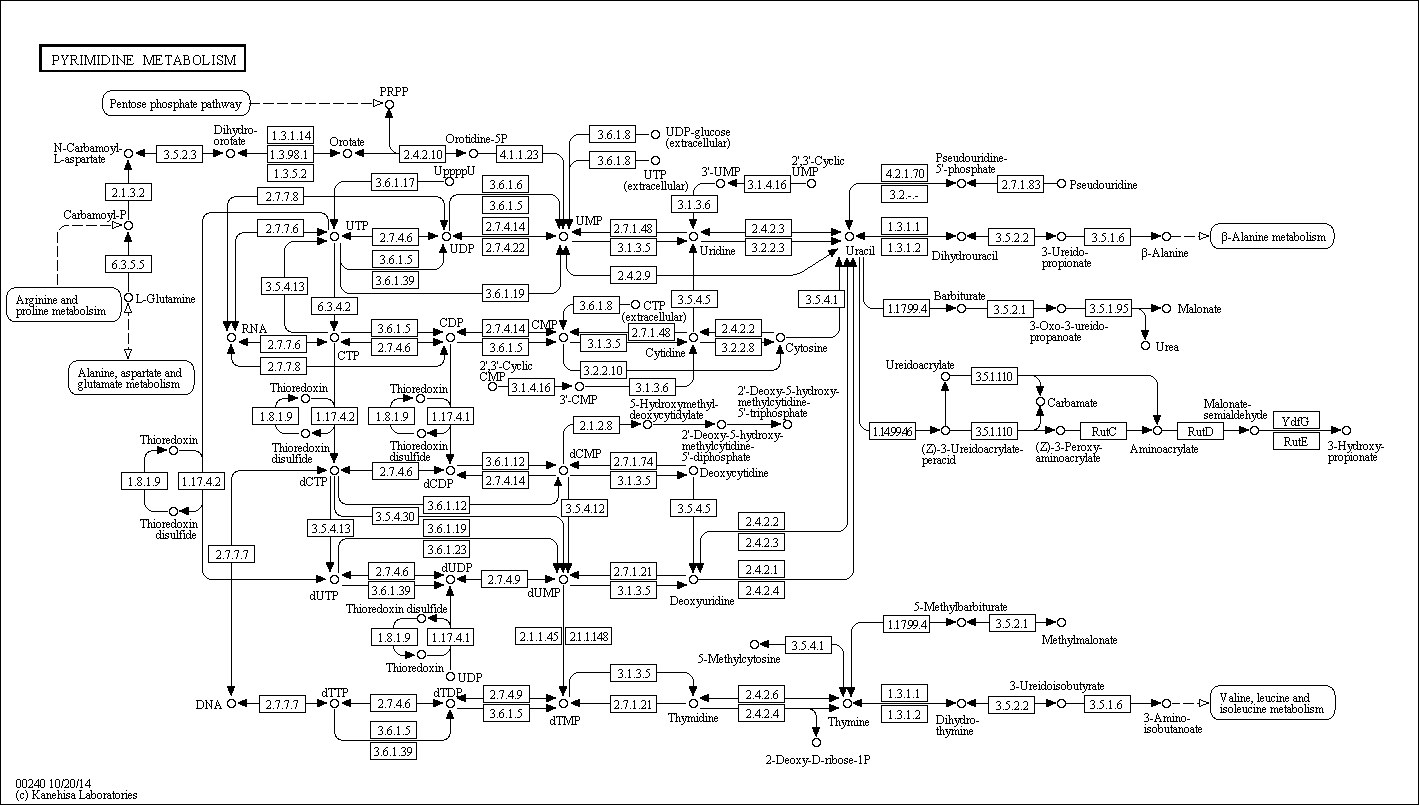
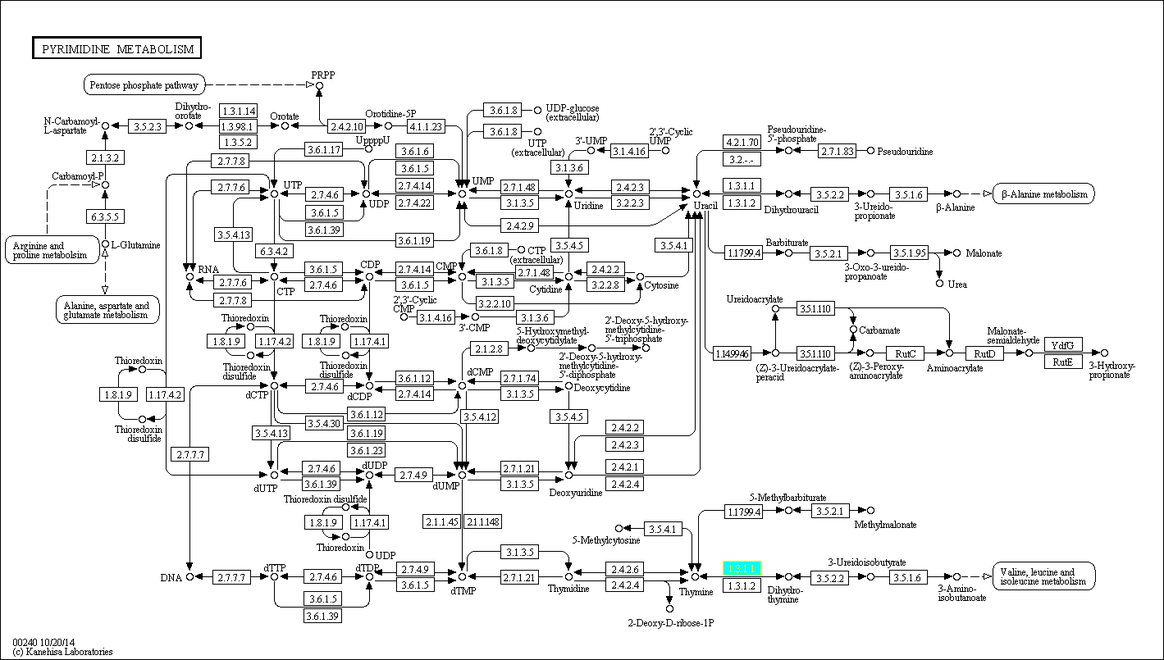
Вот его карта метаболического пути:
Как известно, большая часть нуклеиновых кислот в клетке связана с белком в форме нуклеопротеинов. Поступающие с пищей нуклеопротеины разрушается панкреатическими ферментами, а нуклеопротеины ткани - лизосомальными ферментами. Вначале происходит диссоциация компонентов нуклеопротеинов на белки и нуклеиновые кислоты. Этому способствует кислая среда желудка. Белки затем включаются в обмен вместе с другими белками пищи, а нуклеиновые кислоты гидролизуются нуклеазами сока железы (РНКазами и ДНКазами), с образованием смеси полинуклеотидов (рис 1). Далее в процесс включаются полинуклеотидазы и фосфодиэстеразы (эндонуклеазы) кишечника. Они довершают гидролиз нуклеиновых кислот до мононуклеотидов. В кишечнике, как правило, образуются 3'-фосфат нуклеотиды, а под влиянием лизосомальных полинуклеотидаз образуются биологически важные 5'- фосфат нуклеотиды.
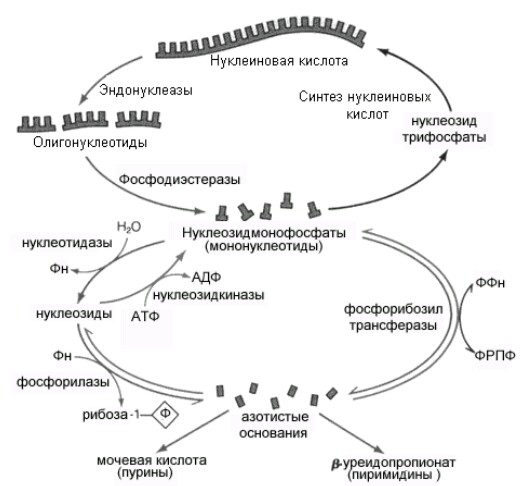
Нуклеотиды гидролизуются нуклеотидазами, с образованием нуклеозидов и Фн. Нуклеозиды, которые обычно рассматриваются как конечный продукт переваривания нуклеиновых кислот в кишечнике, всасываются. В клетках некоторых тканей, в том числе Рис 8.8. Схема катаболизма нуклеиновых кислот и нуклеотидов. клетках кишечника, нуклеозиды подвергаются фосфоролизу нуклеозид фосфорилазами, с образованием оснований и рибозы 1-Ф (или дезоксирибозы 1-P). Рибоза 1-Ф и рибоза 5-Ф в цитозоле находятся в равновесии и могут быть вновь использованы для синтеза нуклеотидов или вступают в неокислительную часть пенозофосфатного пути. Пуриновые и пиримидиновые основания также или распадаются далее до конечных продуктов или используются повторно для синтеза нуклеотидов. В клетке существует интенсивно обмениваемый пул рибонуклеотидов и РНК. Молекулы ДНК и пул дезоксирибонуклеотидов обменивается значительно медленнее. Тканевые пурины и пиримидины, которые не попадают в пути повторного использования, обычно распадаются и продукты их распада выделяются. Используется лишь очень небольшое количество пищевых пуринов, а основная масса поступивших с пищей пуринов распадается. Катаболизм пуринов и пиримидинов не сопровождается значительным высвобождением энергии в сравнении с обменом аминокислот, однако некоторые продукты распада выполняют определенные физиологические функции, например, конечный продукт катаболизма пуринов у человека мочевая кислота, может служить антиоксидантом, продукт катаболизма пиримидина, ?– аланин используется в синтезе активных пептидов мозга и мышц.
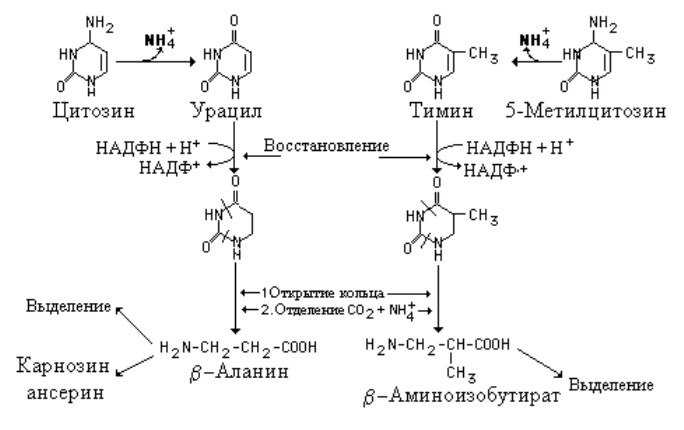
В отличие от пуринов, кольцевая структура пиримидинов разрушается с образованием обычных конечных продуктов катаболизма - ?-аминокислот, аммиака и двуокиси углерода. В катаболизме пиримидиновых нуклеотидов принимают участие нуклеотидазы и пиримидиновые нуклеотид фосфорилазы, которые превращают мононуклеотиды в свободные основания. Аминогруппы цитозина и 5-метилцитозина отделяется в форме аммиака..
Продукты распада нуклеотидов могут повторно использоваться (реутилизацироваться).
Продукты катаболизма нуклеиновых кислот могут использоваться клетками в качестве субстратов для синтеза мононуклеотидов и служить дополнительным источником пула нуклеотидов клеток. Нулеозиды и основания легко проникают через мембраны и могут, при участии системы кровообращения, переносится из клеток одних тканей другим Повторное использование этих продуктов для синтеза нуклеиновых кислот энергетически выгоднее для клеток, чем синтез их de novo. Большинство клеток обладает несколькими путями для преобразования нуклеозидов и свободных оснований назад, до уровня ну-клеотидов. Имеются доказательства того, что биосинтез пуринов в печени обеспечивает предшественниками синтеза ДНК другие клетки, в частности, клетки костного мозга.
В реутилизации продуктов распада нуклеиновых кислот участвуют следующие ферменты:
Несмотря на возможность повторного использования продуктов распада нуклеиновых кислот для синтеза нуклеотидов, значительная доля потребности клеток в нуклеотидах удовлетворяется синтезом нуклеотидов de novo. Этот процесс использует достаточно легко доступные компоненты.
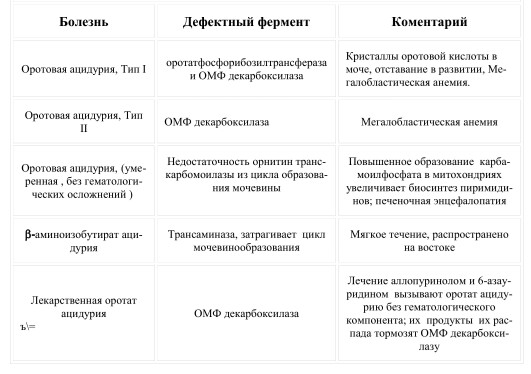
Так же можно ознакомиться со списком болезней, предлагаемых KEGG-ом
Чтобы понять, насколько распространен и консервативен этот путь, я выбрал три организма: эукариота (Xenopus tropicalis), бактерию (Shigella flexneri 2002017) и архею (Thermococcus sibiricus).
Полная таксономия этих организмов:
Западная шпорцевая лягушка может осуществлять данный путь практически целиком, на карте изображены параллельные реакции, приводящие к 1 продукту. Лягушка имеет почти все ферменты для обеспечения работы пиримидиногого метаболизма. А так же возможно перетекание в 5 других метаболитических путей.
У бактерии имеется уже меньше ферментов, работающих в пиримидиновом метаболизме + возможно пересечение с 3 другими метаболитическими путями.
А у архей их(ферментативных путей) еще меньше! + возможно пересечение с 2 другими метаболитическими путями. Поэтому архея и бактерия способны осуществлять лишь отдельные части данного пути.
Кроме путей и ферментов, в базе KEGG хранятся биохимические реакции. Например, запись R01414 содержит реакцию
5,6-Dihydrothymine(C00906) + NAD+(C00003) <=> NADH(C00004) + H+(C00080) + Thymine(C00178)
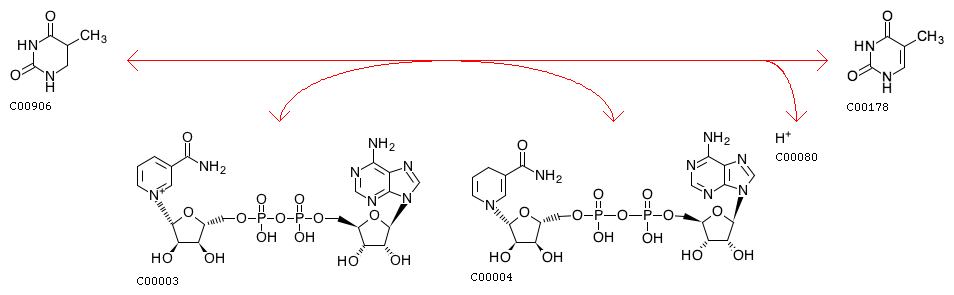
С помощью кнопки User Data Mapping можно покрасить эти реакции в метаболическом пути.
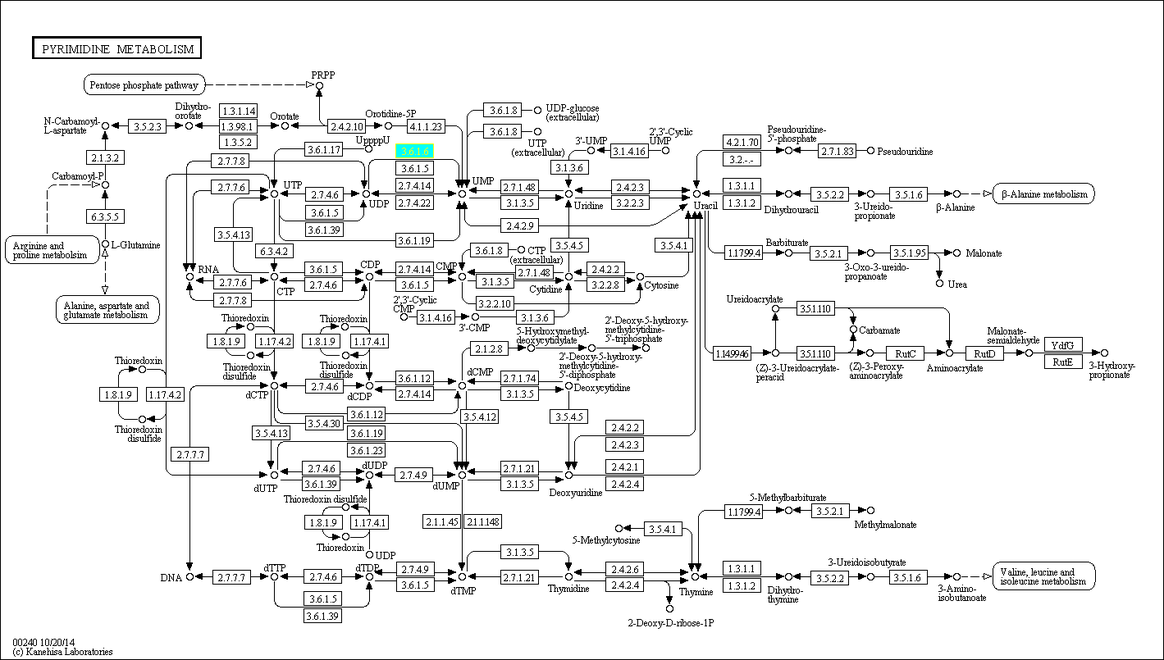
Я выбрал реакцию R00155 , катализируемую ферментом нуклеозид-дифосфатазой(3.6.1.6)
Для этой реакции существуют 3 ортологических ряда белков: K01511, K12304, K12305. В первом из них 74 белков, во втором - 71, в третьем - 24.
Последовательности белков из этих рядов были скачаны и выровнены сервисомMUSCLE. А далее в программе JalView. Множественое выравнивание всех белков из трех ортологических рядов оказалось плохим. Поэтому я был вынужден удалить короткие, плохо выравнивающиеся последовательности.
Конечный проект JalView с выравниванием можно скачать здесь: [x].
Далее программой MEGA было построено дерево методом Neighbor-joining со 100 бутстрэп-репликами.
Дерево четко распадается на 3 клады: первая - гомологический ряд K01511, вторая - K12304, третья - K12305. Поддержка бутстрепом ветвей: K12304 и К12305 - 99, т.е. ветви надежные.
Рисунок того же дерева с бутстрепом.
Однако хочу заметить, что белки кластера K12304 плохо выравниваются с остальными белками (хотя общие выровненные блоки все же имеются, основанные в основном на функциональном сходстве аминокислот, а не на идентичности), поэтому этот ряд белков и выделился в отдельную кладу.
Поэтому можно сделать вывод: K01511 и K12305 действительно являются ортологическими рядами, а K12304 - группа белков, схожих по функции с двумя другими белками, но не являющаяся ортологичной.

Последнее обновление: 3.05.2015