Для работы использовалась 3D структура АТФ-зависимого транспортера калия из Dinoroseobacter shibae, белка, который уже изучался в первом семестре.
PDB-файл белка (PDBid структуры - 2HMV) содержит 2 цепи каждая по 222 аминокислоты.
На сайте PDB есть файл структурных факторов для данной структуры, что говорит о том, что это экспериментальные данные, а не модель.
Чтобы получить карту электронной плотности (ЭП) и информацию о ней, использовался сервер EDS. Выдача сервера о структуре 2HMV:
TRANSPORT PROTEIN 11-JUL-06 2HMV
DIAMOND-SHAPED OCTAMERIC RING STRUCTURE OF AN RCK DOMAIN
2 WITH ADP BOUND
ORGANISM_SCIENTIFIC: BACILLUS SUBTILIS;
ORGANISM_TAXID: 1423;
EXPRESSION_SYSTEM: ESCHERICHIA COLI BL21(DE3);
EXPRESSION_SYSTEM_TAXID: 469008;
EXPRESSION_SYSTEM_STRAIN: BL21(DE3);
EXPRESSION_SYSTEM_VECTOR_TYPE: PLASMID;
EXPRESSION_SYSTEM_PLASMID: PET15B
RCK, KTN, KTR, KTRA, KTRAB, MEMBRANE PROTEIN, ION
TRANSPORTER, SYMPORTER, TRANSPORT PROTEIN
R.A.ALBRIGHT,J.H.MORAIS-CABRAL
24-FEB-09 2HMV 1 VERSN
03-OCT-06 2HMV 1 JRNL
26-SEP-06 2HMV 0
R.A.ALBRIGHT,J.L.IBAR,C.U.KIM,S.M.GRUNER,
J.H.MORAIS-CABRAL
THE RCK DOMAIN OF THE KTRAB K(+) TRANSPORTER:
MULTIPLE CONFORMATIONS OF AN OCTAMERIC RING.
CELL(CAMBRIDGE,MASS.) V. 126 1147 2006
ISSN 0092-8674
16990138
10.1016/J.CELL.2006.08.028
REFERENCE 1
AUTH T.P.ROOSILD,S.MILLER,I.R.BOOTH,S.CHOE
TITL A MECHANISM OF REGULATING TRANSMEMBRANE POTASSIUM
TITL 2 FLUX THROUGH A LIGAND-MEDIATED CONFORMATIONAL
TITL 3 SWITCH
REF CELL(CAMBRIDGE,MASS.) V. 109 781 2002
REFN ISSN 0092-8674
REFERENCE 2
AUTH Y.JIANG,A.LEE,J.CHEN,M.CADENE,B.T.CHAIT,R.MACKINNON
TITL CRYSTAL STRUCTURE AND MECHANISM OF A CALCIUM-GATED
TITL 2 POTASSIUM CHANNEL
REF NATURE V. 417 501 2002
REFN ISSN 0028-0836
RESOLUTION. 2.20 ANGSTROMS.
Разрешение данной структуры 2.20 ангстрем - это хорошее разрешение. Затем с сервера была загружена карта электронной плотности с параметрами по умолчанию.
Структура белка и карта электронной плотности были загружены в программу PyMOL для визуализации.
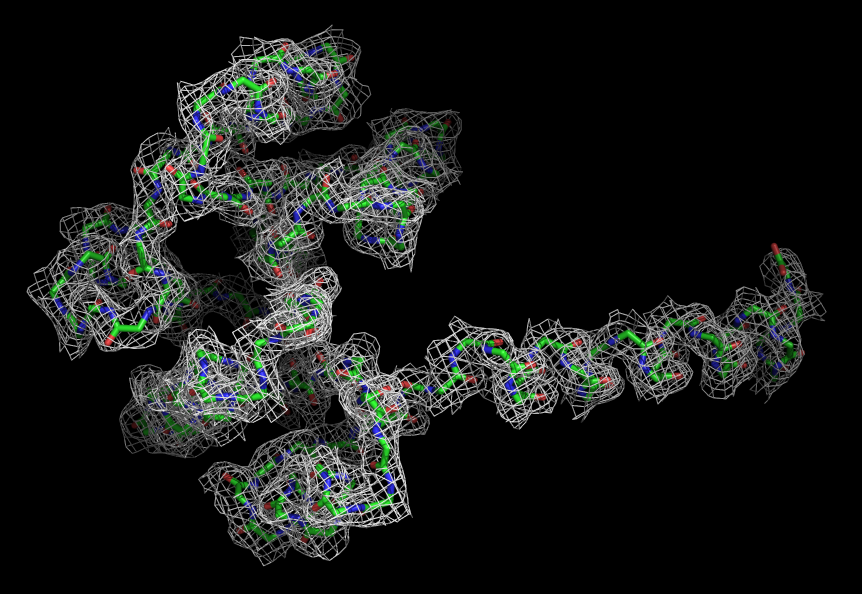
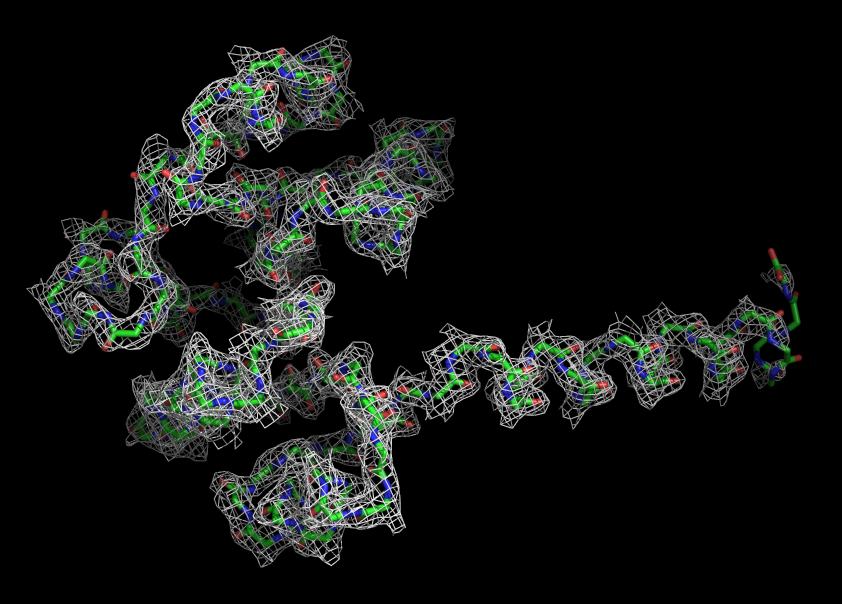
Чтобы оценить, насколько хорошо вцелом остов белка вписывается в карту электронной плотности, ЭП была визуализирована только вокруг остова цепи А.
 |  |
Рис. 1.ЭП вокруг остова цепи А структуры 2HMV. Уровень подрезки слева равен 1,справа - 2.
Видно, что остов очень хорошо вписывается в карту электронной плотности.
Далее ЭП была визуализирована для небольшого участка белка (4 аминокислоты: 88 по 91 позицию, лейцин, треонин, треонин, лейцин).
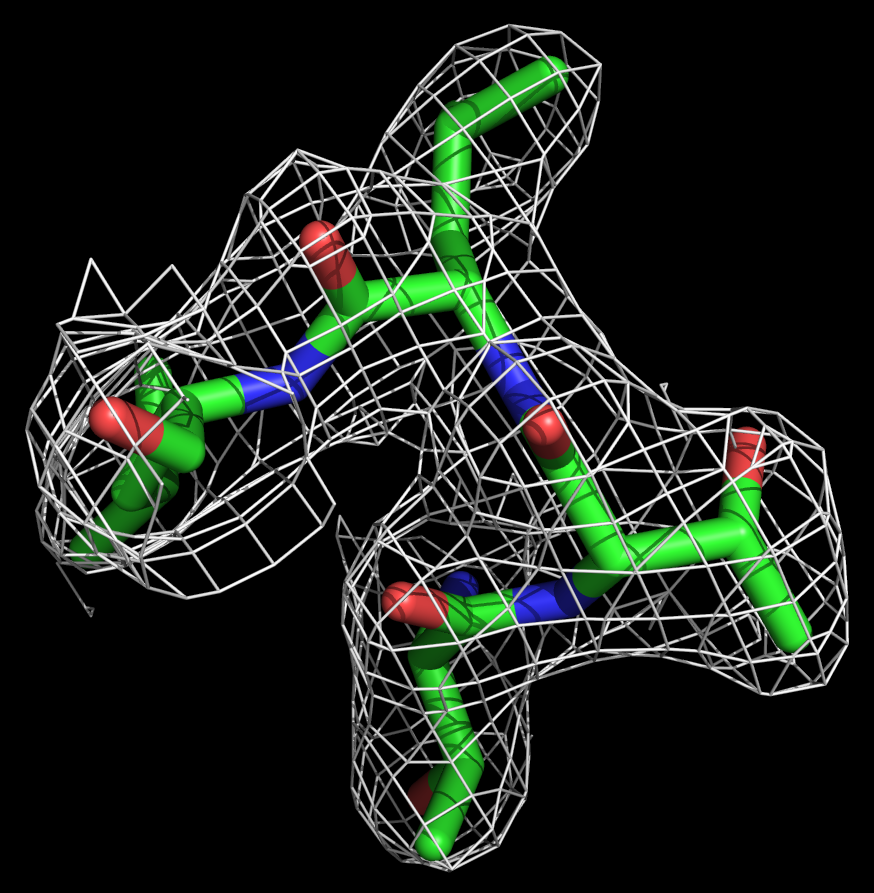 | 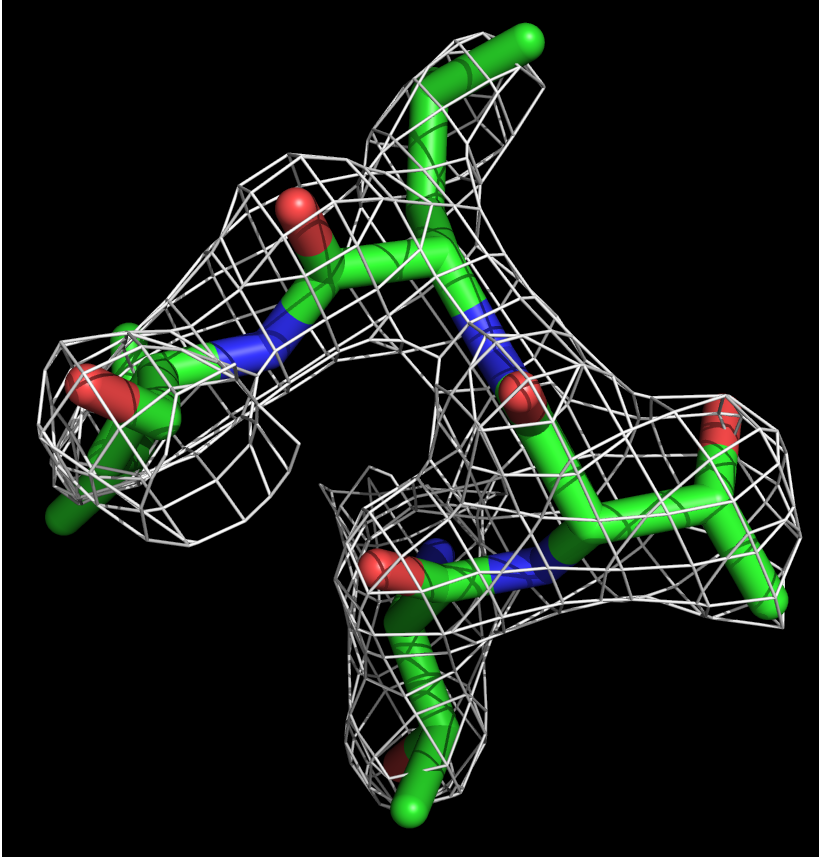 |
Рис. 2.Изображения ЭП при разных уровнях подрезки (слева равен 1,справа - 2) для небольшого участка белка 2HMV.
Видно, что не только остов хорошо вписывается в карту электронной плотности, но и боковые группы аминокислот (см рисунок 2).
Структура имеет хорошее разрешение (1,2 ангстрема). Думаю, что при таких экспериментальных данных можно с определенной точностью предсказать, где располагаются центры атомов в распределении электронной плотности.
Последнее обновление: 9.10.2016