
Был выбран белок (мономер супероксиддисмутазы) для которого существует и ЯМР и РСА структура; ЯМР структура 1BA9. Запись 1BA9 содержит 36 моделей. Структура представляет собой мономер; длина белковой цепи составляет 153 остатка. РСА структура 1MFM. Структура 1MFM имеет атомное разрешение 1.02 Å.
На рисунке 1 показано как расположены различные модели, полученные методом ЯМР между собой.

На рисунке 2 показано взаиморасположение 1MFM структуры, полученной методом РСА и моделей 1BA9.
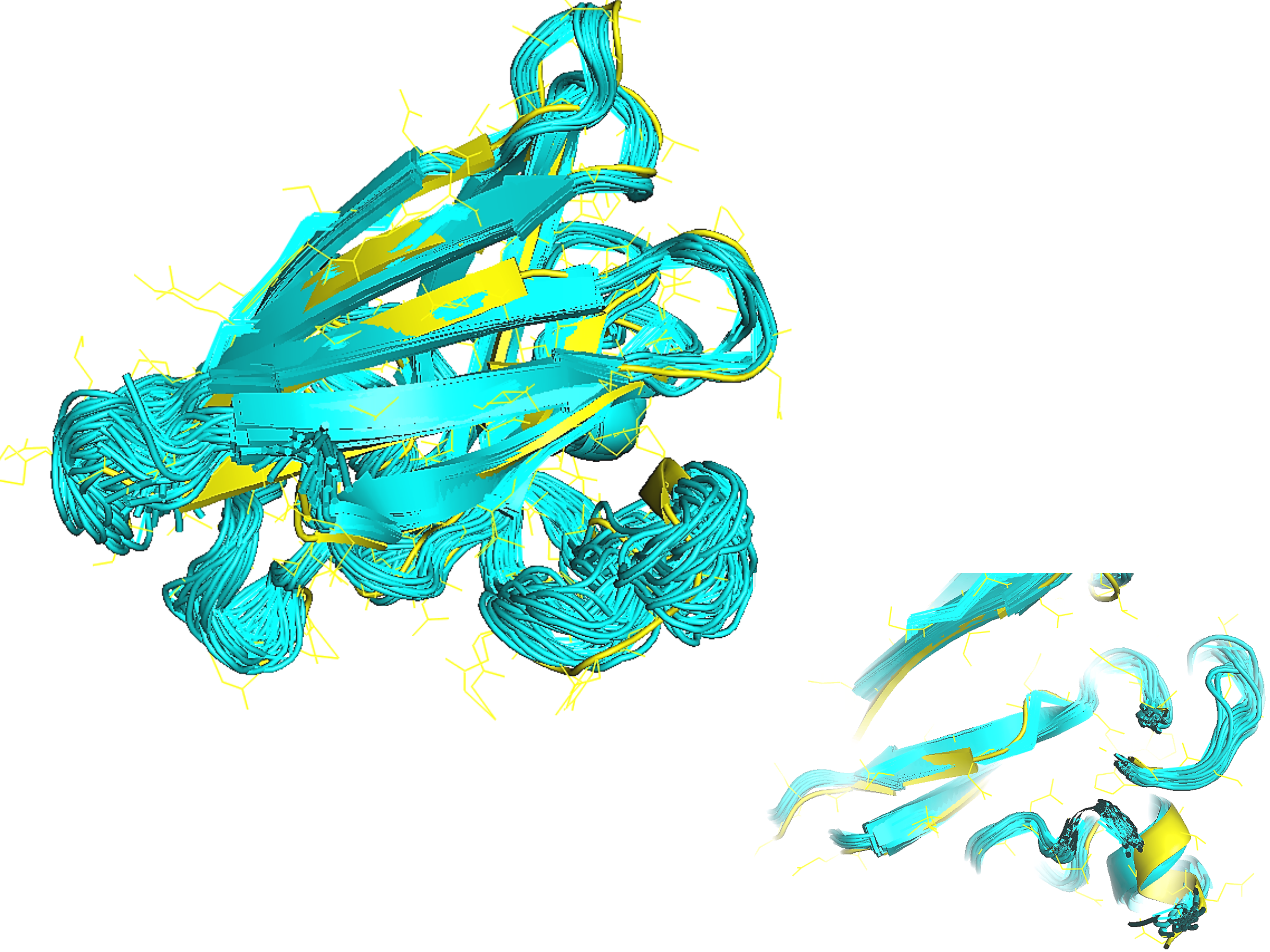
select R, name NH* within 3.5 of OE* select E, OE* within 3.5 of name NH* distance bond, R, E
select Arg, resi 69 and name NH2 select Glu, resi 77 and name OE2 distance bond, Glu, Arg
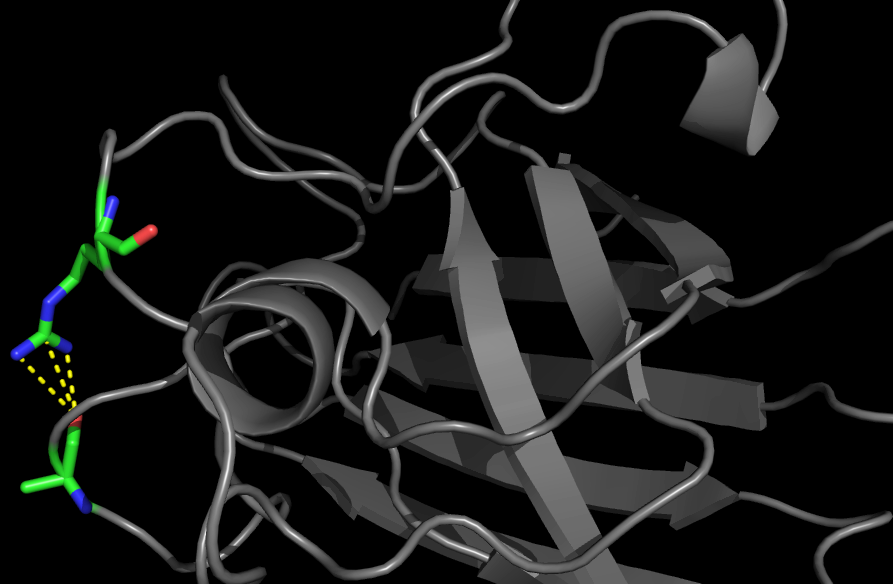
Была найдена водородная связь между боковыми радикалами Arg69 и Glu77 (Рис.3)
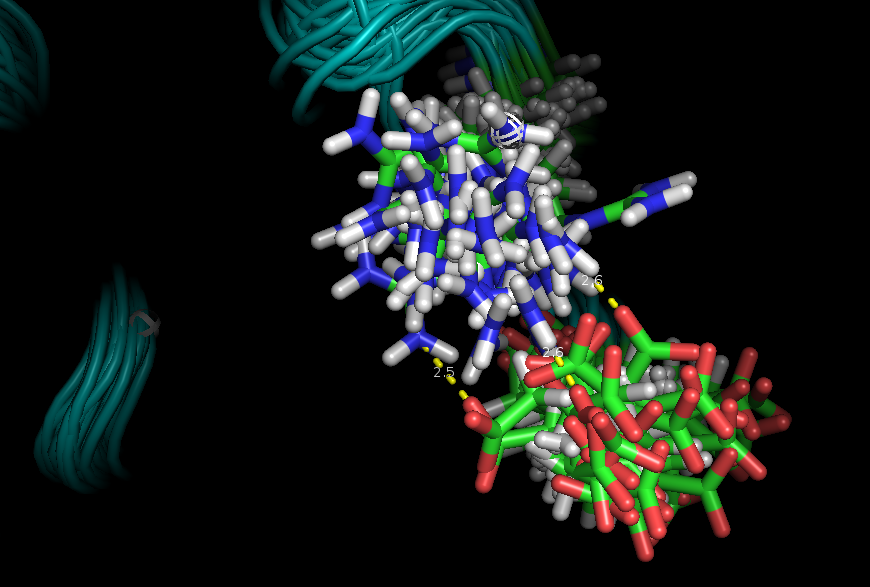
Эта же водородная связь была рассмотренна в модели 1MFM. Интересно, что в PDB-файле отсутствует один атом кислорода, то есть нет никакого OE1 и OE2, а С2 атомом заканчивается боковая цепь. Не очень понятно почему так произошло (?). (Рис.4)
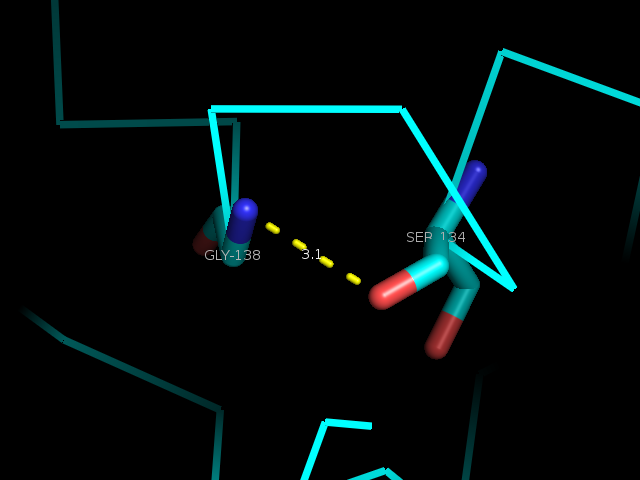
Так же была рассмотрена водородная связь, участвующая в образовании альфа-спирали: между NH-группой Gly138 и O-атомом Ser134 (Рис. 5).
 |
| Рис. 6. Остовная водородная связь в альфа-спирали: NH-Gly138::O-Ser134 |
Эта связь также присутствует и в структуре, полученной с помощью РСА (Рис. 6).
 |
| Рис. 6. Остовная водородная связь в альфа-спирали: NH-Gly138::O-Ser134 |
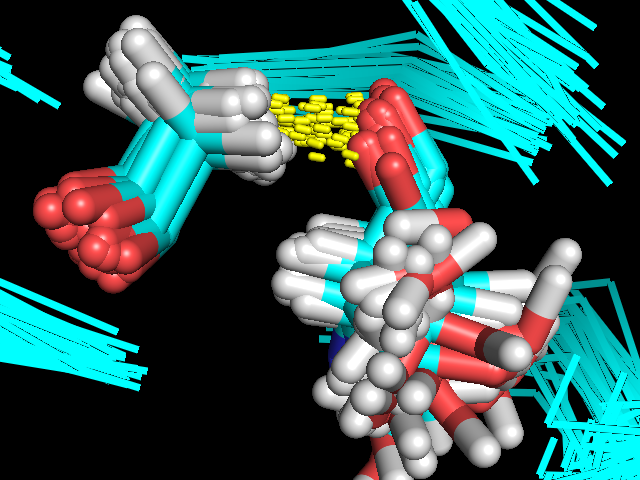
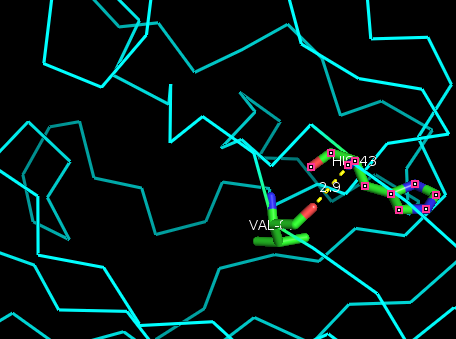
В качестве водородной связи внутри глобулы белка была выбрана водородная связь между двуми beta-тяжами, сформированная взаимодействием NH-группы His43 и O-атома Val87 (Рис.7; Рис.8).
 |
| Рис. 7. Водородная связь в глобуле белка: NH-His43::O-Val87 |
 |
| Рис. 8. Водородная связь в глобуле белка: NH-His43::O-Val87 |
| Где расположена водородная связь | Донор и акцептор электронов | Расстояние в РСА, Å | Число моделей ЯМР, в которых есть связь | Минимальное расстояние в ЯМР, Å | Максимальное расстояние в ЯМР, Å | Медианное расстояние в ЯМР, Å |
| На поверхности глобулы | NH2-Arg69 и OE2-Glu77 | ? | 3/36 | 2.5 | 2.6 | 2.6 |
| Остовная водородная связь в альфа-спирали | NH-Gly138 и O-Ser134 | 3.1 | 26/36 | 2.6 | 3.2 | 2.7 |
| Водородная связь в глобуле белка между двумя бета-тяжами | NH-His43 и O-Val87 | 2.9 | 25/36 | 2.8 | 3.4 | 2.8 |
По проделанной работе можно сделать вывод, что больше всего варьирует длина водородной связи во вторичной структуре белка (имеется ввиду значение длины водородной связи у различных моделей, полученных методом ЯМР). В бета-листе белка, напротив, значение длины водородной связи практически неразличимо между моделями. Также, было отмечено, что в среднем длина водородной связи, полученной методом РСА чуть больше длины этой же связи, полученной методом ЯМР. Что касается вторичной структуры и таких различных значений длины одной и той же водородной связи, видимо, это связано с тем, что ЯМР проводят в растворе и вторичные структуры, такие как петли, недостаточно жестко закреплены.