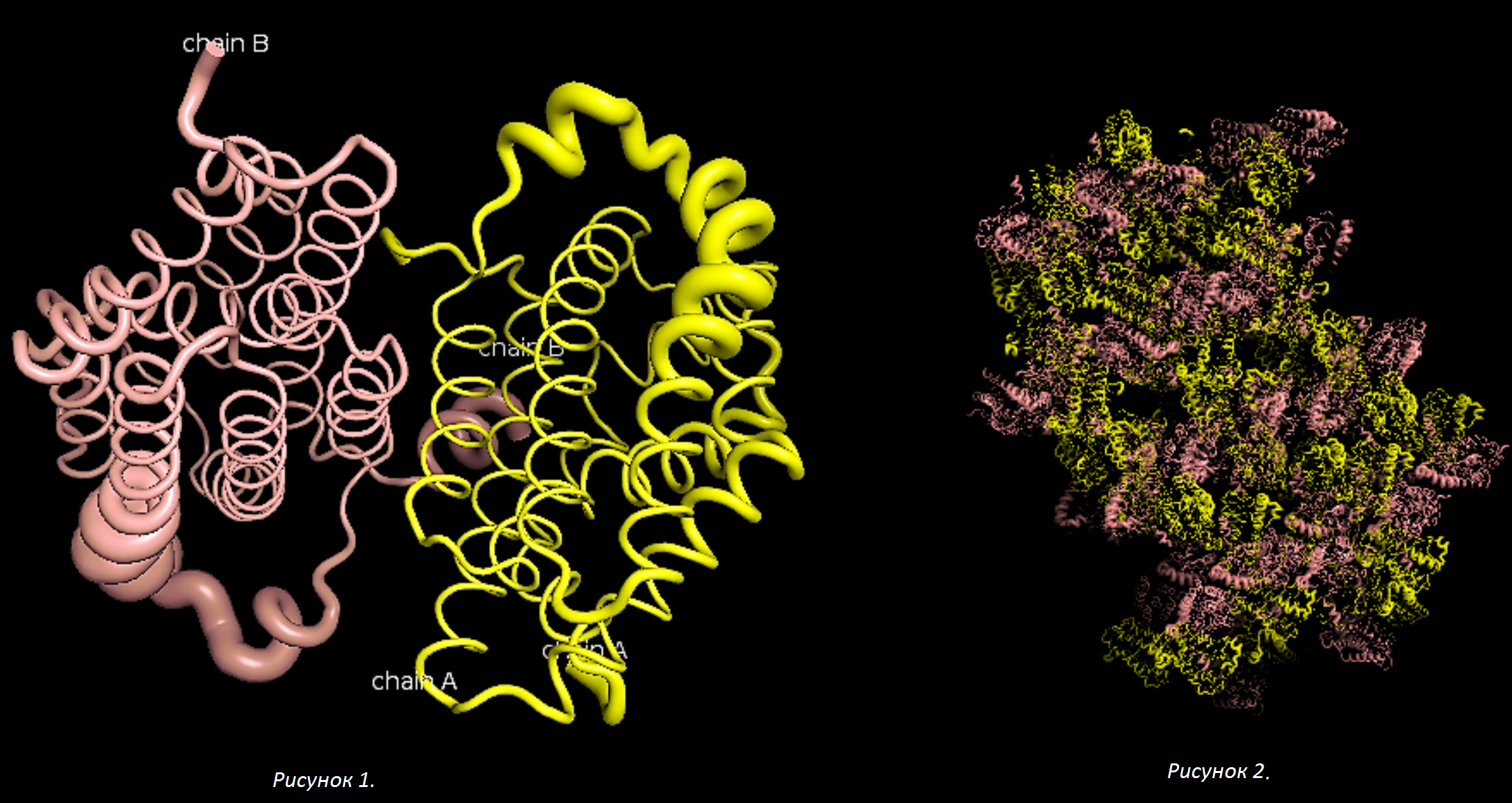
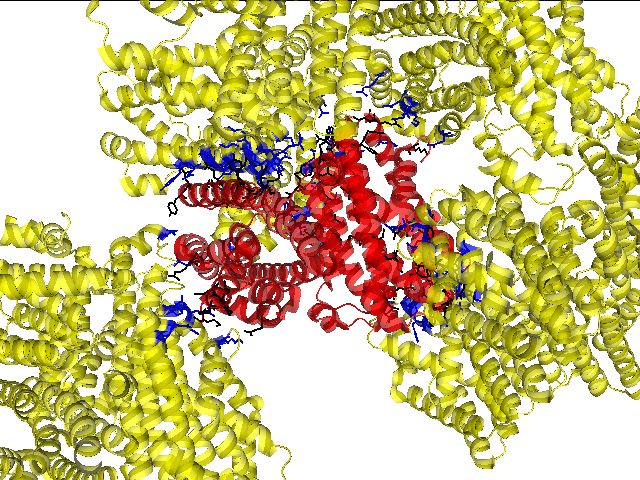
Рисунок 1. Ассиметрическая единица белка 2qcx, представленная гомодимером. Рисунок 2. Молекулы соседних ячеек белка 2qcx.
Модель 2QCX описывает структуру белка тиаминазы 2 Bacillus subtilis. Асимметрическая единица состоит из цепей A и B белка; активная форма белка представляет собой гомодимер. Изображения структуры белка и соседних ячеек кристалла представлены ниже.
Оттенки желтого и светло-фиолетового цветов обозначают цепи A и B белка, соответственно.
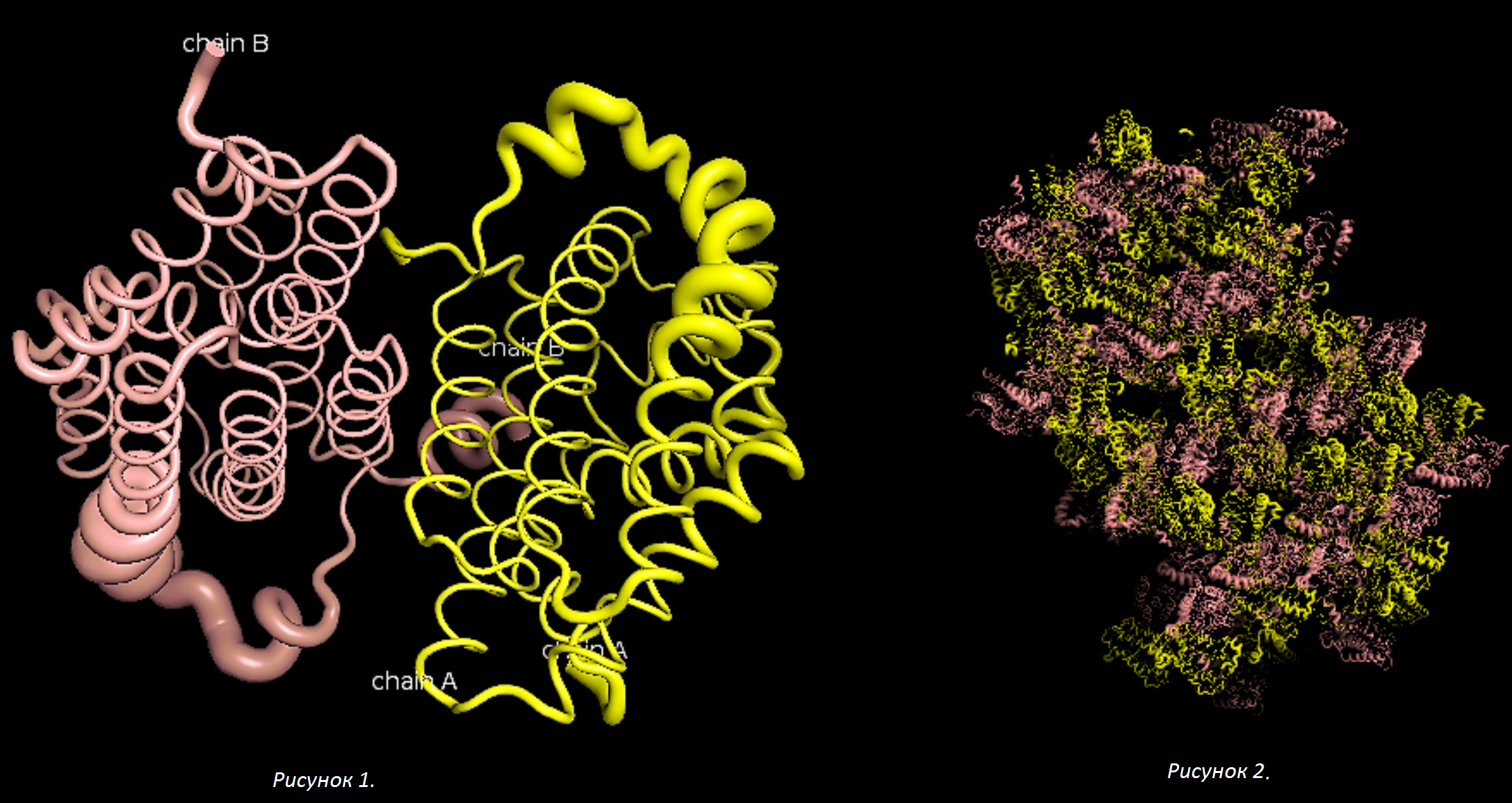
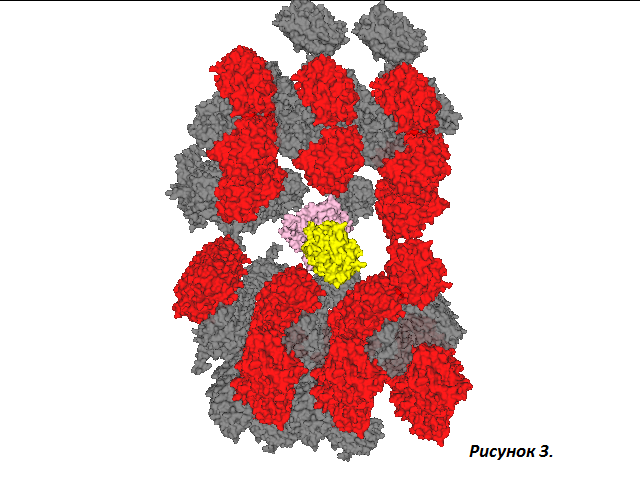
При визуализации молекул соседних ячеек кристалла также было решено скрыть белки на расстоянии 30 Å от исходной молекулы в целях большей наглядности изображения. (рисунок 3). Молекулы соседних ячеек белка представлены в красно-серой окраске, соответствующей цепям А и B.
В поле CRYST1 записи PDB указаны кристаллографические характеристики. Для модели 2QCX эта строка имеет следующий вид:
CRYST1 58.625 58.625 296.469 90.00 90.00 90.00 P 41 21 2 16
Первые три числа - значения длин направляющих векторов кристалла, следующие три - углы между направляющими векторами. Число молекул в ячейке равно 16. Название кристаллической группы P 41 21 2 означает, что она относится к тригональным группам. Эта группа ацентрическая, хиральная, енантиоморфная, и параллелограм, содержащий ассиметрическую ячейку: 0<=x<1/2; 0<=y<=1/2; 0<=z<=1/4. Для этой группы характерны следующие операции симметрии:
symmetry= X,Y,Z symmetry= -X,-Y,Z+1/2 symmetry= -Y+1/2,X+1/2,Z+1/4 symmetry= Y+1/2,-X+1/2,Z+3/4 symmetry= -X+1/2,Y+1/2,-Z+1/4 symmetry= X+1/2,-Y+1/2,-Z+3/4 symmetry= Y,X,-Z symmetry= -Y,-X,-Z+1/2
Были прослежены водородные связи и полярные взаимодействия между белками соседних ячеек. Как можно видеть на изображениях ниже, молекула белка в кристалле имеет множество контактов с соседствующими молекулами.
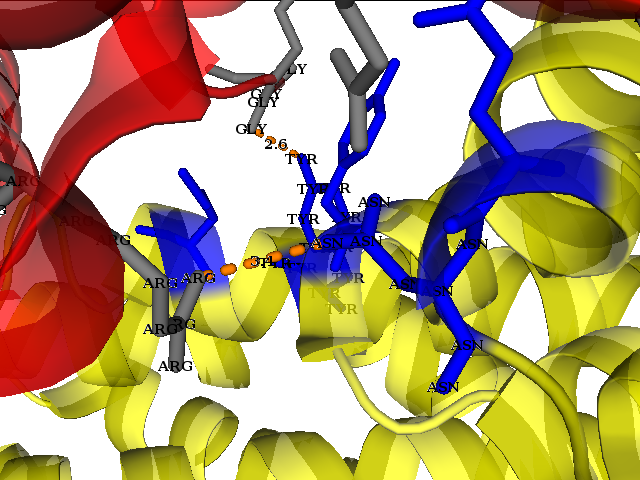
Следует отметить, что при рассмотрении взаимодействий ярко проявляется симметрия структуры (TYR---LEU; LEU---TYR).В этом можно убедиться взглянув на изображение ниже.
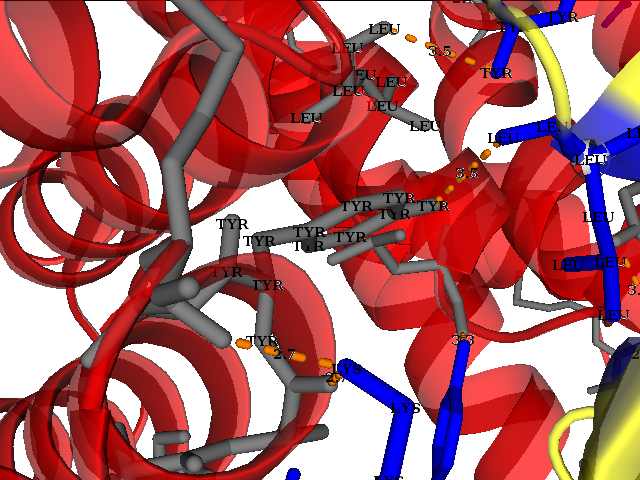
Необходимо также уделить внимание гидрофобным взаимодействиям. Были получены изображения, демонстрирующие наличие гидрофобных взаимодействий между соседствующими молекулами белка в кристалле (гидрофобные аминокислоты в структуре отмечены оранжевым, сам 2qcx - серым, соседи - красным цветом, соответственно). На их основании можно сделать предположение, что гидрофобные взаимодействия играют важную роль для поддержания структуры.
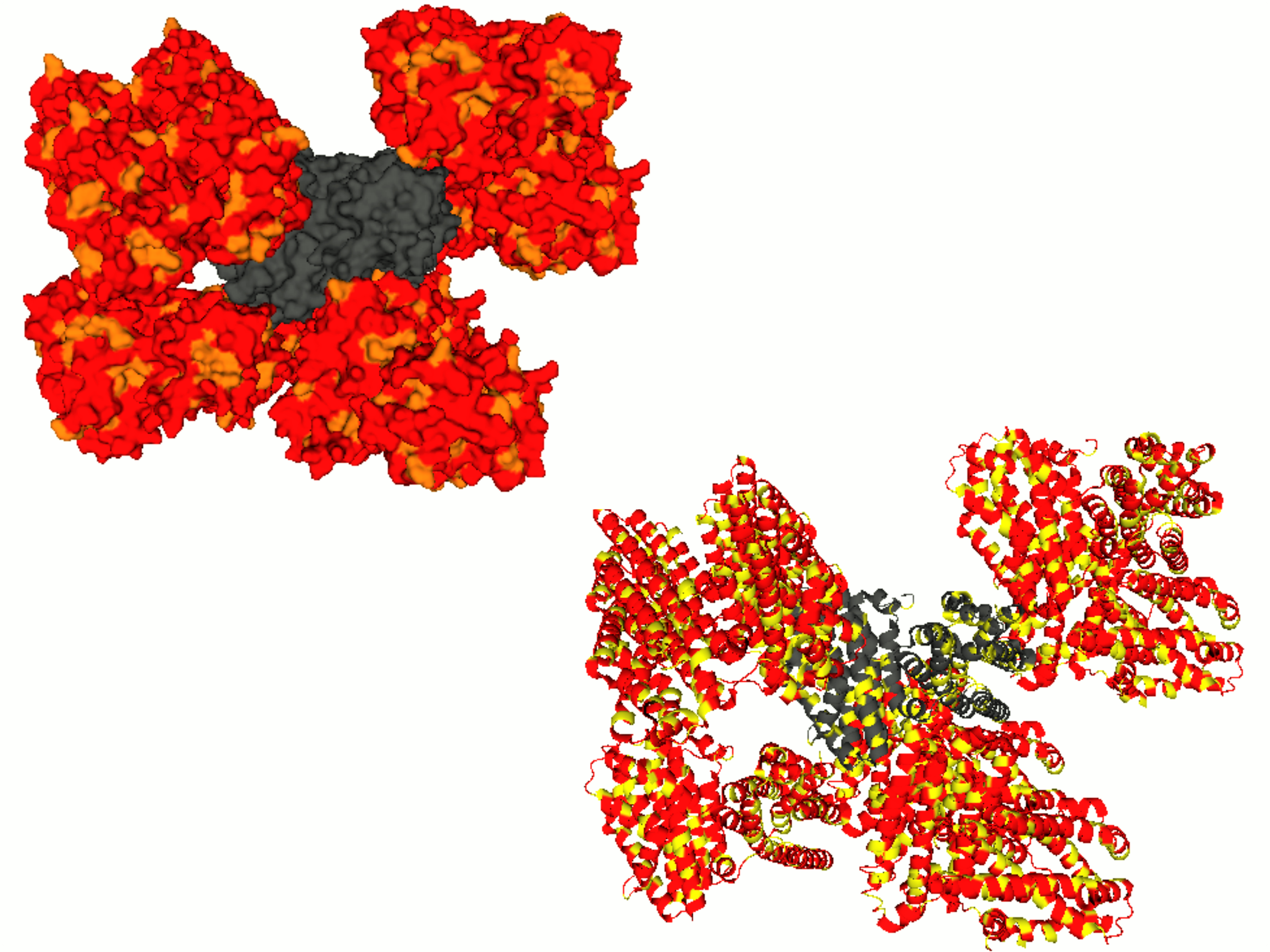
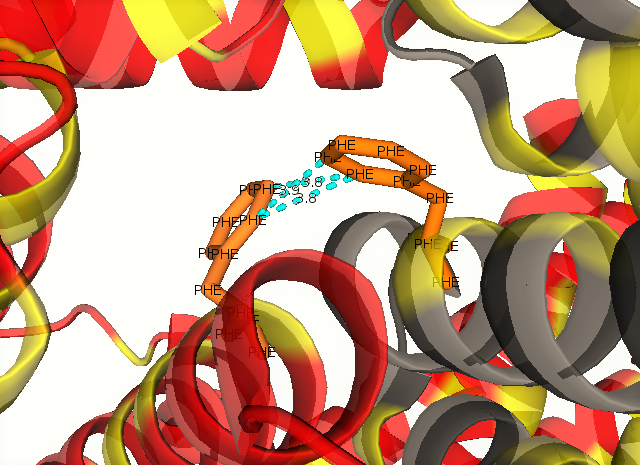
Анализ взаимодействий белка с соседствующими в кристалле молекулами позволяет получить более полное представление о структуре. Рассмотрение и визуализация этих контактов для структуры 2QCX позволили продемонстрировать свойство симметрии в кристалле, а также получить представление о взаимодействии (о водородных связях, гидрофобных контактах) молекул соседних ячеек.
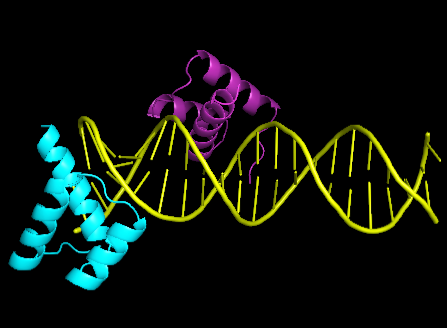
Модель 3HDD представляет структуру комплекса гомеодомена engrailed Drosophila melanogaster и ДНК с разрешением 2.20 Å. Было построено изображение структуры, на котором белковые цепи A и B отмечены фиолетовым и голубым цветами, соответственно, а ДНК – желтым.
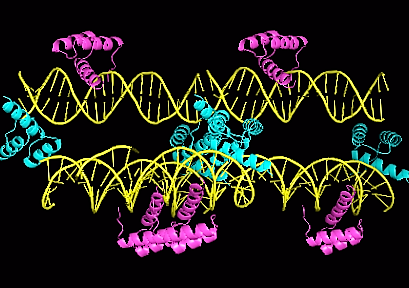
Для построения соседних асимметрических единиц в PyMol применялась команда symexp. Эта команда позволяет получить изображение молекулы ДНК из соседней ячейки, которая контактирует с цепью B белка. На изображении ниже можно увидеть контакты комплекса с соседними молекулами.
При более детальном рассмотрении мы видим изображение молекулы ДНК из соседней ячейки, которая контактирует с цепью B белка.
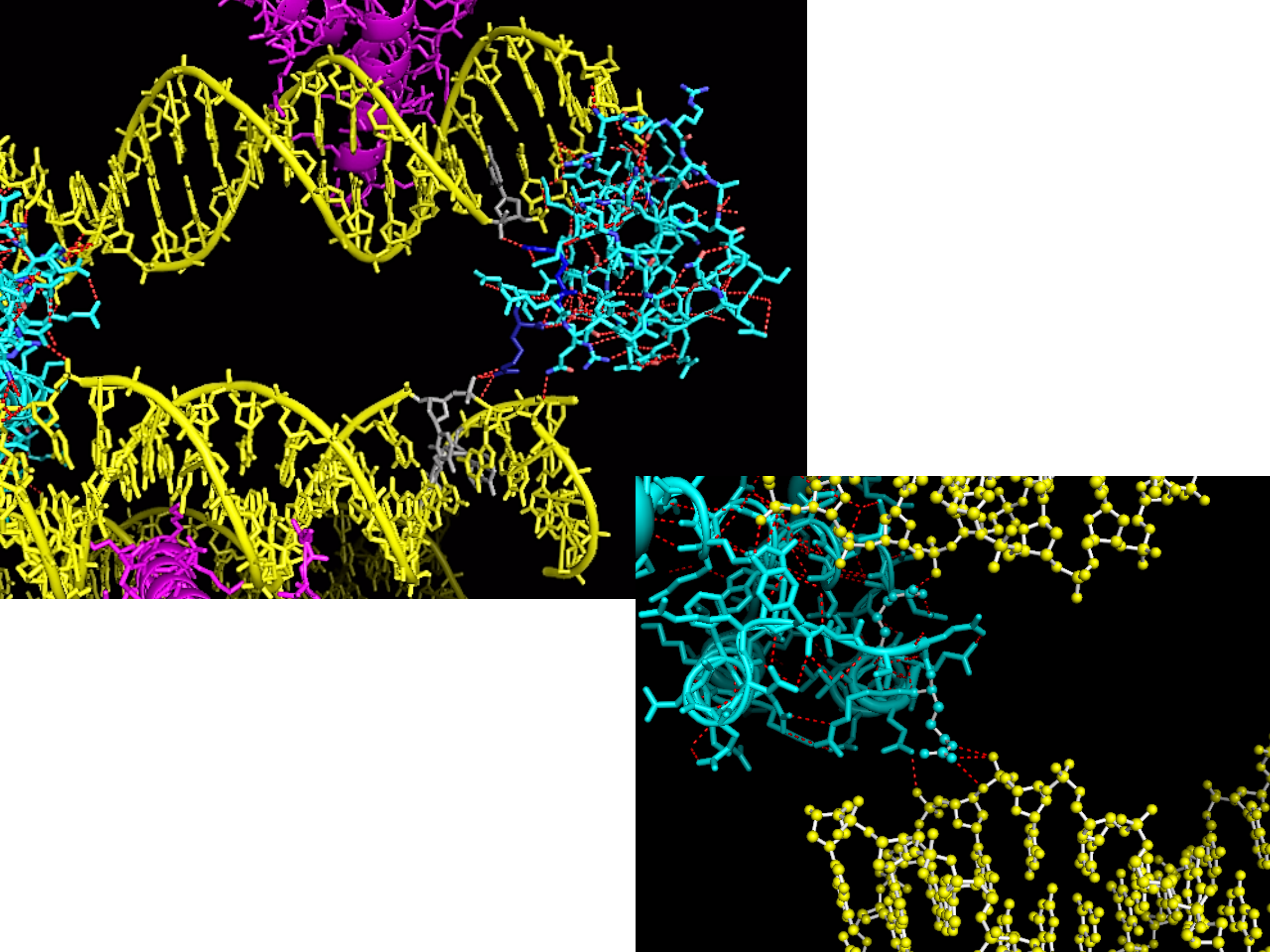
Также было интересно посмотреть на контакты цепи B c цепью B соседних ячеек (это, конечно, не странность, а просто интерес). Изображение контактов приведено на рисунке 4.