Практикум №1
Задание №1: Визуализатор PyMOL. Взаимодействия.
Краткая биологическая характеристика объекта.
В рамках данного практикума я буду изучать структуру взаимодействия одного из наименее известных типов ионотропных глутаматных рецепторов - каинатных рецепторов, - с одним из ненативных специфических агонистов, называемым каиновой кислотой.
Каиновая кислота, являясь нейротоксином, нередко используется в нейронаучных экспериментах в качестве стимулятора ЦНС, вызывающего судорожные приступы у экспериментальных животных, тем самым являясь необходимым компонентом для моделирования нейродегенеративных процессов, таких как эпилепсия или болезнь Альцгеймера.
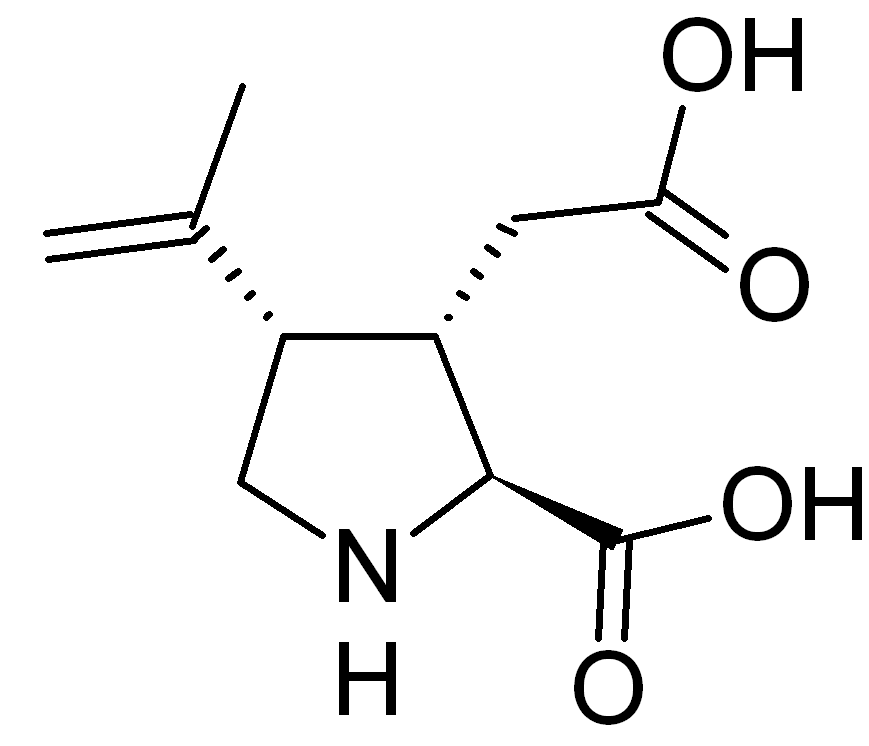
Структурно каиновая кислота (Рис. 1) является непротеиногенной гетероциклической иминокислотой, схожей с пролином и глутаматом.
Каиновые рецепторы состоят из четырёх субъединиц, каждая из которых способна связывать лиганд. Изучаемая мной структура (PDB ID: 1TT1) представляет собой кристаллическую структуру субъединицы GLUR6 в комплексе с каинатом, полученную с помощью метода рентгеноструктурного анализа с максимальным разрешением 1.93 Å.
Описание взаимодействий лиганда с белком.
В рамках данного раздела я попробую наглядно продемонстрировать сайт связывания лиганда с рецептором, указав конкретные аминокислотные остатки, участвующие в взаимодействии с лигандом, и соответствующие связи, стабилизирующие комплекс.
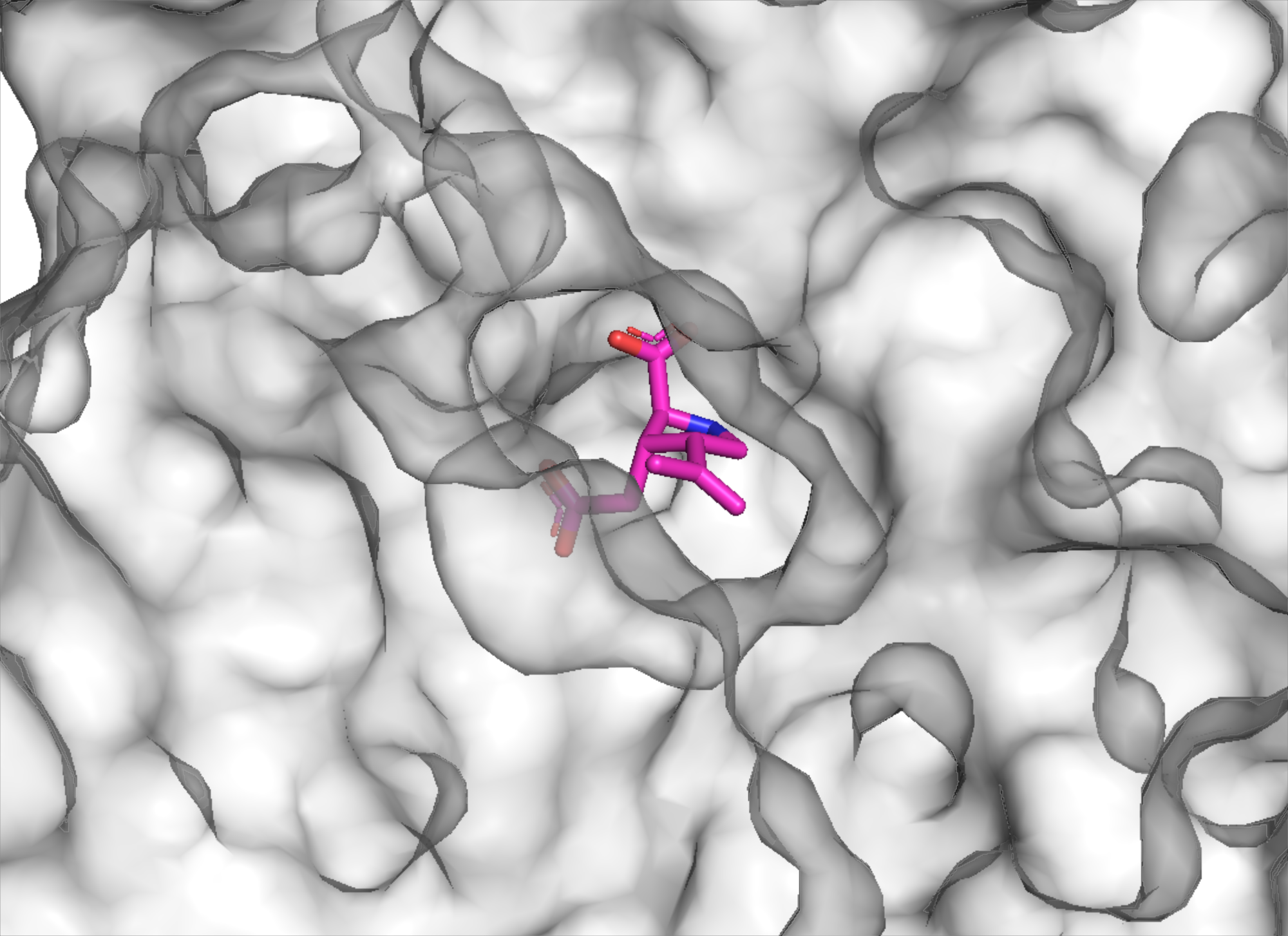
Но прежде посмотрим на поверхность белка и карман связывания каината рецептором (Рис. 2). Видно, что в данном случае карман достаточно "глубоко" находится в белке, указывая на прочность связывания нейротоксина с каинатным рецептором.
Теперь рассмотрим сайт связывания с указанием всех найденных мною взаимодействий лиганда с белком (Рис. 3).
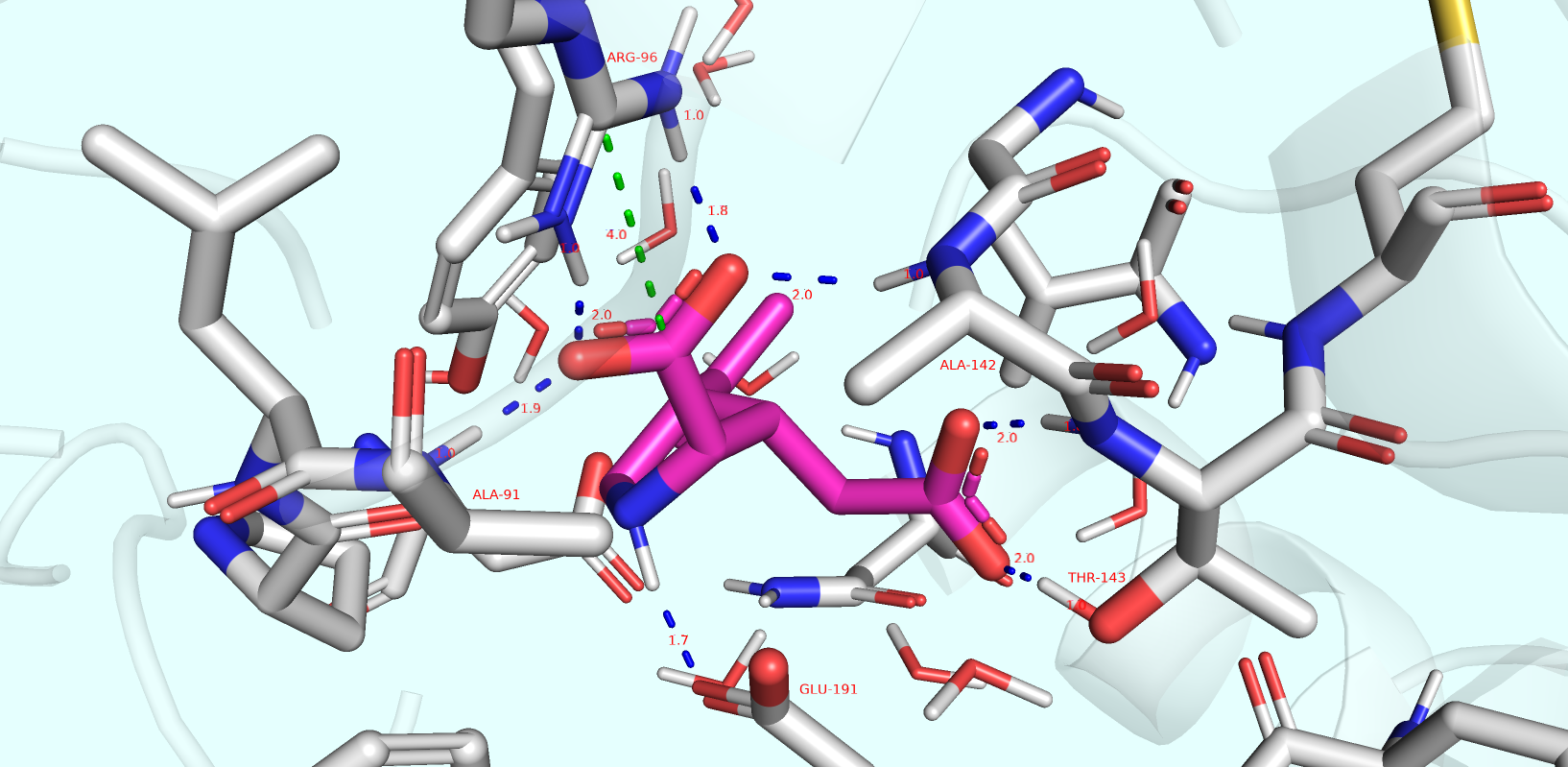
(На изображение можно нажать для того, чтобы разглядеть детали).
Составим для удобства таблицу, отражающую характеристики всех идентифицированных взаимодействий (Таблица 1).
Тип взаимодействия.
Атомы, участвующие во взаимодействии
Аминокислотные остатки белка, участвующие во взаимодействии
Длина соответствующей связи (Å)
Водородная связь.
O (акцептор),
N (донор), H.ARG-96.
2.0 (акцептор - H),
1.1 (H - донор).
Водородная связь.
O (акцептор),
N (донор), H.ARG-96.
1.8 (акцептор - H),
1.0 (H - донор).
Водородная связь.
O (акцептор),
N (донор), H.ALA-142.
2.0 (акцептор - H),
1.0 (H - донор).
Водородная связь.
O (акцептор),
N (донор), H.ALA-91.
1.9 (акцептор - H),
1.0 (H - донор).
Водородная связь.
O (акцептор),
N (донор), H.GLU-191.
1.7 (акцептор - H),
1.0 (H - донор).
Водородная связь.
O (акцептор),
N (донор), H.THR-143.
2.0 (акцептор - H),
1.0 (H - донор).
Водородная связь.
O (акцептор),
O (донор), H.THR-143.
2.0 (акцептор - H),
1.0 (H - донор).
Солевой мастик.
N (ARG-96),
С (Lig.).ARG-96.
4.0.
Максимальная длина водородной связи составила 3.1 Å. Длина найденного солевого мостика составила 4.0 Å.
Ссылка на сессию pymol: 1tt1_site.pse
Задание №2: Визуализация электронной плотности лиганда и окружающих его остатков.
Скачав карту электронную плотность (ЭП) изучаемой структуры и визуализировав в виде mesh часть, по которой были воссозданы координаты атомов лиганда и окружающих его остатков (в окрестности 6 Å) с параметром подрезки, равным 1 сигме (std normal distribution), и carve, равным 2 Å (как для лиганда, так и для окружения), я получил следующее изображение:
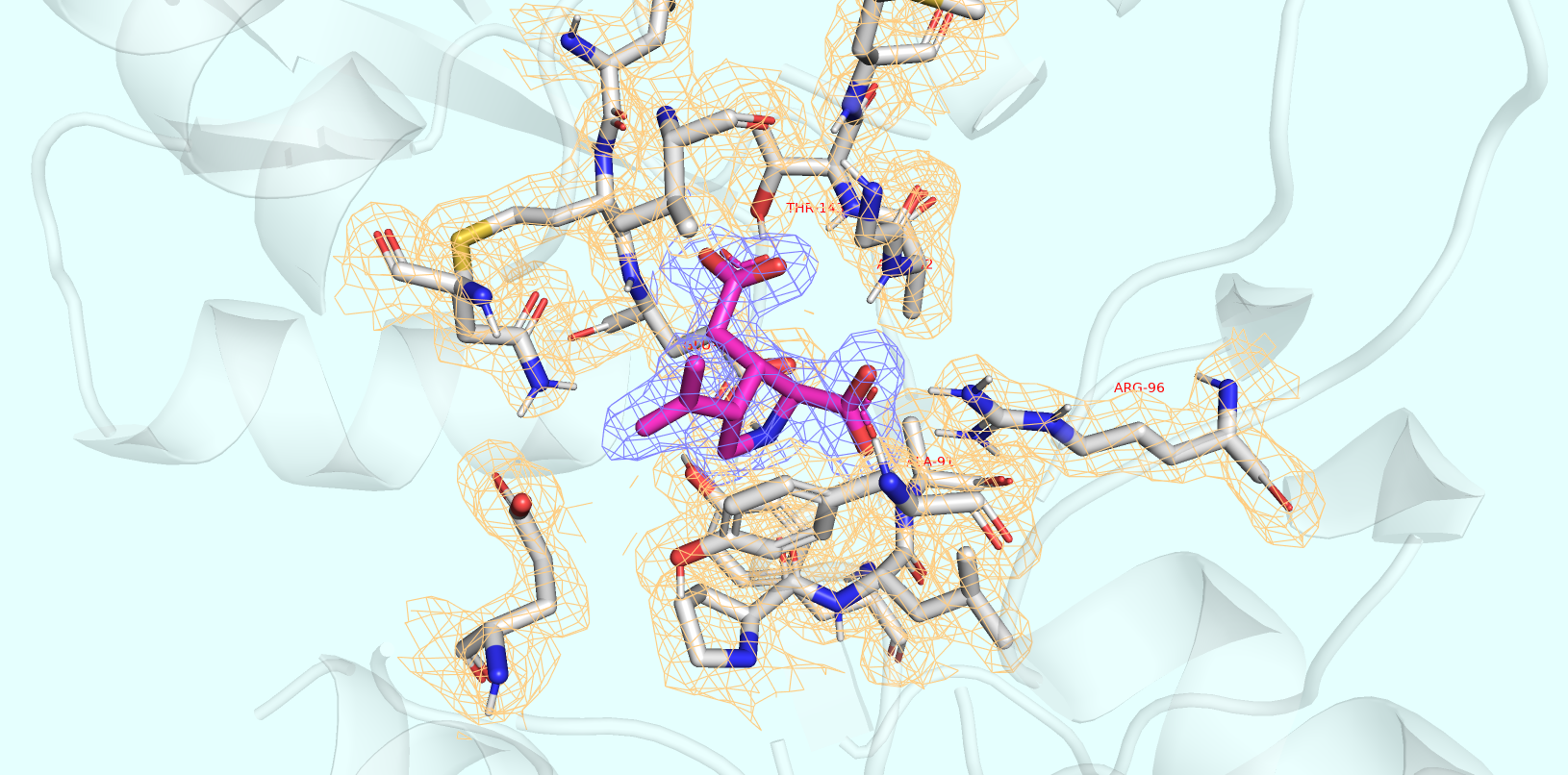
Параметры: подрезка (σ) = 1, carve = 2.
Видно, что все компоненты сайта связывания хорошо покрыты электронной плотностью.
Таким образом, можно сделать вывод, что и лиганд, и окружающие его остатки хорошо покрыты ЭП =).
Ссылка на сессию pymol: 1tt1_EP.pse
Кирилл Кузенков, студент четвёртого курса ФББ