Практикум №3
Задание №1: Альтернативные положения.
В рамках данного практикума мне предстоит работать со структурой (PDB1: 6HOI) мотива LIR белка Beclin1, одного из ключевых участников комплекса, индуцирующего аутофагию [1].
В рамках первого задания (вариант В) необходимо было рассмотреть два альт-лока ARG-14 (A и B), рассмотреть контакты, стабилизирующие их положения, и, сделав предположения о населённости той или иной конформации, свериться с реальными населённостями из соответствующего файла PDB.
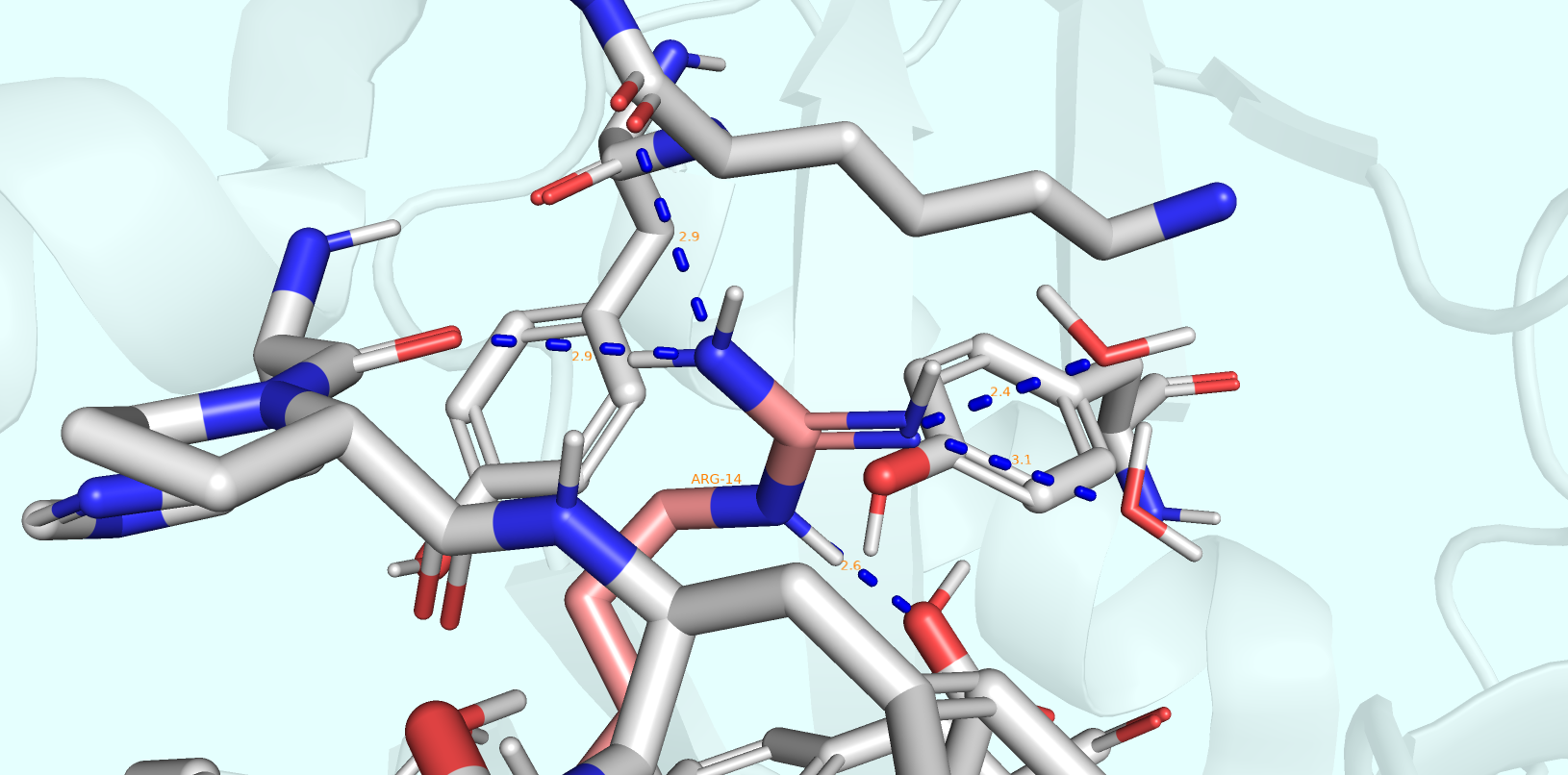
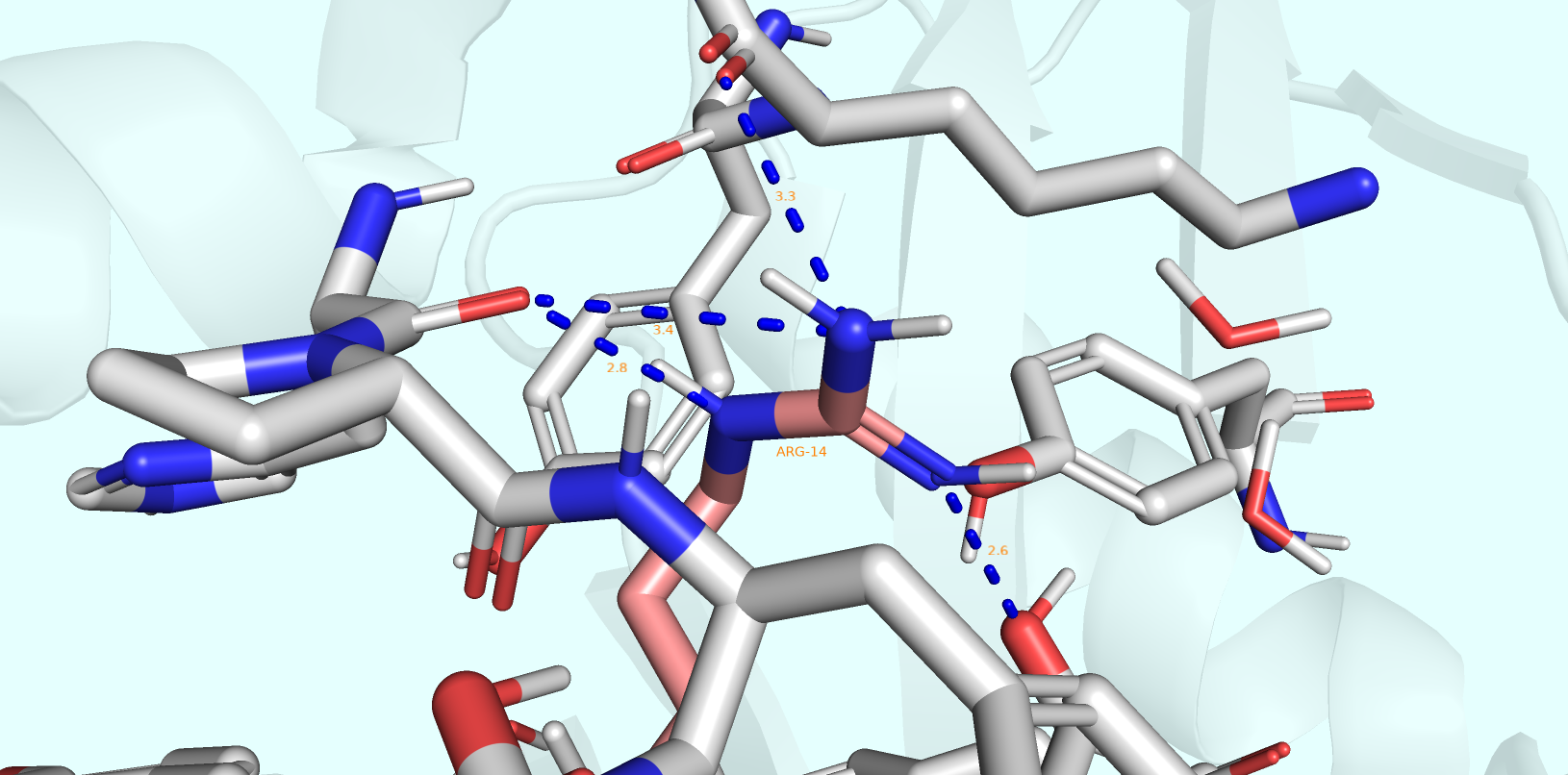
Были получены изображения двух конформаций: A (Рис. 1) и B (Рис. 2) - в совокупности с окружающими их остатками, вступающими в те или иные формы взаимодействий.
Я нашёл лишь несколько водородных связей, в которых принимают участие данные аргинины. Потенциальные ионные взаимодействия мне показались сомнительными.
На изображениях можно заметить, что в альт-локе B аргинин принимает участие в меньшем количестве водородных связей, каждая из которых к тому же ослабляется увеличением соответствующего ей расстояния. Тем не менее мне не кажется это различие разительным. По-видимому, населённости соответствующих конформаций должны быть сходными.
Обратившись к PDB-файлу, я обнаружил, что населённости альт-локов A и B равны соответственно 0.59 и 0.41, что согласовано с моими догадками.
Ссылка на сессию pymol: 3pr_1.pse.
Задание №2: B-фактор.
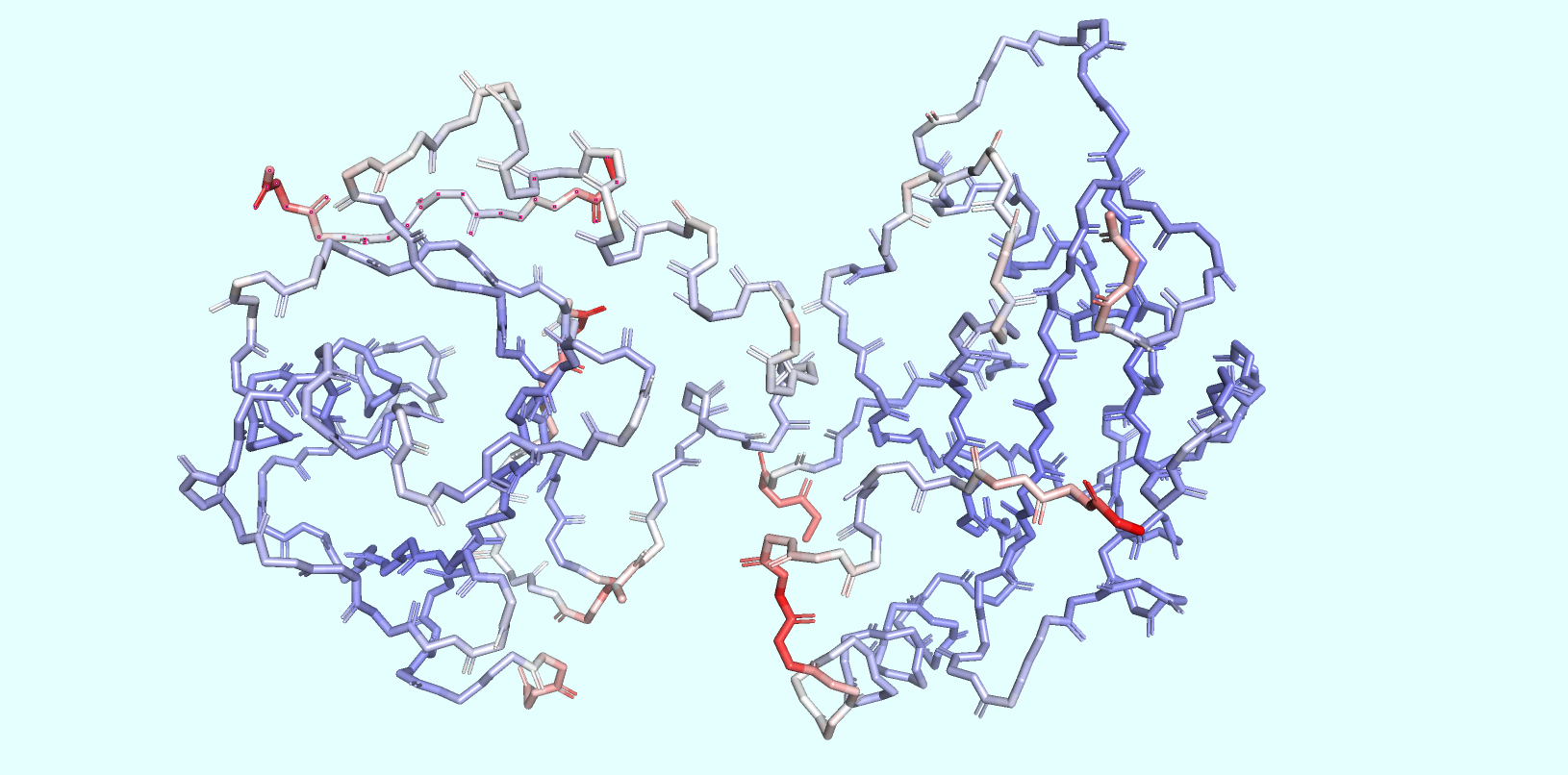
В рамках данного задания необходимо было покрасить все атомы белкового остова выбранной структуры (6HOI) по B-фактору (температурный фактор). При этом атомы с низким B-фактором будут окрашены в синий, средним - в белый, высоким - в красный. Было получено изображение (Рис.3), согласно которому можно предположить (и подтвердить свои догадки, обратившись к соответствующим источникам информации...), что B-фактор - есть относительное колебательное движение тех или иных частей структуры.
В частности, атомы с низким B-факторов являются устойчивыми и находятся в наиболее ограниченном количестве положений в пространстве, в то время как высокотемпературные (с высоким B-фактором) красные атомы принадлежат к наиболее гибким частям структуры, положение которых наименее детерменировано в рамках рассматриваемой структуры.
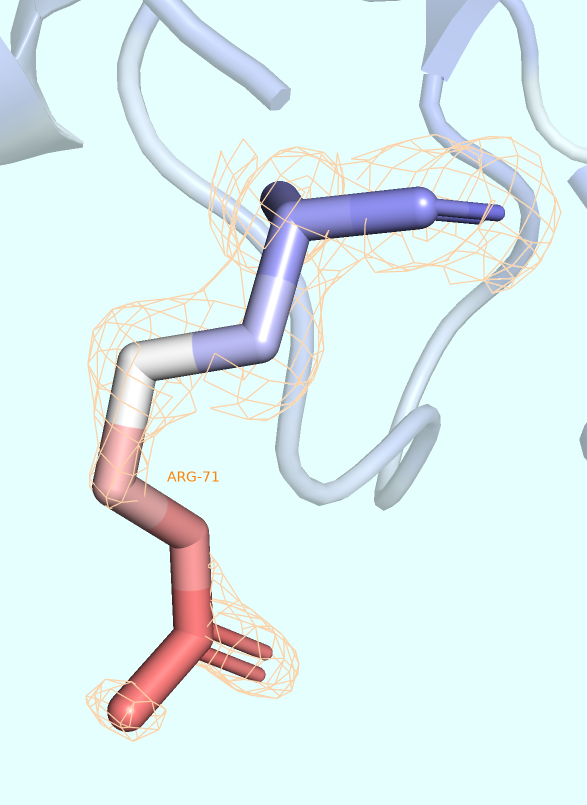
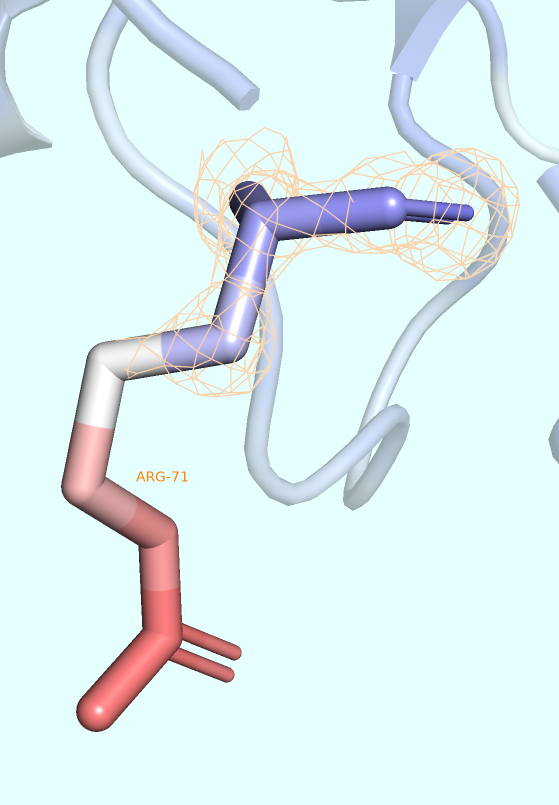
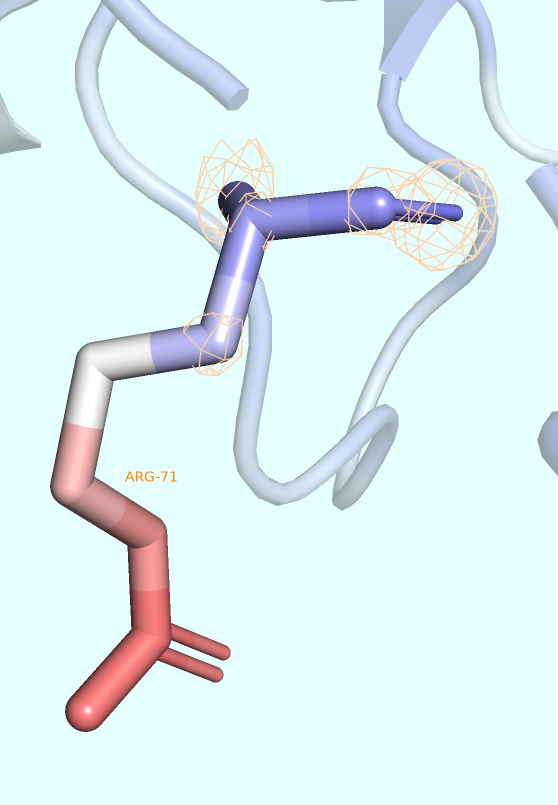
Для более локального рассмотрения понятия B-факторы выберем остаток, атомы которого наиболее ранжируются относительно значений соответствующих им B-факторов (например, остаток, атомы которого заметно краснеют к его окончанию, символизируя постепенное повышение B-фактора), и визуализируем в виде mesh ЭП этого остатка для того, чтобы более точно оценить степень точности предсказания его положения (которая, как мы знаем, определённо ниже у тех частей структуры, которые являются наиболее подвижными подвижными).
В качестве такого остатка был выбран ARG-71. Была получена серия изображений (Рис. 4), варьирующих касательно выбора подрезки ЭП (использовались, как обычно, уровни 1, 2 и 3 σ). Во всех случаях параметр carve был равен 1 Å.
На изображении видно, что уже при уровне подрезки, равным 1 (то есть при визуализации около 32% наиболее плотных облаков), некоторые атомы бокового радикала выбранного аргинина не покрываются электронной плотностью совсем. Именно эти атомы и имеют наибольшие значения B-фактора в остатке (хоть и некоторые из наиболее красных атомов всё равно покрываются ЭП).
Таким образом, можно сделать вывод, что боковая цепь данного аргинина обладает наименьшей ригидностью и претерпевает большое количество различного рода движений, что и выражается в плохом качестве покрытия её ЭП.
Ссылка на сессию PyMol: 3pr_2.pse.
Задание №3: Соседи.
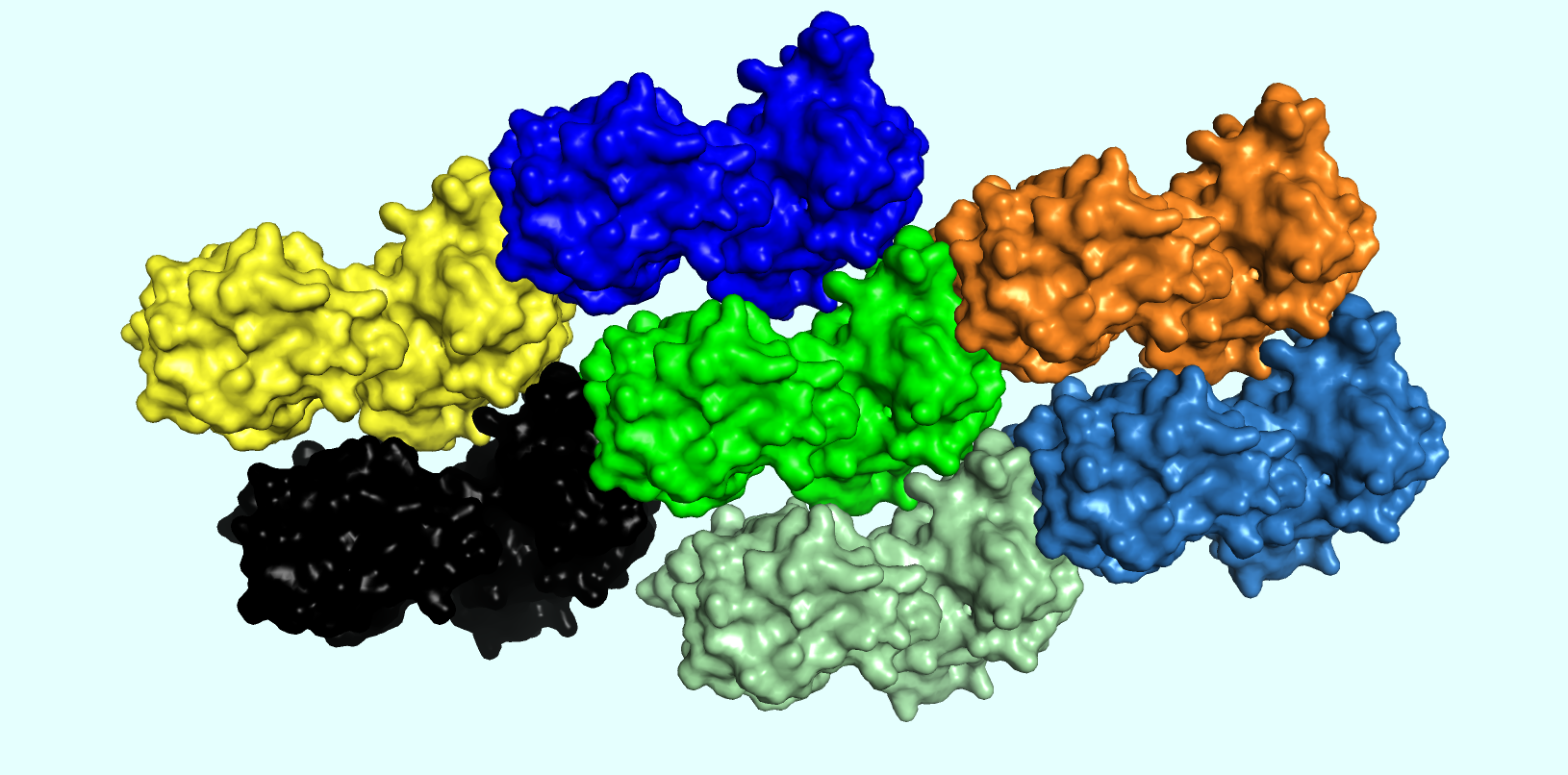
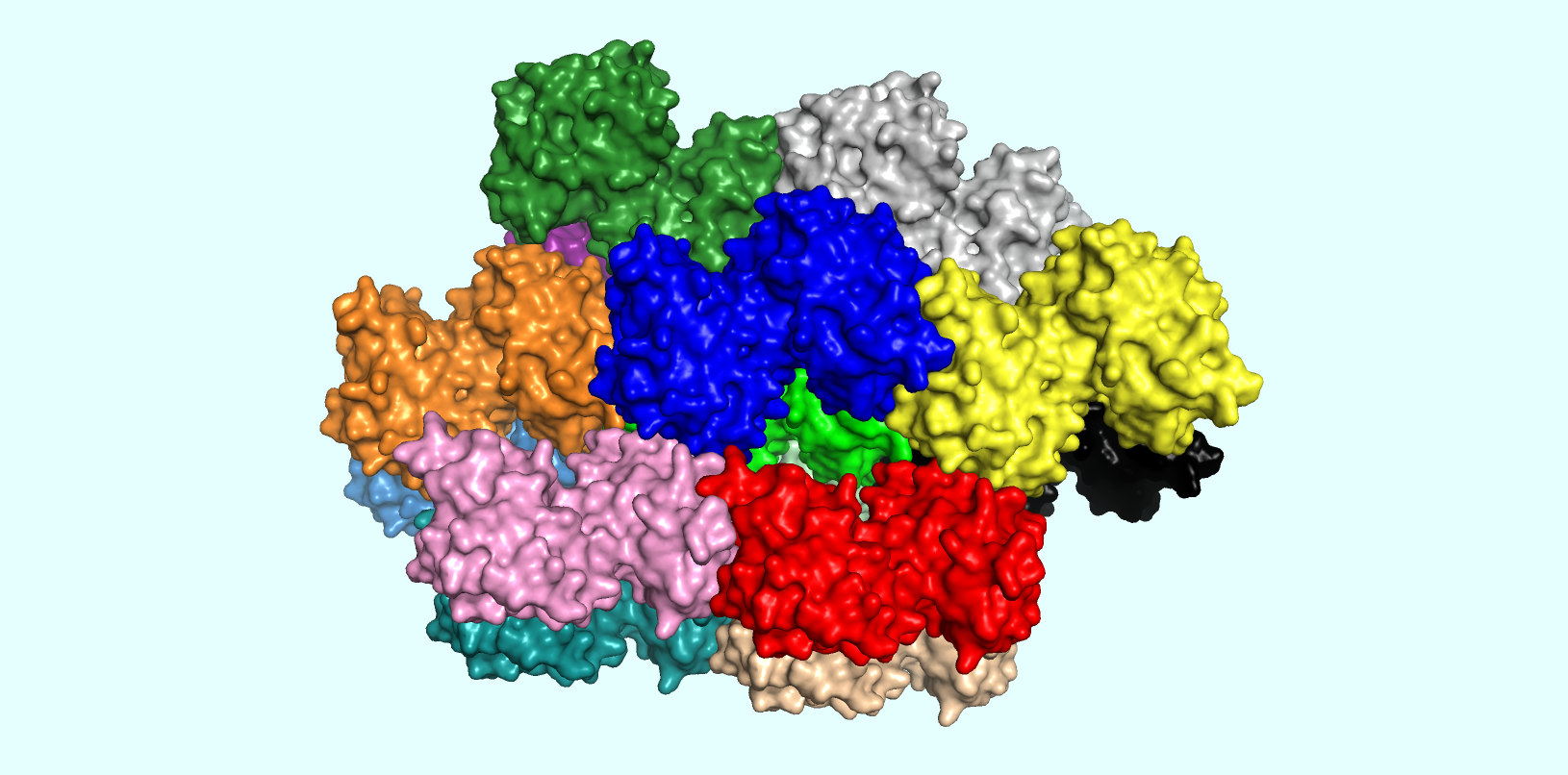
В рамках последнего задания я рассматривал кристаллическую структуру выданного белка. При этом я отобразил всех соседей белка в кристаллической ячейке с отсечкой по расстоянию, равной 5 Å. При этом было сделано изображение, демонстрирующее "кристалличность" структуры =) (Рис. 5). Посчитано было, что у данного белка около 14 соседей в кристаллической ячейке. Каждый из соседей получил свой уникальный цвет (кстати говоря, подбирать 14 достаточно различающихся между собой цветов - не самая лёгкая для меня задача). Все молекулы были представлены в виде surface.
Ссылка на сессию PyMol: 3pr_3.pse.
Кирилл Кузенков, студент четвёртого курса ФББ