Практикум №6
Задание №1: Идентификация водородных связей.
В этом практикуме я буду работать с двумя структурами: 7K6B (ЯМР) и 4IQH (РСА), - принадлежащими одному из семи (в частности, выданная мне структура представляет из себя структуру домена C2A) цитоплазматических доменов (C2A-G: каждый из них предположительно ответственен за специфическую роль [1]) белка дисферлина, дефекты в гене которого приводят к нескольким типам мышечных дистрофий [2].
Домен C2A представляет из себя классический β-сэндвич, состоящий из 8 β-тяжей.
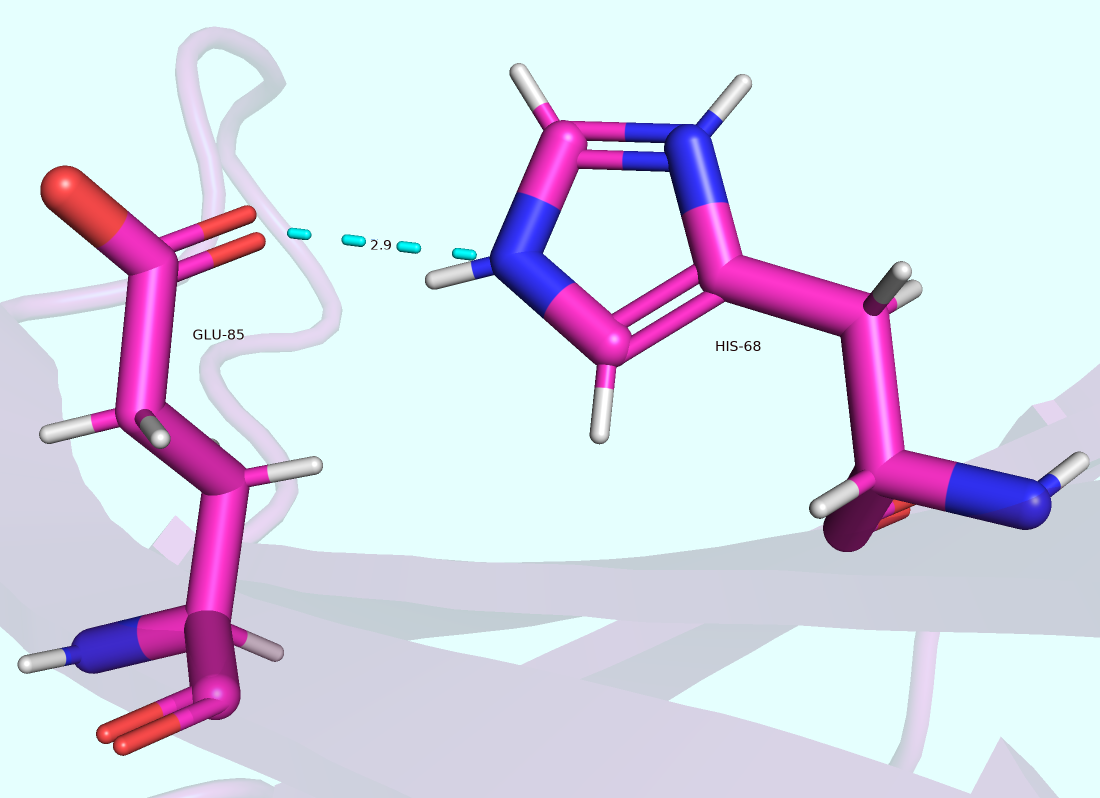
Поскольку в ассиметрической ячейке структуры 4IQH (РСА) содержалось три цепи, была выбрана одна из них (A), в рамках которой были идентифицированы три водородные связи (Рис. 1):
1) Водородная связь между остовами β-тяжей (Leu-121 и Phe-103: акцептор и донор соответственно).
2) Водородная связь в рамках боковых цепей аминокислотных остатков, входящих в β-тяж (Glu-85 и His-68: акцептор и донор сответственно).
3) Водородная связь в петлях, выходящих на поверхность глобулы (Asp-62 и Gly-64: акцептор и донор соответственно) [Ранее была найдена другая пара, но её пришлось заменить, поскольку один из соответствующих остатков отсутствовал в ЯМР-структуре, являясь первым остатком на N-конце].
Эта же информация продублирована в таблице в более удобном виде (Таблица 1):
Номер водородной связи.
Атомы, участвующие во взаимодействии.
Аминокислотные остатки белка, участвующие во взаимодействии.
Длина соответствующей связи (Å).
Локализация.
1)
O (акцептор),
N (донор), H.LEU-121 (акцептор) и PHE-103 (донор).
2.92
Внутри глобулы.
2)
O (акцептор),
N (донор), H.GLU-85 (акцептор) и HIS-68 (донор).
2.85
Скорее на поверхности (поскольку домен представляет из себя β-сэндвич).
3)
O (акцептор),
N (донор), H.ASP-64 (акцептор) и GLY-62 (донор).
2.92
На поверхности.
Далее была получена таблица расстояний, данные которой представляют из себя результат работы кода (Таблица 2):
Аминокислотные остатки белка, участвующие во взаимодействии.
Расстояние РСА (Å).
Количество и процент ЯМР-моделей, содержащих данную связь.
Расстояние ЯМР (Å).
Минимальная
Максимальная
Медианная
LEU-121 (акцептор) и PHE-103 (донор).
2.92
20 (100%)
2.65
2.80
2.73
GLU-85 (акцептор) и HIS-68 (донор).
2.85
2 (10%)
2.69
12.77
7.58
ASP-64 (акцептор) и GLY-62 (донор).
2.92
10 (50%)
2.70
6.23
4.36
Таким образом, мы видим, что остатки, располагающиеся ближе к поверхности белка, поддерживаются в среднем меньшим количеством моделей ЯМР, чем центральные остатки.
Поскольку выданная структура не является достаточно большой и представляет из себя β-сэндвич, не удалось найти пары остатков в глобуле, которые бы образовывали водородную связь боковыми цепями (все находящиеся строго в "глобуле" остатки образуют водородные связи только остовом). Из-за этого вторая водородная связь тоже располагается скорее на поверхности белка и демонстрирует явно малую поддержку среди моделей ЯМР (всего 10%).
Но так или иначе удалось запечатлеть явную тенденцию, в рамках которой остатки, близкие к центру, поддерживаются большим количеством моделей ЯМР, нежели поверхностные. Это происходит из-за того, что в ЯМР регистрируемый белок располагается в растворе, в то время как в рамках РСА эксперимента белок находится в кристалле, что ограничивает свободу его перемещений.
Задание №2: Зависимость mean RMSF от mean B-factor.
В рамках второго задания решено было проверить, насколько подвижность белковой цепи, диктуемая разными моделями структуры ЯМР, отражает действительную подвижность белка. Для этого решено было сравнить для ряда эквивалентных остатков в двух структурах (ЯМР и РСА) параметры RMSF (мера подвижность отдельных участков по всем моделям ЯМР) и B-factor РСА. Для каждого из остатков были вычислены средние значения соответствующих параметров и отложены на диаграмме рассеяния (Рис. 3).
Обе цепи были обрезаны по краям для достижения сопоставления остатков в двух структурах (технические детали опущены и приведены более подробно в коде).
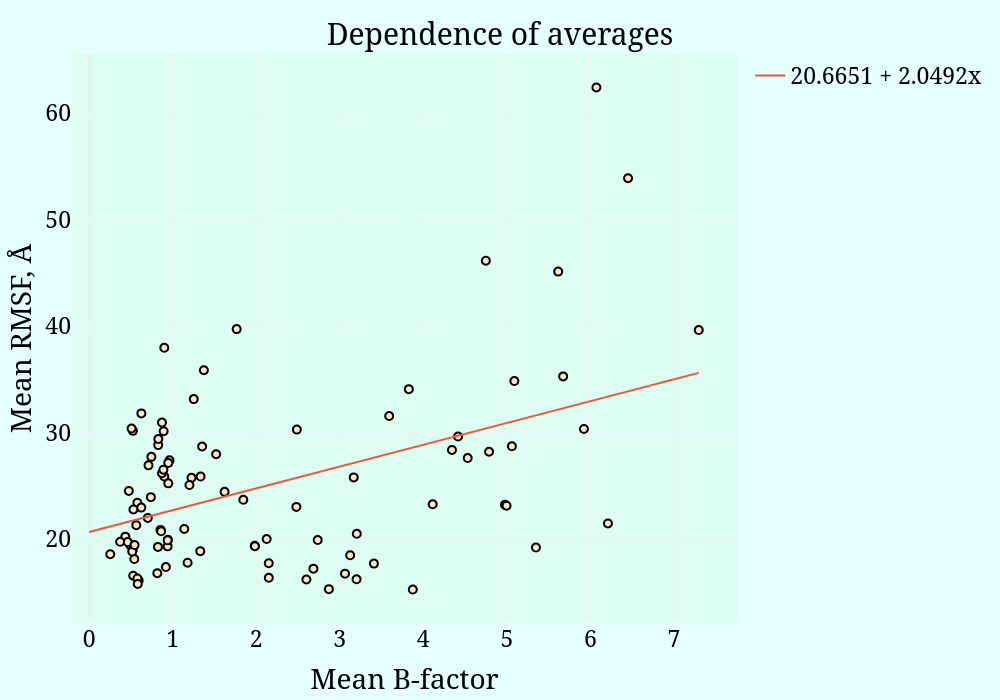
Между соответствующими параметрами наблюдается положительная относительно ненизкая корреляция (R = 0.45, p-value = 5e-6), что, однако, говорит о невысокой предсказательной способности ЯМр касательно подвижности соответствующих остатков (всё-таки корреляция ~ 0.45 - это не слишком высоко). Но и совсем низкой её назвать нельзя.
Ссылка на сессию pymol: 6pr.pse
Кирилл Кузенков, студент четвёртого курса ФББ