Green fluorescent protein(GFP)
Зелёный флуоресцентный белок (ЗФБ) (англ. green fluorescent protein, GFP) — белок, выделенный из медузы Aequorea victoria, который флуоресцирует в зелёном диапазоне при освещении его светом от синего до ультрафиолетового диапазона.
В настоящее время ген белка широко используется в качестве светящейся метки в клеточной и молекулярной биологии для изучения экспрессии клеточных белков.
Разработаны модификации белка для применения в биосенсорах. Созданы цельные светящиеся животные (например, свиньи), у которых ЗФБ внесён в геном и передаётся по наследству.
Созданы также ЗФБ-содержащие вирусные векторы, позволяющие локально вводить желаемый ген в организм животного и прослеживать экспрессируемый белок.
В 2008 году Осаму Симомура, Мартин Чалфи и Роджер Тсьен получили Нобелевскую премию по химии за открытие и разработку зелёного флуоресцентного белка GFP.
https://ru.wikipedia.org/wiki/Зелёный_флуоресцентный_белок
Ligands:
Start hydrophobic core №1
Start hydrophobic core №2
Start ion bridges
Start hydrogen bonds
Start protein-ligand
Resume
Save image
Про гидрофобные ядра:
Для поиска гидрофобных ядер я брал крупные ароматическиe (и довольно редкие) аминокислоты: для 1-го ядра TRP57 (триптофан), для 2-го TYR106 (тирозин).
Ядро №1: Как видно из апплета, азот из индола в боковом радикале триптофана находится близко к полярному растворителю(воде). Со стороны азота из бокового радикала триптофана много полярных молекул (вода). Сам же боковой радикал окружен боковыми радикалами валина, лейцина, метионина, гистидина(больше связанными с остовом триптофана полярными атомами), фенилаланина, тирозина (все они в той или иной мере неполярны). Минимальное расстояние от воды до бокового радикала 3,6 ангстрем.
Ядро №2: Здесь остов тирозина стабилизируется азотом из остова лизина и боковым радикалом аспарагина, боковой радикал окружен фенилаланином, изолейцином, лейцином, валином. Минимальное расстояние от воды до бокового радикала 5,6 ангстрем.
Большая часть атомов находится на расстоянии около 3,5 ангстрем от выбранного неполярного аминокислотного остатка.
В эти 3,5 ангстрем помещается кислород(d=3,08 ангстрем) и азот(d=2,8 ангстрем).
Про солевые мостики:
При внешнем осмотре белка в Jmol обнаружил интересный ARG109 с двумя термодинамически допустимыми положениями в белке.
Он образует солевой мостик гуанидо группой с боковым карбоксилом GLU95 или с боковым карбоксилом GLU111.
В попытке объяснить наличие двух термодинамически возможных вариантов, добавил солевой мостик LYS113 с GLU111, предполагая, что это один из факторов, препятствующих связи GLU111 с ARG109, когда тот связан с GLU95.
Последний мостик был выбран за красоту расположения боковых радикалов.
Про водородные связи:
Учёл замечения по практикуму №1 и взял в этот раз бета тяжи подлиннее. Дополнительно отключил Rasmol для более верного подсчёта водородных связей(см. скрипт).
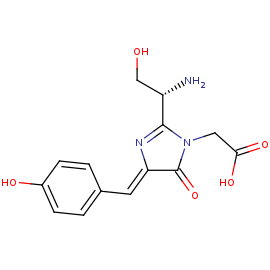
Механизм люминисценции GFP:
Youvan D. C., Michel-Beyerle M. E. Structure and fluorescence mechanism of GFP //Nature biotechnology. – 1996. – Т. 14. – №. 10. – С. 1219.
https://www.nature.com/articles/nbt1096-1219
download
© Кирпичиков Роман, 2017