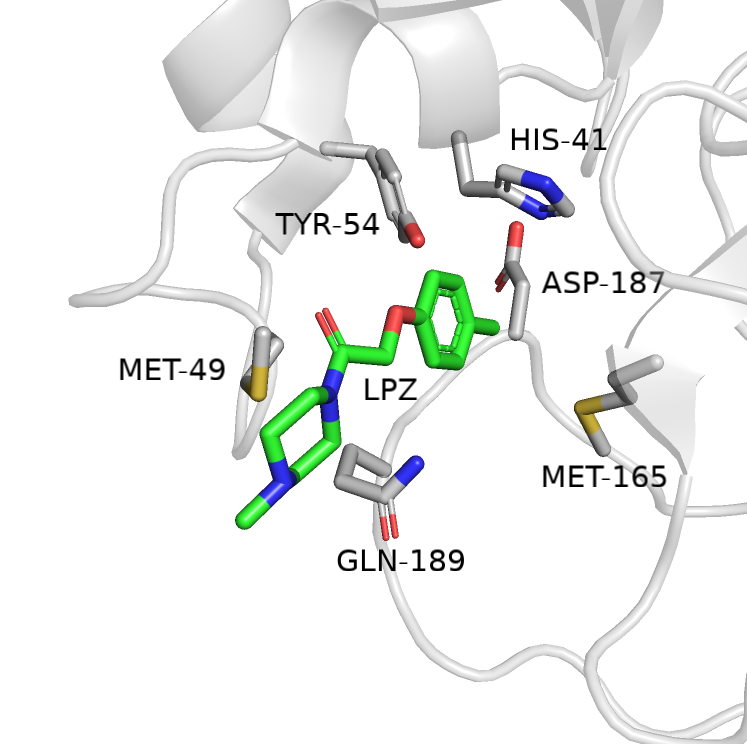
В этом задании использовалась структура 5RE9. В файле помимо протеазы содержатся данные двух соединений: LPZ и DMS (диметилсульфоксид). Для выполнения задания выбрал LPZ.
На Рис.1 показан LPZ и его окружение. Есть основания предположить, что TYR-54 акцептором водородной связи, а бензольное кольцо LPZ её донором.

Расcмотрели две расшифровки структуры металло-бета-лактамазы 2 типа. В целом в элетронной плотности альфа спирали 5NBK(Рис.2, сверху) более размытые электронные облака, в которых трудно увидеть центра атомов предложенной модели. В 5XP6(Рис.2, снизу) же все центры атомов остова хорошо различимы.
Значит 5XP6 имеет лучшее разрешение, чем 5NBK. И действительно, по данным PDB у 5XP6 разрешение 0.95Å, а у 5NBK - 2.23Å.
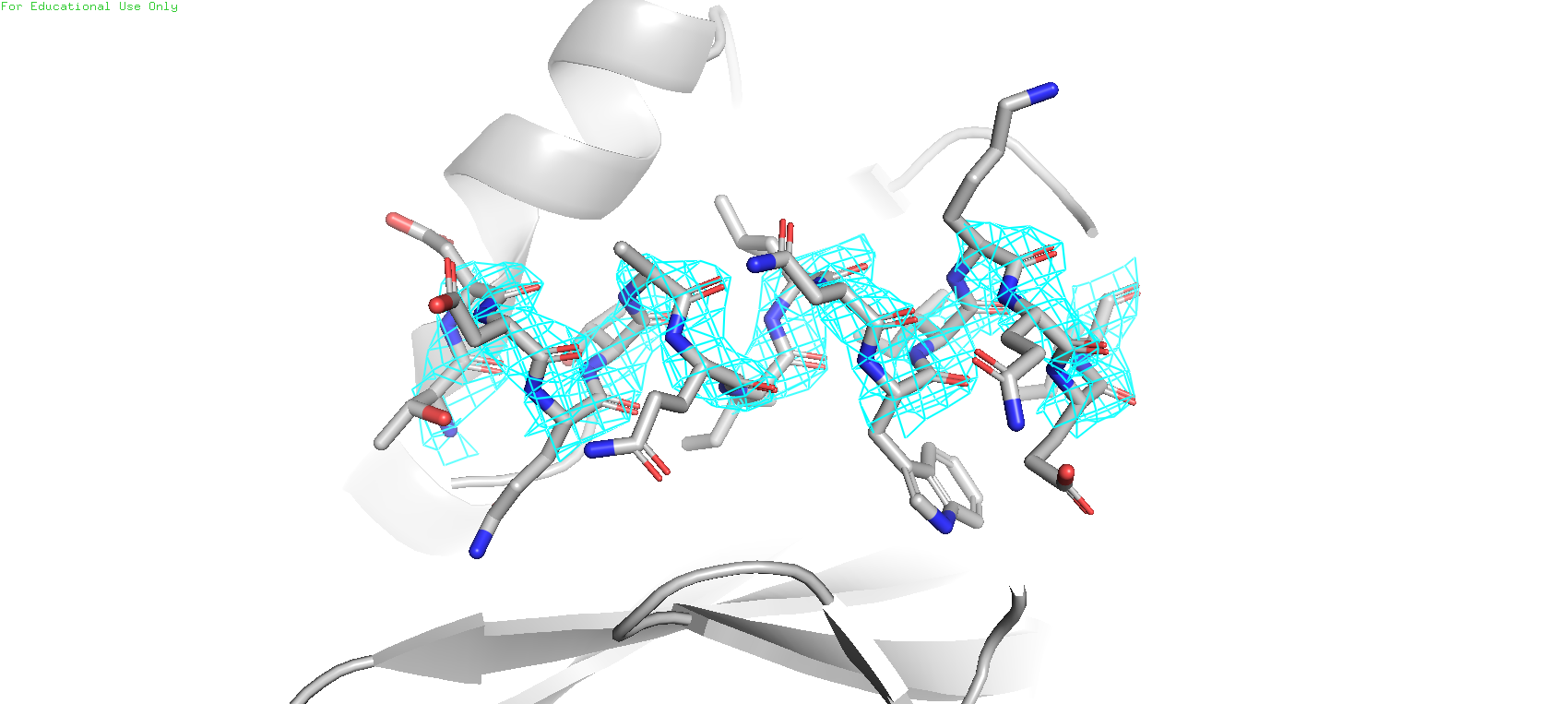
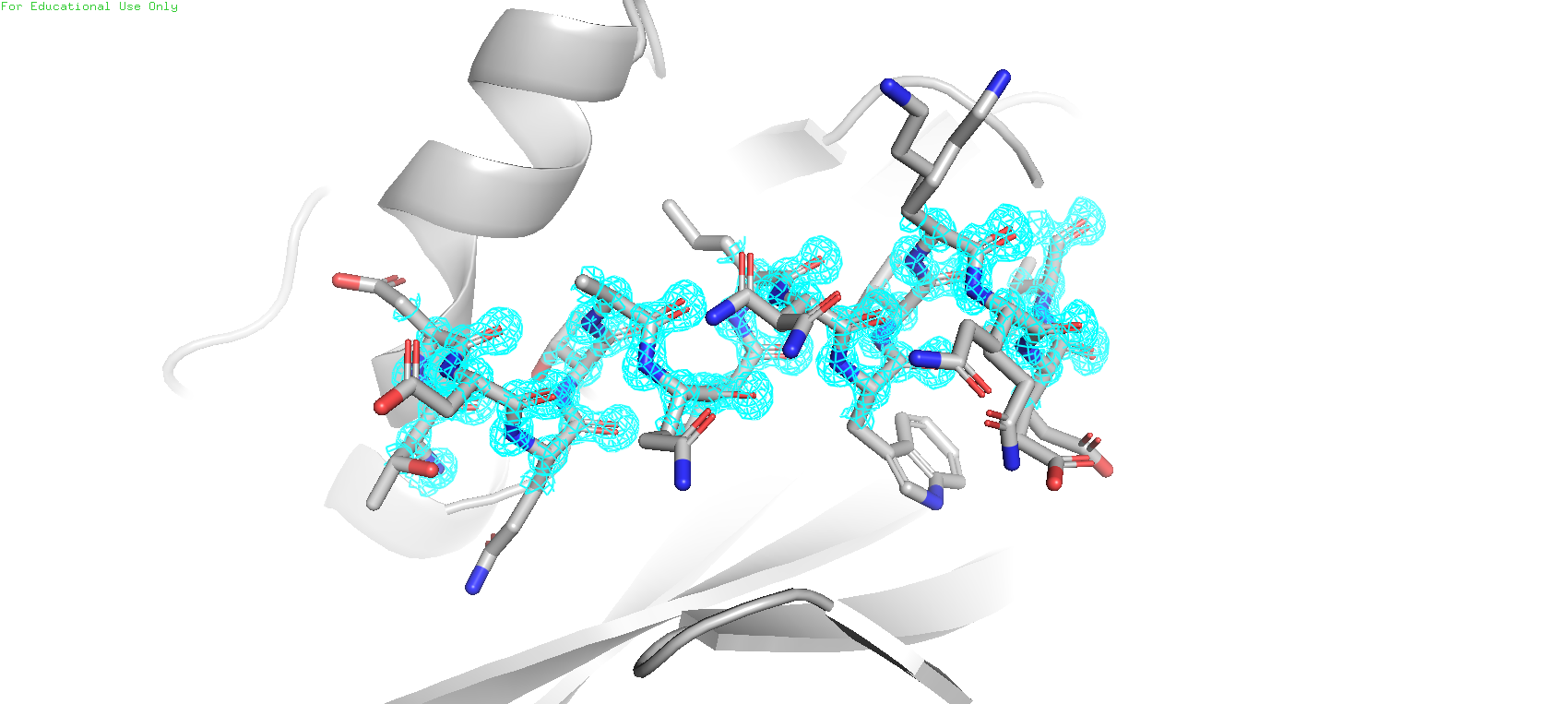
В этом задании нам предложено посмотреть на электронную плотность остова протеазы SARS-CoV-2 на разных уровнях подрезки (1,2,3)
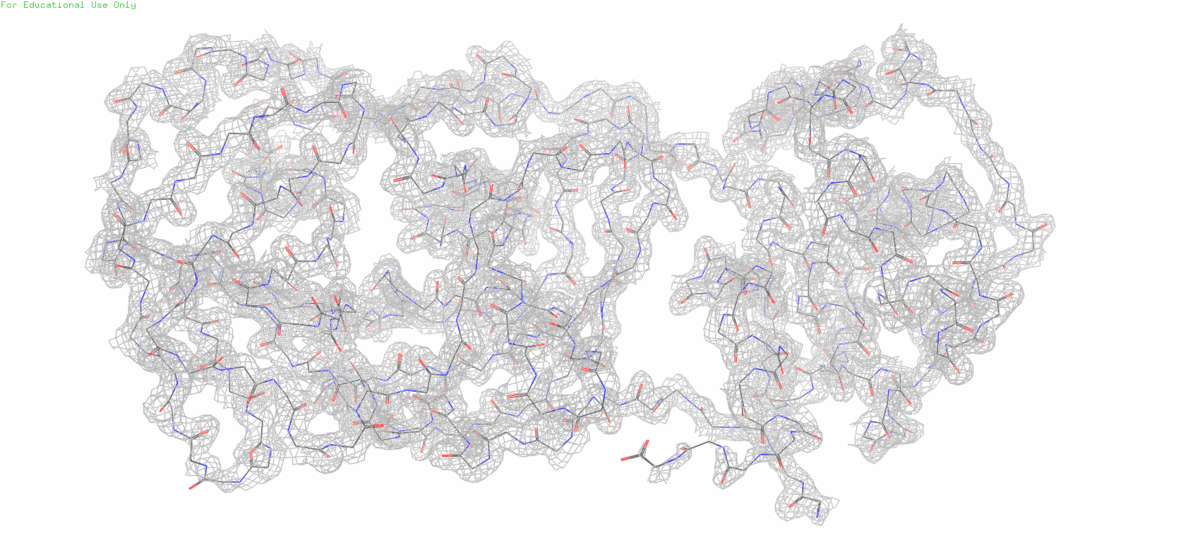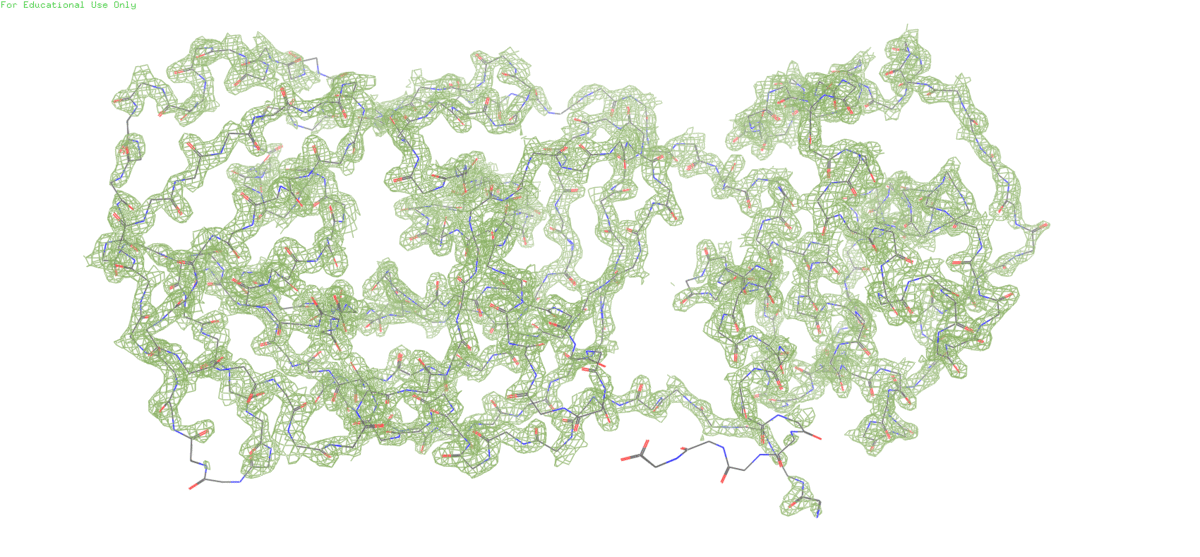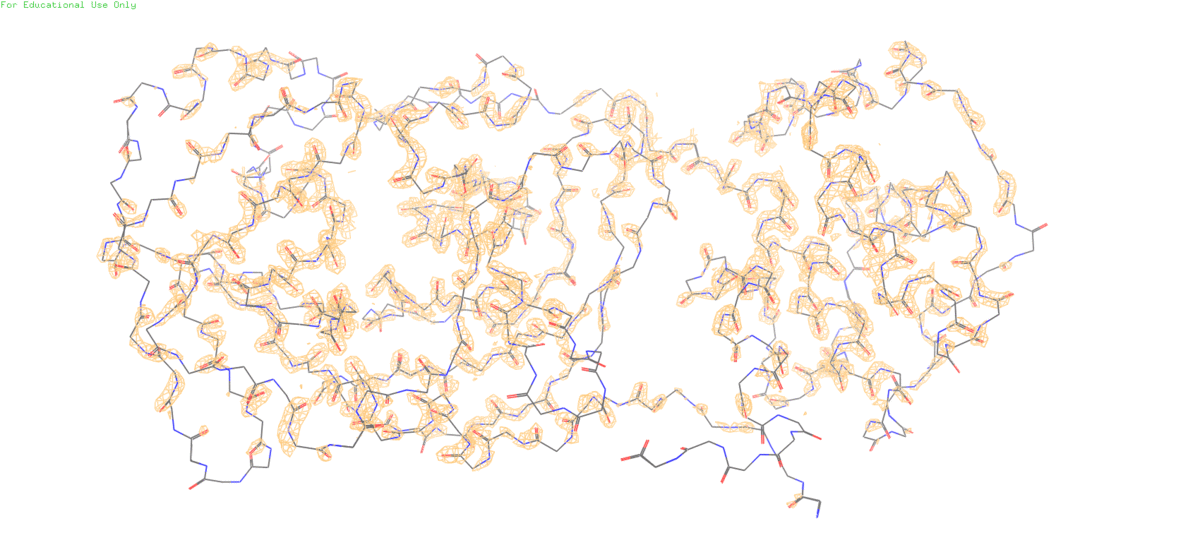
Уже на втором уровне подрезки заметен С-конец белка, которому видимо не удалось хорошо закристаллизироваться из-за высокой подвижности и поэтому его электронная плотность размазалась в пространстве.
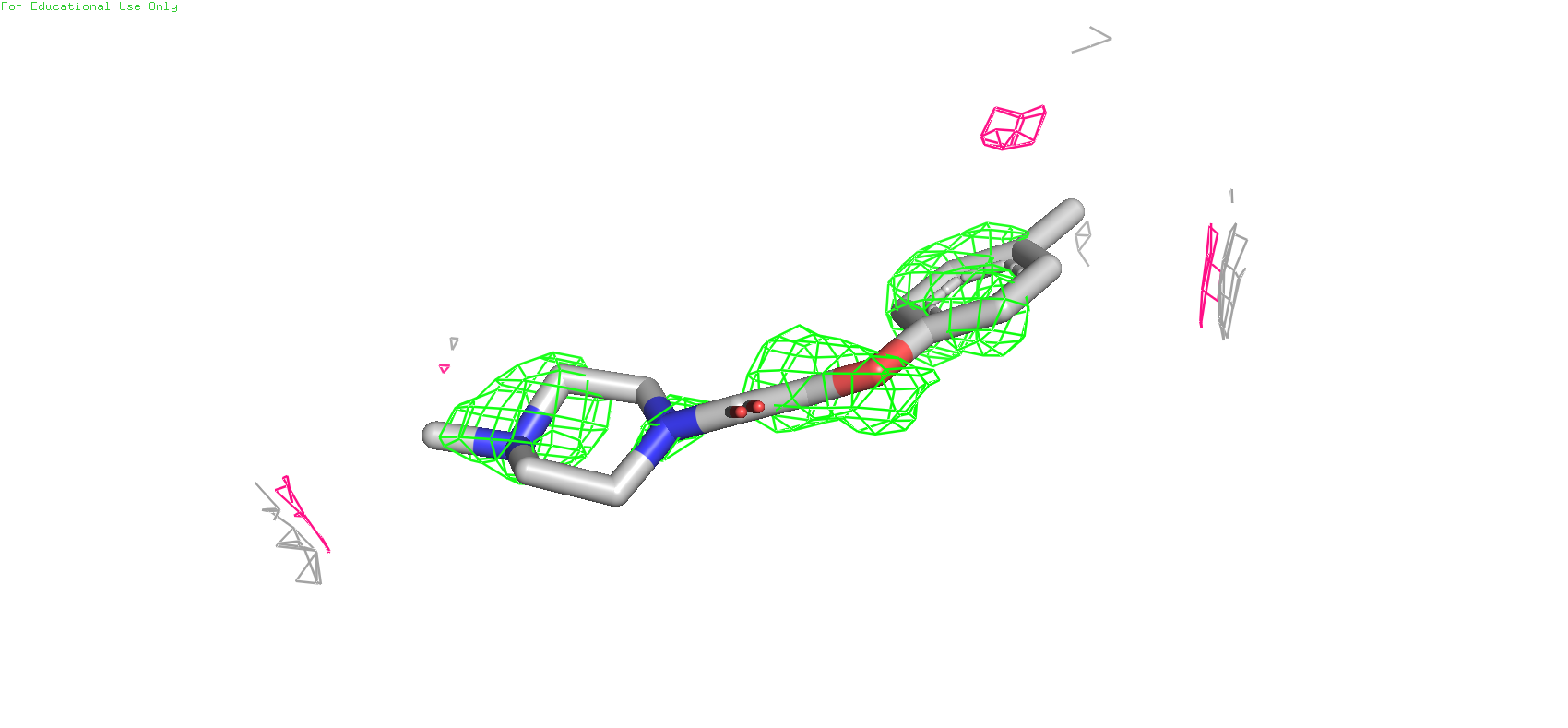
На Рис.4 показаны электронные плотности LPZ на разных уровнях отсечки. (зелёным цветом показан 1 уровень, мажентой 2-ой, а серым 3-ий). Как видно из картины, электронная плотность лиганда невысока и поэтому мы её видим только на первом уровне отсечки (2 и 3 уровень показывают элетронную плотность окружения лиганда). Это может быть связано с тем, что лиганд не связан ковалентно с белком и следовательно не во всех кристаллографических ячейках он мог оказаться.