
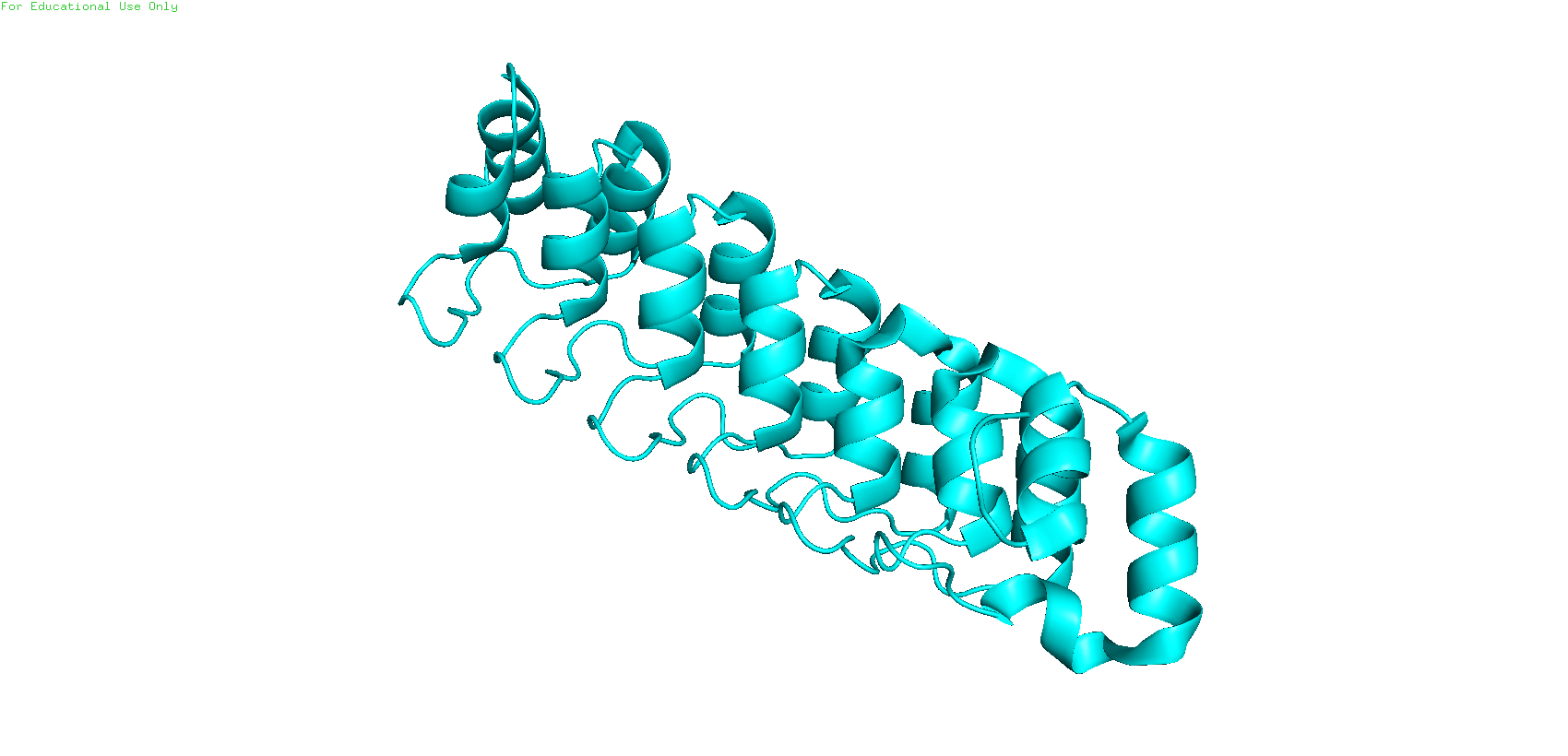
Целью данного задания было сравнение структур человеческого онкогена - ганкурина, полученных с помощью ЯМР (1TR4) и РСА (1UOH) на макро- и микроуровнях. Разрешение РСА структуры составило 2,0 A. Число посчитанных моделей ЯМР - 20.


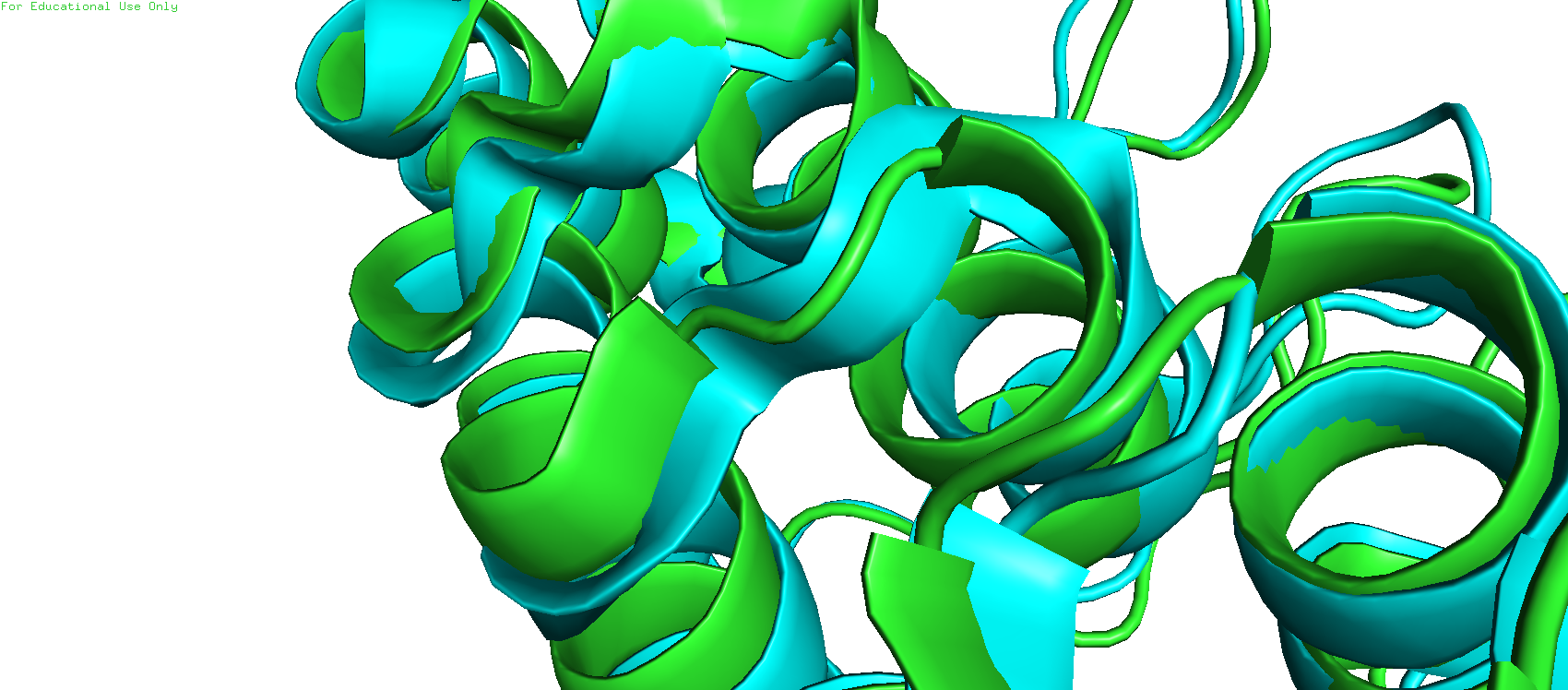
Ниже показан gif файл наложения 20 моделей ЯМР на модель РСА.

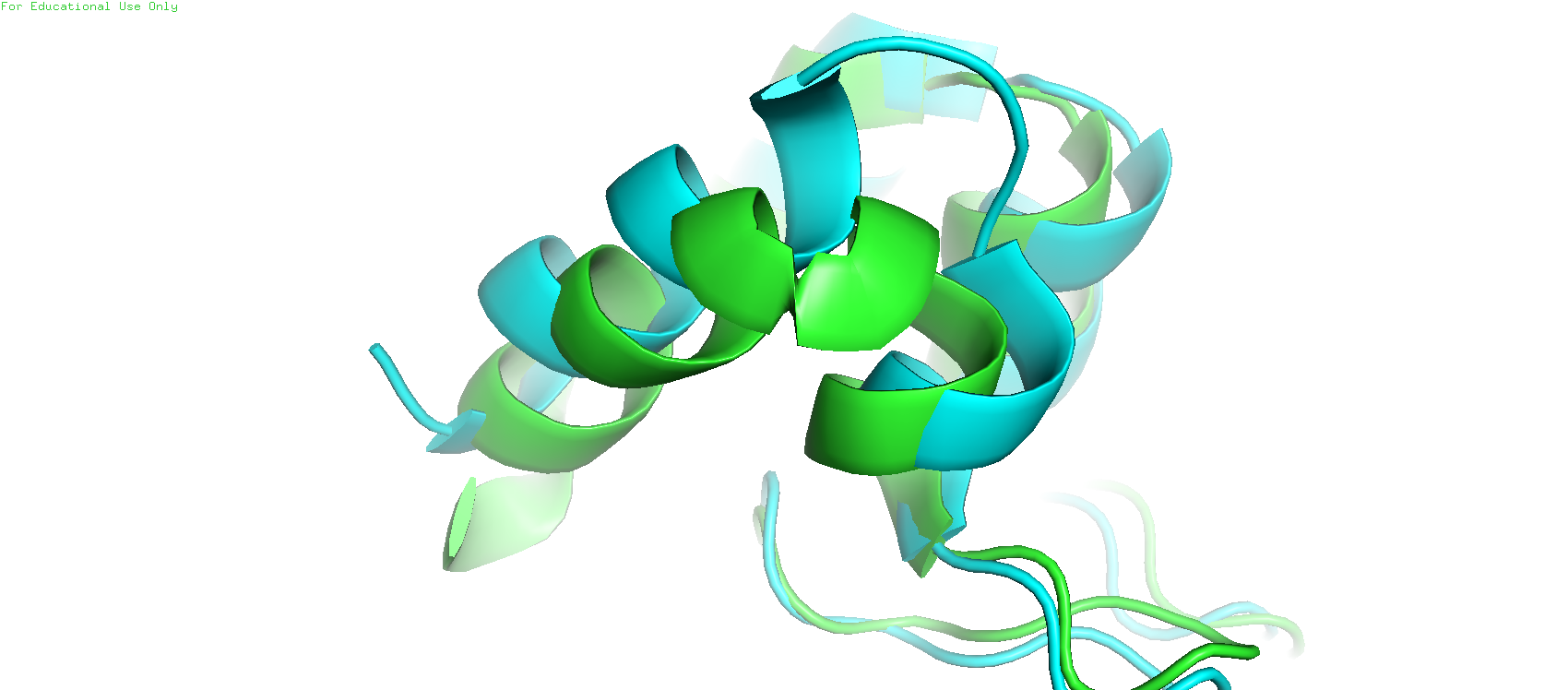
Ниже представлены различия в разметке альфа-спиралей у РСА модели (голубой) и ЯМР модели (первой и зеленой). Рассматривал только одну модель, чтобы не загромождать картинки. Все эти различия обоснованы слегка отличающимся положением атомов и, возможно, способами разметки вторичных структур в РСА и ЯМР, и не вносят какую-либо неоднозначность в расшифровку структуры.

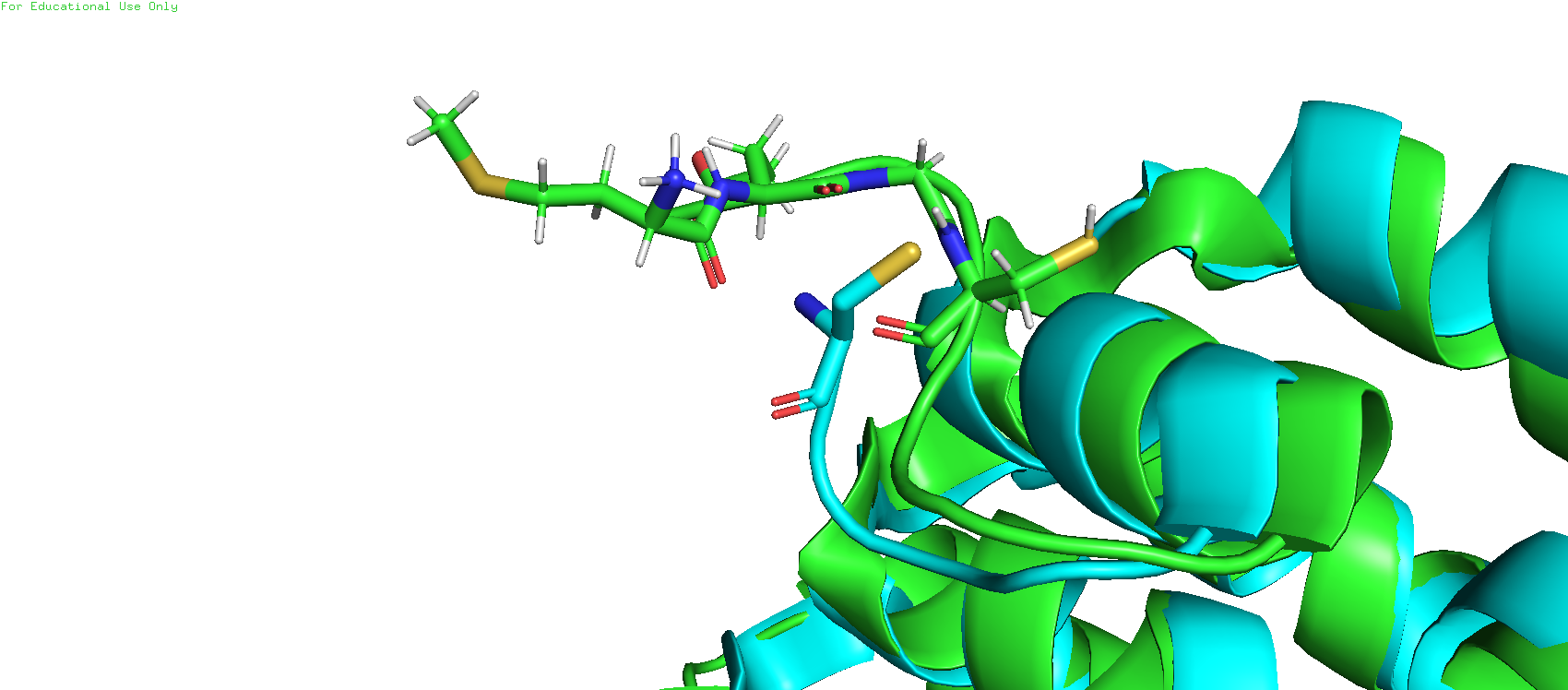
В РСА отсуствуют 3 N-концевых аминокислотных остатка. РСА структура начинается с CYS.
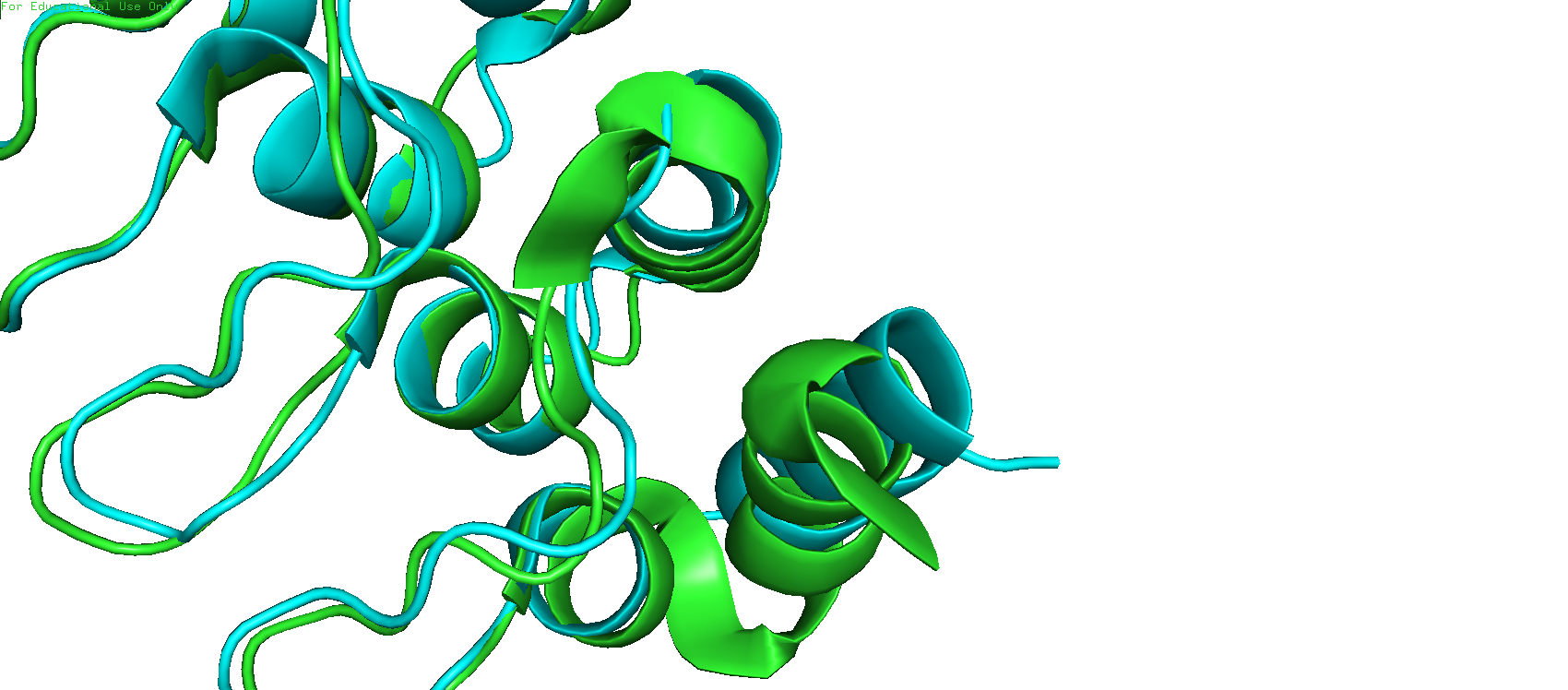
На Рис.5 видим довольно значительное пространственное различие в положении крайних альфа-спиралей у ЯМР и РСА. Это может быть связано с большей, относительно остальной частью белка подвижностью этих альфа-спиралей, так как они стерически меньше ограничены окружением. А когда пошел процесс кристаллизации, то они застыли в другой конформации, чтобы образовать кристалл.
Для совпадающих остатков в ЯМР и РСА моделях были вычислены средние RMSF и B-факторы, соответственно (все остатки совпадают, за исключением 3 остатков, отсуствующих в РСА модели).
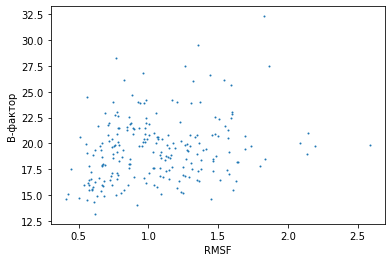
Коэффициенты корреляций Пирсона и Спирмена соответственно равны 0,24 и 0,24, что говорит о том, взаимосвязь между B-фактором и RMSF слаба. Это значит, что ни о каком тренде говорить не приходится. На Рис.6 видно, что в областях с большим RMSF B-фактор также большой, однако большой В-фактор также можно встретить у остатков с низким значением RMSF. При этом также есть много остатков, у которых В-фактор средний при низком RMSF, а также остатки с низким значением В-фактора при значениях RMSF выше среднего. Поэтому как-то связать RMSF атомов, посчитанный из моделей ЯМР, и их B-фактор из модели РСА не представляется возможным. Вероятно причина такого резульата заключается в том, что RMSF, вычисленное по ЯМР моделям не отражает реальную подвижность.
| Тип водородной связи | Расстояние в РСА (A) | Процент и число ЯМР моделей со связью | Расстояние в ЯМР (A) | ||
| Мин. | Макс. | Медиана | |||
| Между атомами остова альфа-спирали Рис.7 | 2,9 | 100%, 20 | 2,6 | 3,3 | 2,7 |
| Между атомами боковых цепей альфа-спирали Рис.8 | 3,1 | 0%, 0 | 4,1 | 6,9 | 5,25 |
| Между атомами боковых цепей петли Рис.9 | 2,9 | 10%, 2 | 2,9 | 5,9 | 4,5 |
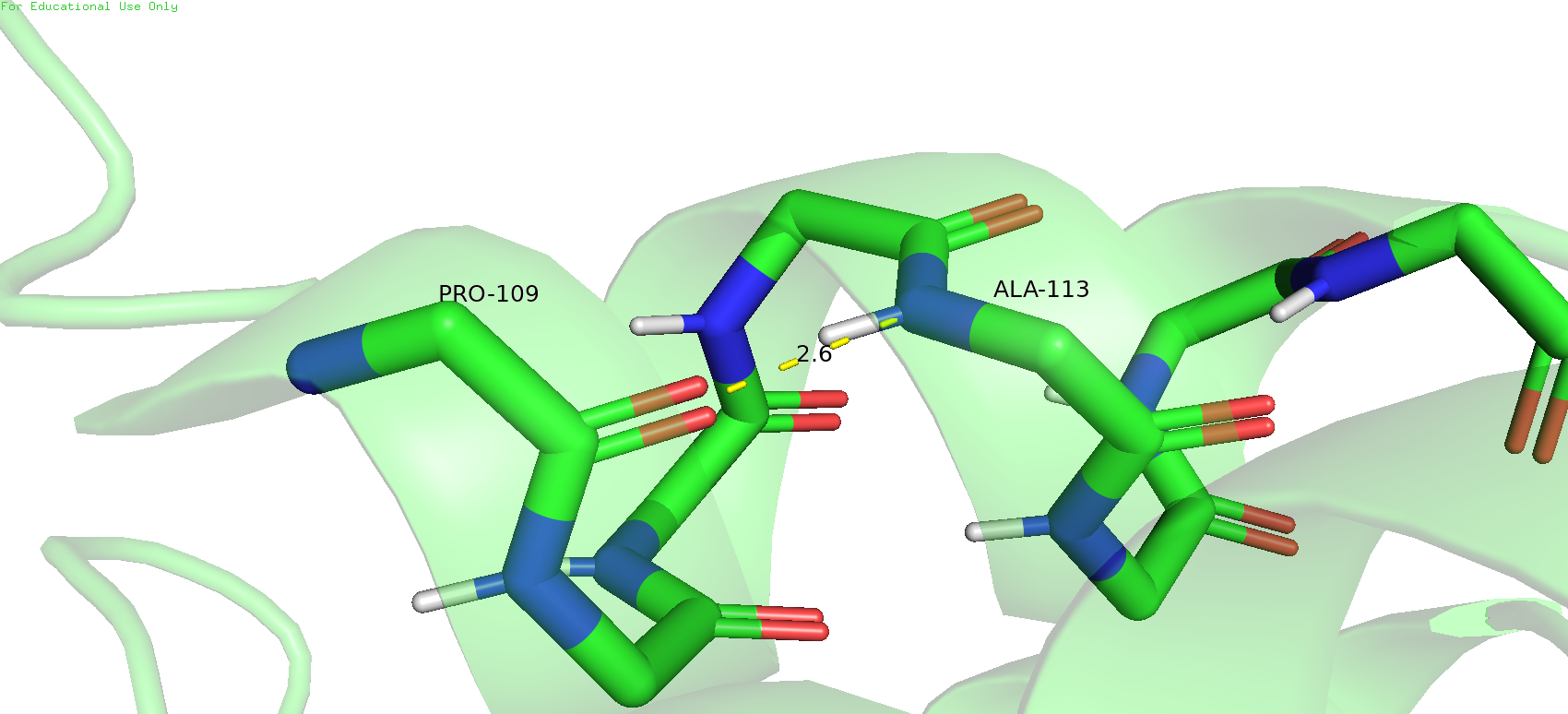
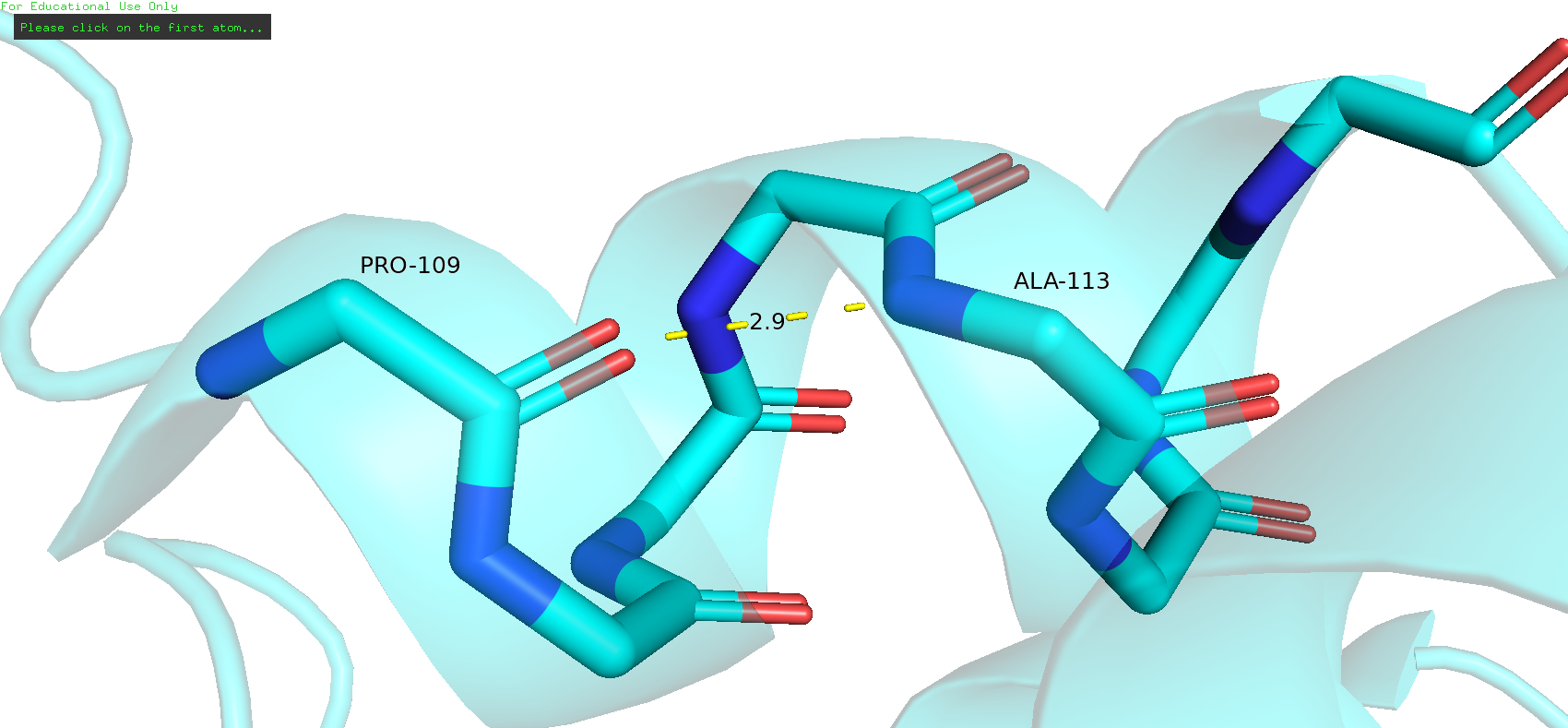
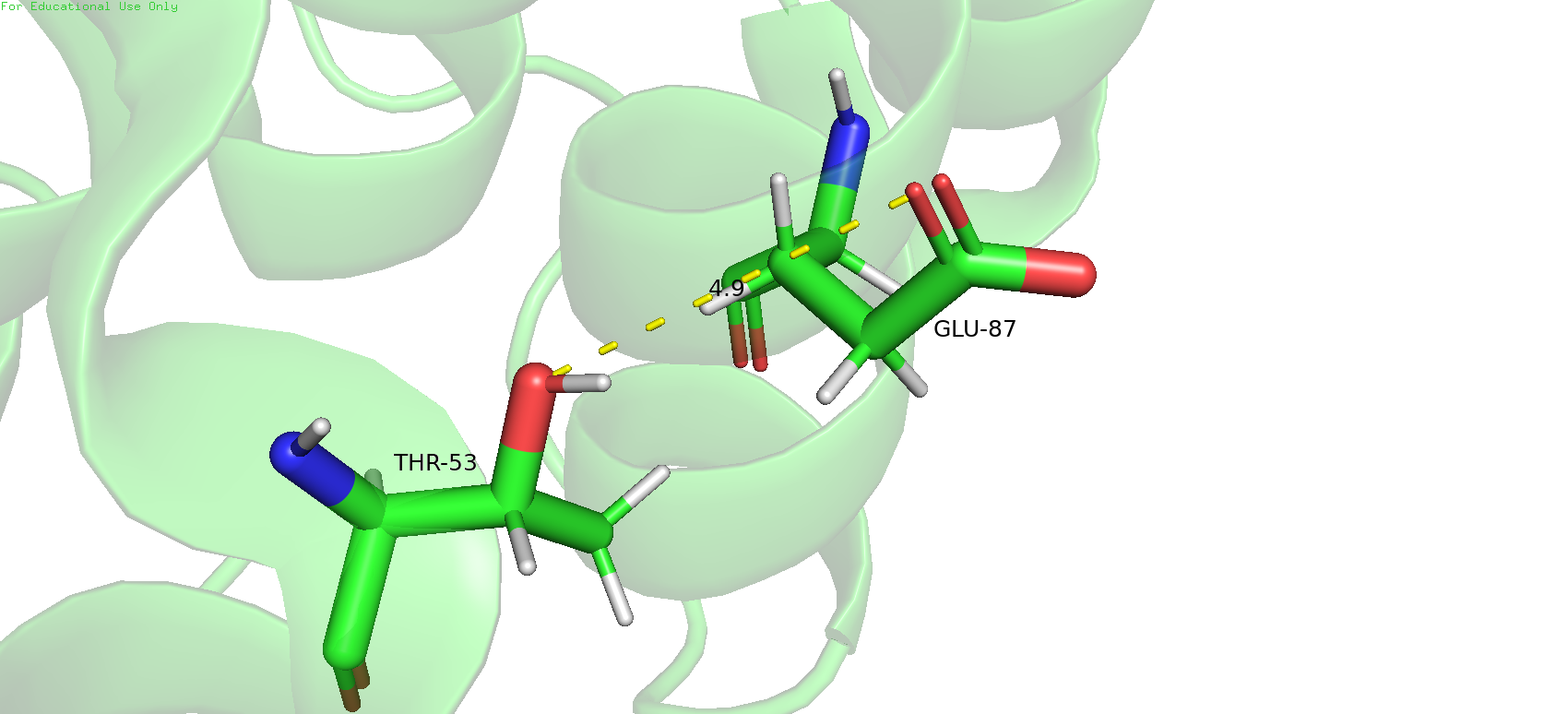
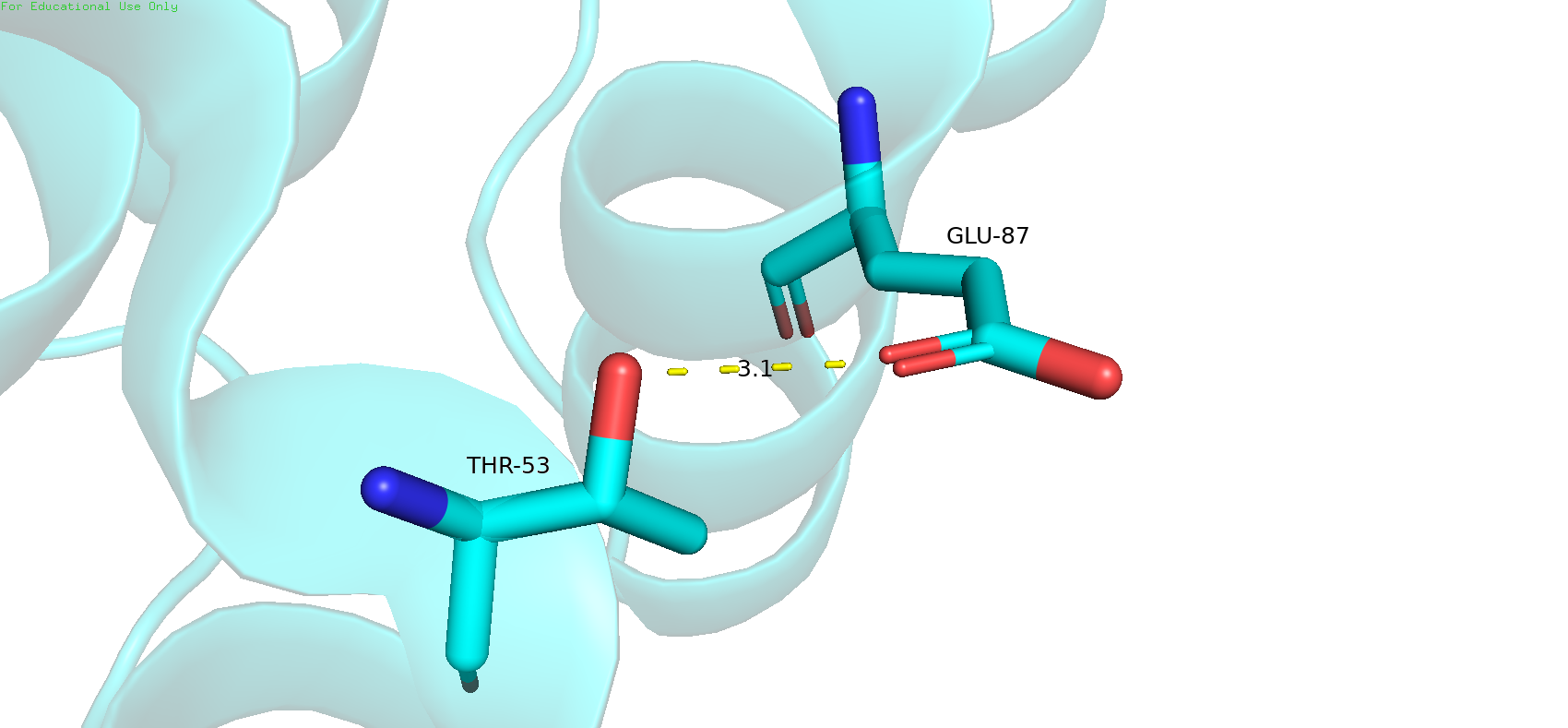
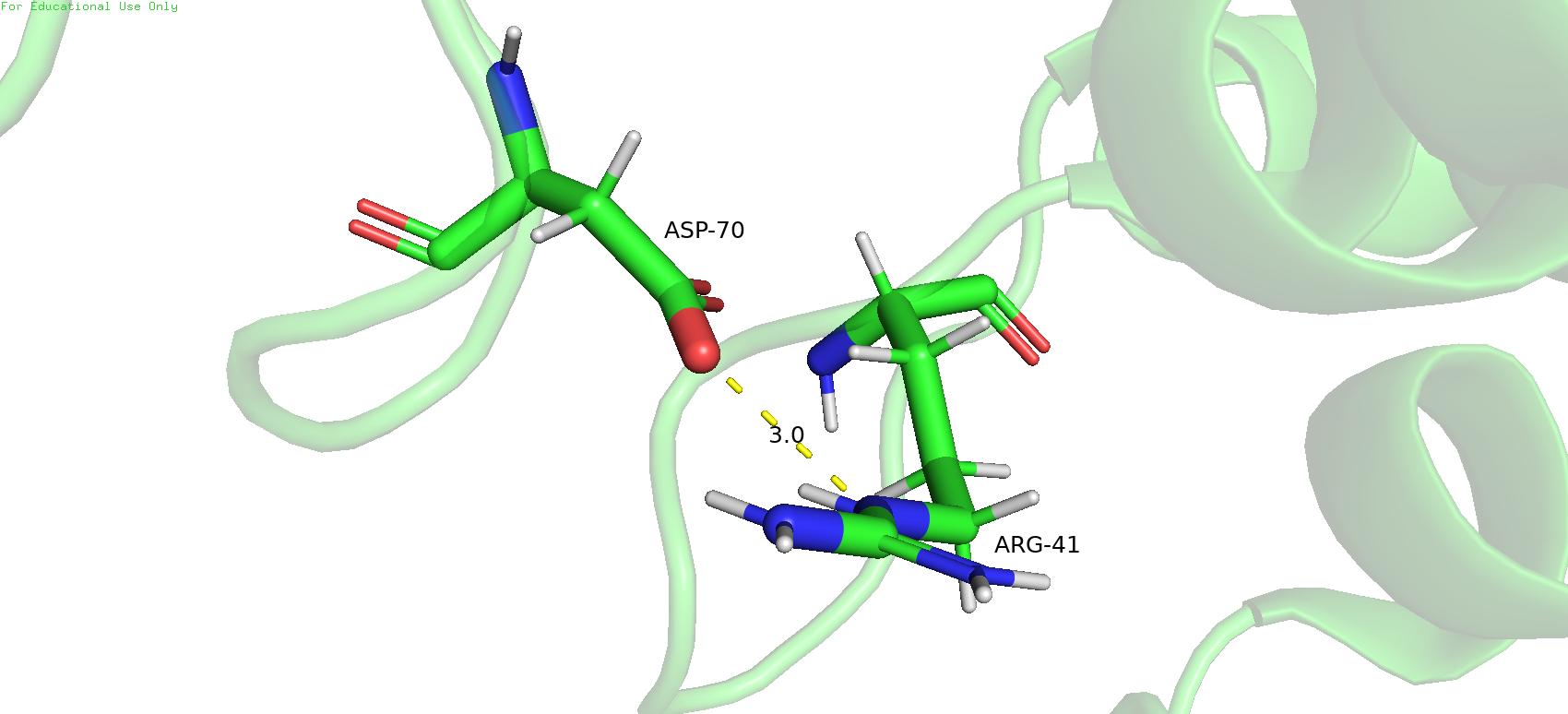
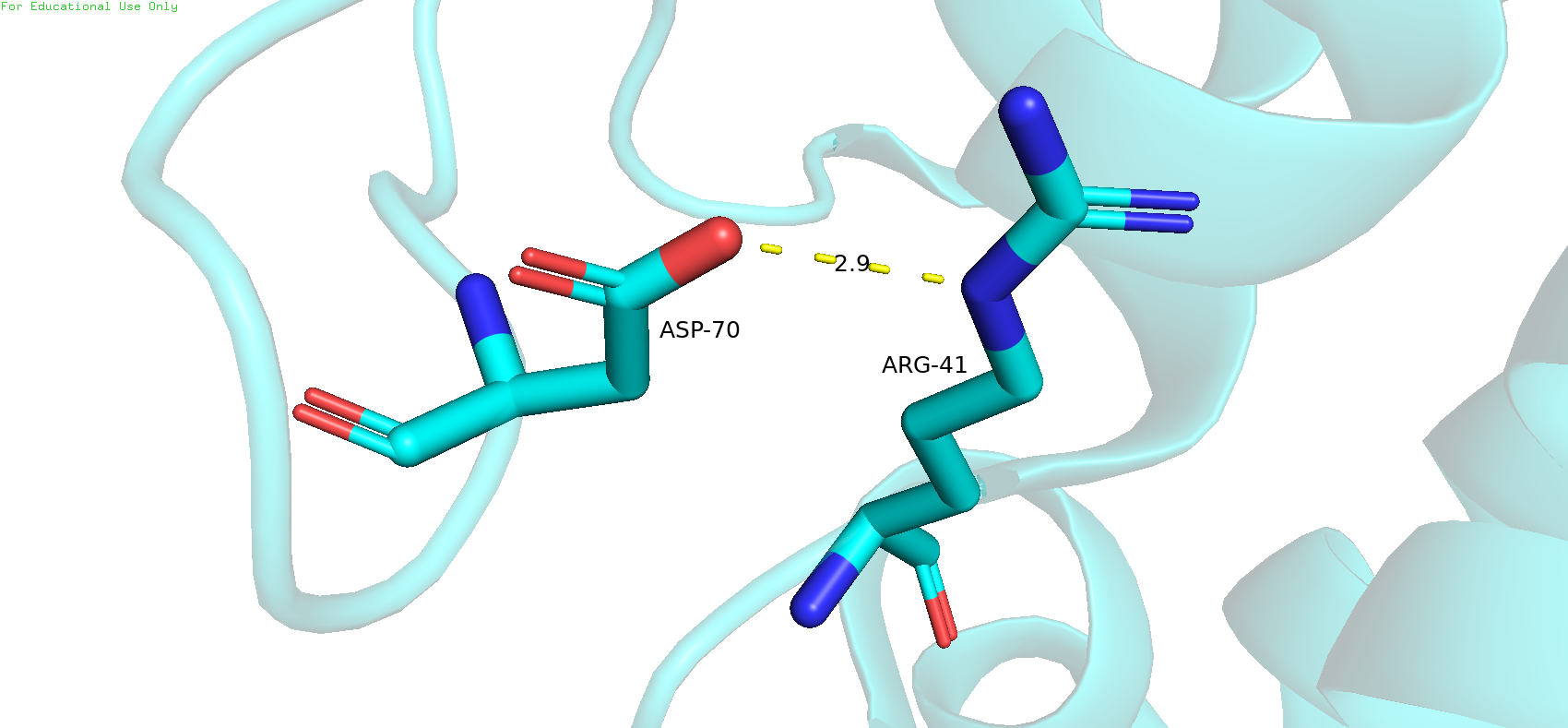
Можно сделать вывод, что в таких жеских структурах как альфа-петли водородные связи между атомами остова (связи поддерживающие структуру альфа-спирали) присутствуют и на ЯМР и на РСА моделях, что логично, ведь без этих связей не было бы и альфа-спиралей. В свою очередь водородные связи, образованные боковыми радикалами аминокислот, далеко не всегда есть в ЯМР моделях, что говорит нам о том, что в РСА моделях не все водородные связи между боковыми радикалами на самом деле присутствуют в белке. Это логично, ведь при кристаллизации белок стремится понизить свою свободную энергию и из-за этого начинаются появляться новые водородные связи, которых не было в растворённой в воде форме белка. То есть кристаллизация белка для РСА вносит дополнительные водородные связи в модель.