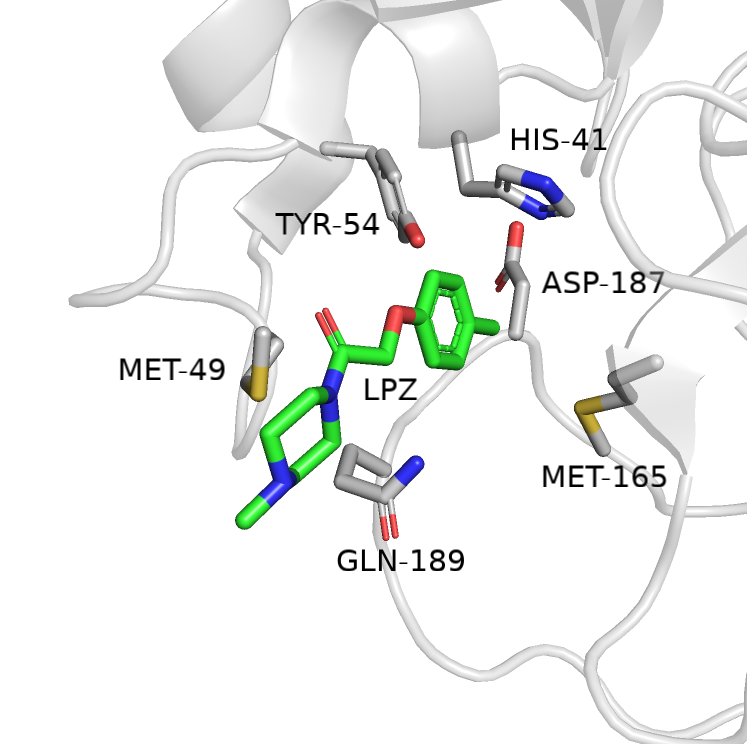
В первом практикуме я предположил только одно взаимодействие - водородную связь между TYR-54 (акцептор) и бензольным колцом лиганда (донор). PoseView же не обнаружил никаких взаимодействий. Ни водородных связей, ни гидрофобных взаимодействий. С другой стороны нельзя сказать, что этот лиганд оказался в структуре случайно. Его электронная плотность видна на 3-ем уровне подрезки. В чём же дело и за счёт чего лиганд удерживается в кармане связывания идей нет.

На Рис.2 видим сайт мутагенеза - GLY-3144 (углероды зелёного цвета). Сразу можно отмести крупные аминокислотные остатки вроде гистидина, тирозина, фенилаланина и триптофана.
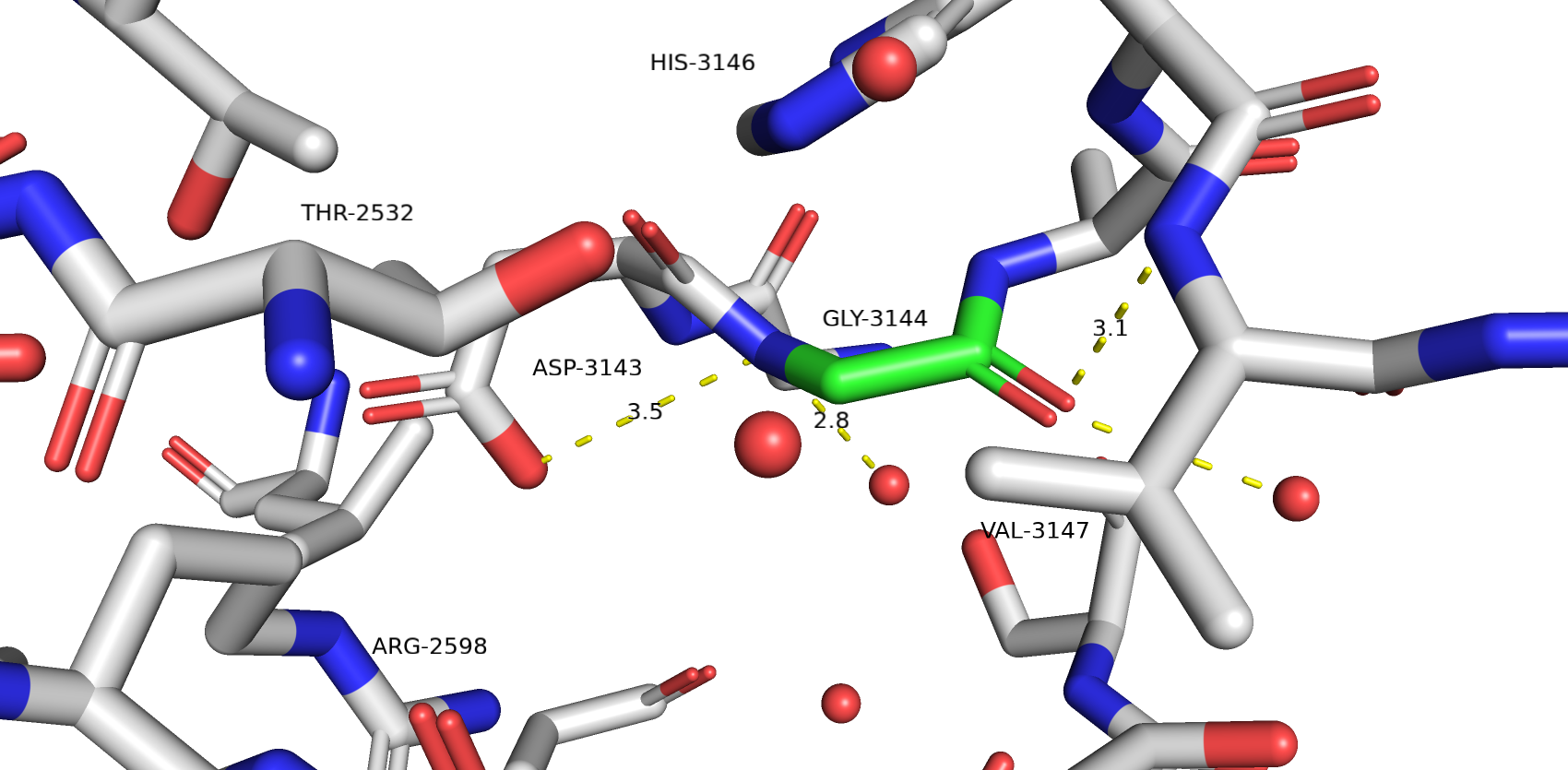
Перебирая все остальные аминокислотные остатки остановил своё внимание на аспарагине и аспартате, а так же глутамине и глутамате. Они подходят по размерам и образуют водородные связи с другими остатками в сайте мутагенеза.
Для аспарагина strain=16.92 и предсталенность ротамера 7%. Он образует хорошую водородную связь с ARG-2598 и неплохо заполняет внутреннюю полость белка, образовавшуюся из-за замены на глицин.
Для аспартата strain=16.88 и представленность ротамера 25.4%. Его водородная связь немного проигрывает по энергии водородной связи аспарагин, но от так же неплохо заполняет внутреннюю полость белка.
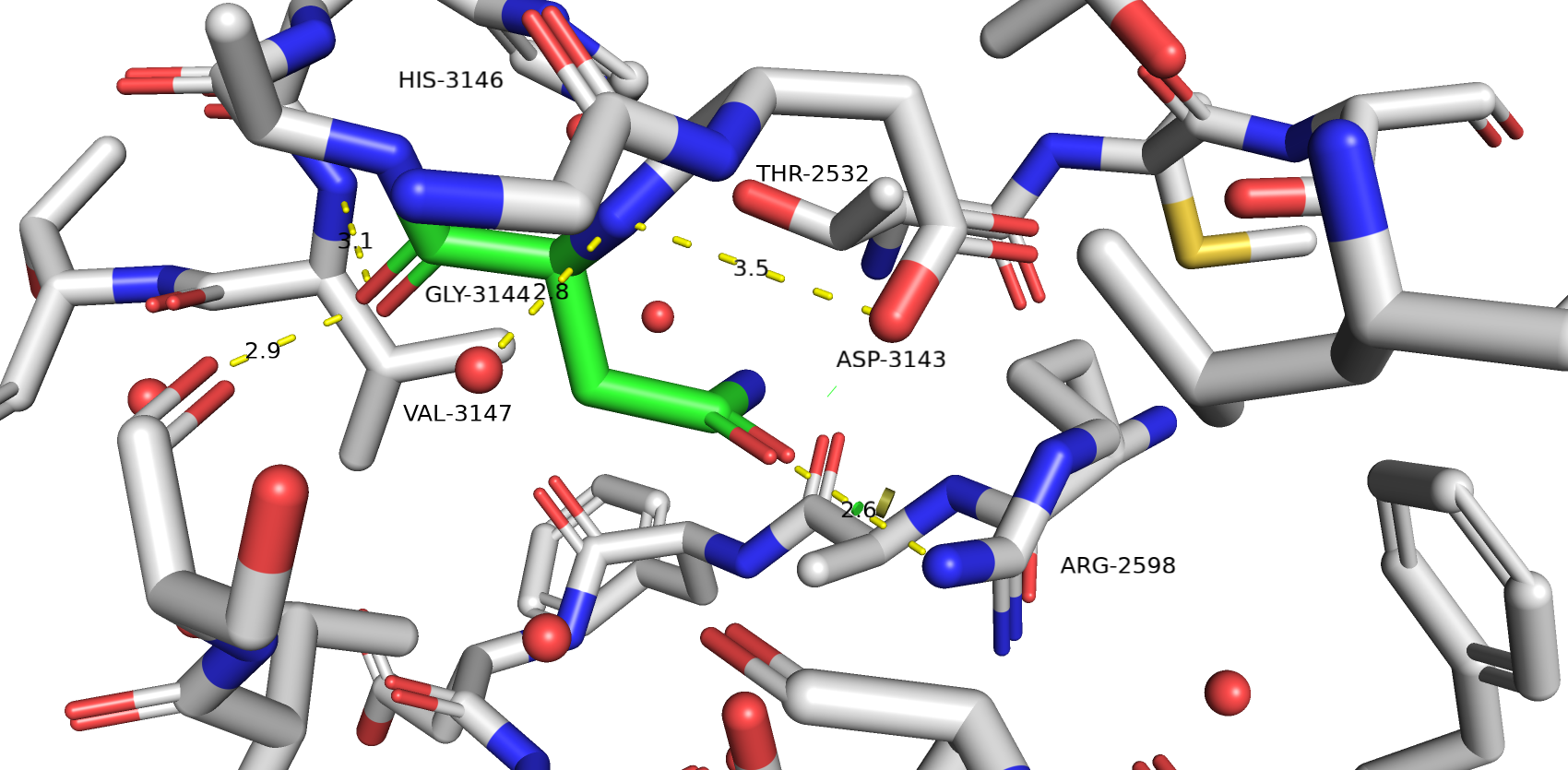
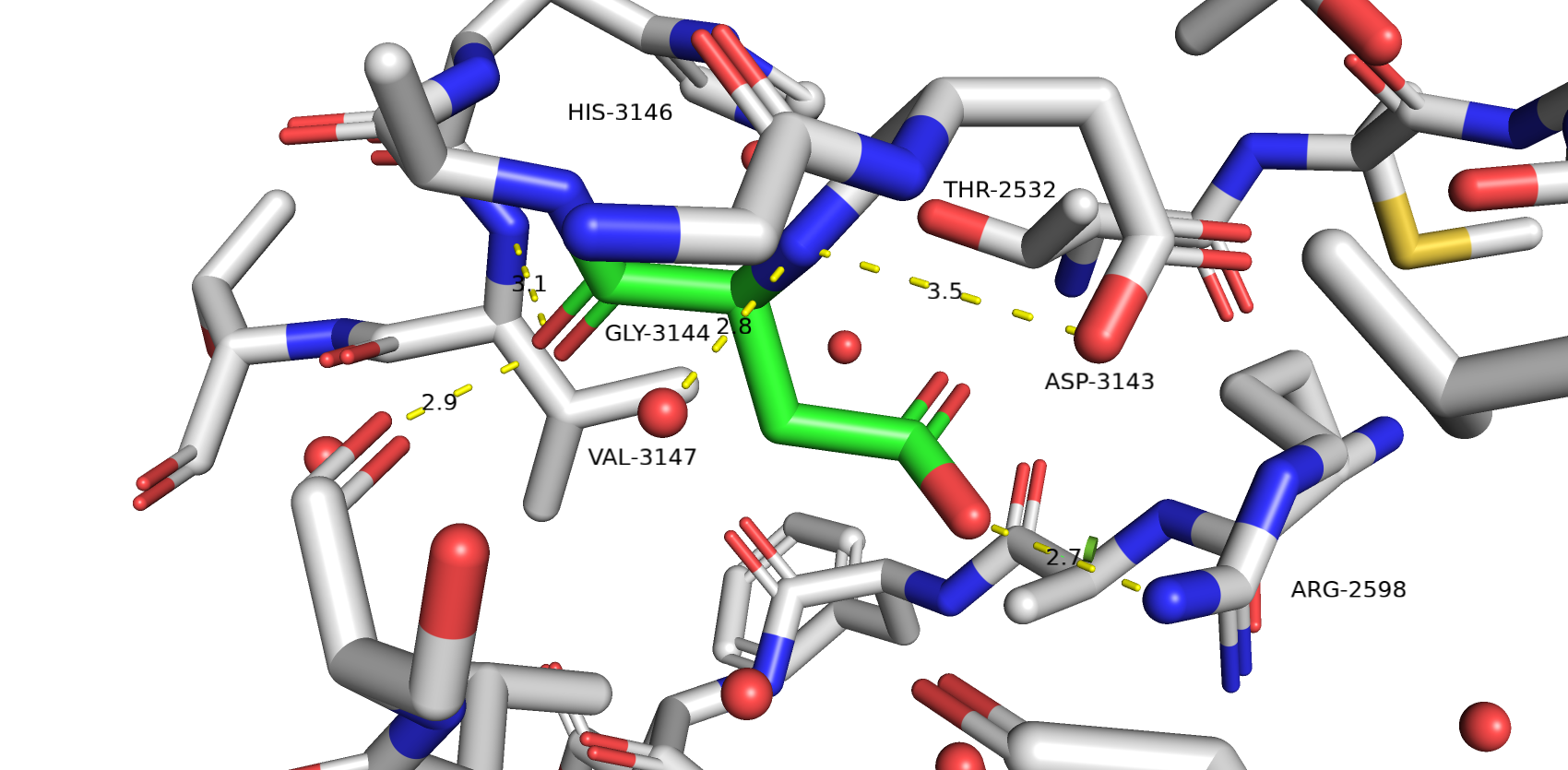
Для глутамина strain=16.01 и предсталенность ротамера 1.5%. Он образует хорошую водородную связь с THR-2532 и неплохо заполняет внутреннюю полость белка, однако есть коллизия вандервальсовых радиусов с аланином.
Для глутамата strain=18.61 и представленность ротамера 5.5%. Он так же образует хорошую водородную связь с THR-2532, и неплохо заполняет внутреннюю полость белка, однако есть коллизия вандервальсовых радиусов с ARG-2598.
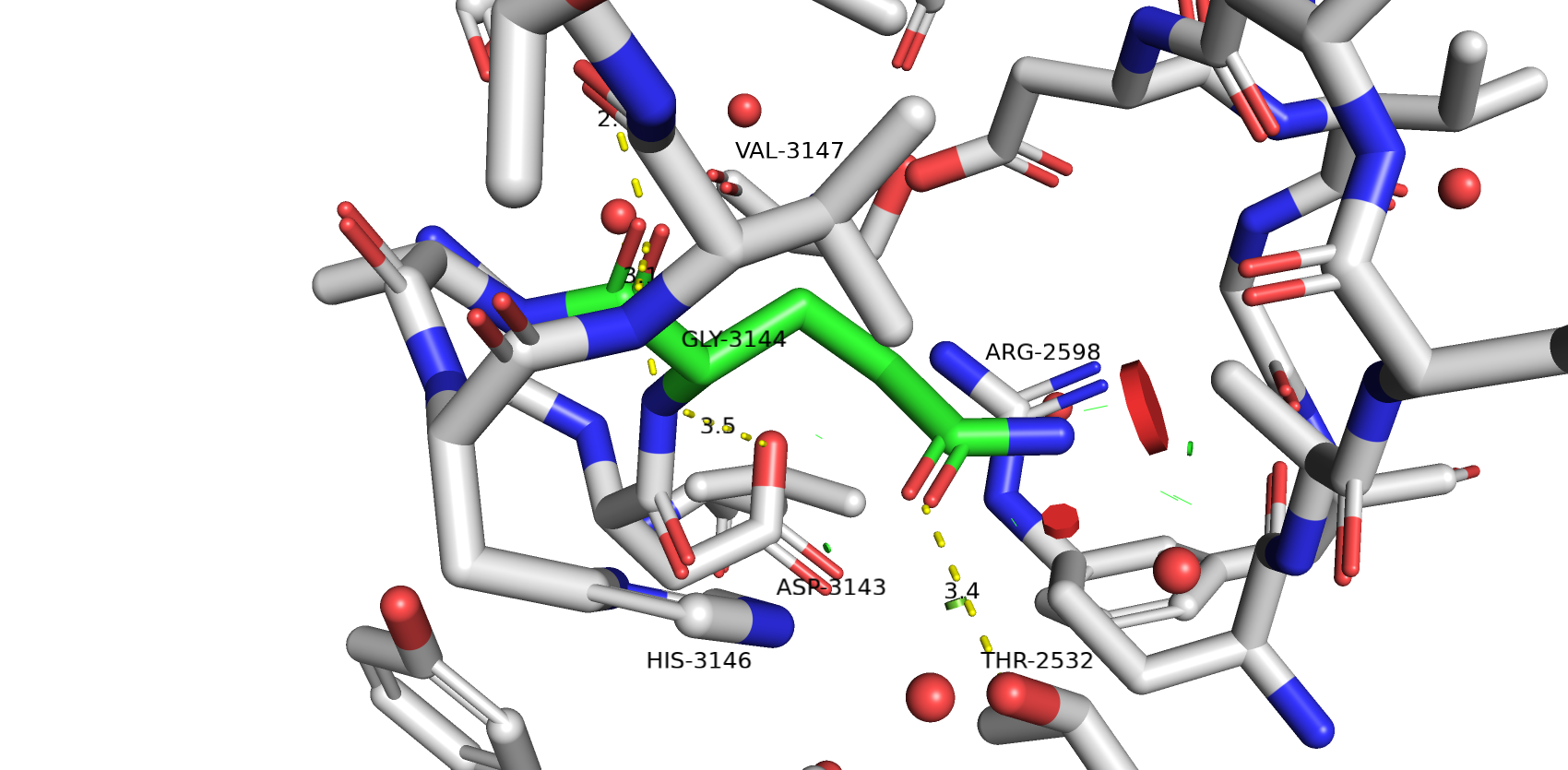

В конечном итоге я остановился на варианте с ASP потому что он там нужен для формирования водородной связи и соляного мостика с ARG-2598. У достаточно низкий strain и представленость ротамера 25.4%. Возможно полость белка не оказывается не полностью заполненной, но зато нет коллизий вандервальсовых радиусов как с GLU и GLN. THR-2532 уже образует водородную связь с HIS-3146, поэтому не думаю, что GLN и GLU больше подходят.
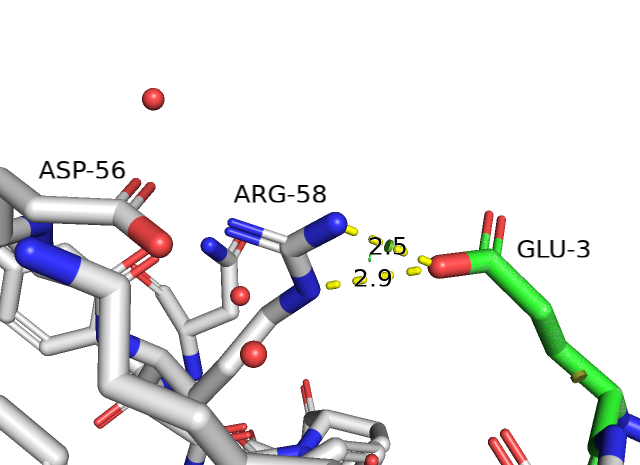
Для второго белка была произведена замена GLY-3 на GLU-3 (strain=13.57 и представленность ротамера 1.1%). Это единственный вариант имеющий смысл, потому что глутамат образует водородную связь и солевой мостик с ARG-58, который также образует водородную связь и солевой мостик с ASP-56.