Пространственная структура плазмепcина II
1 Структура в целом
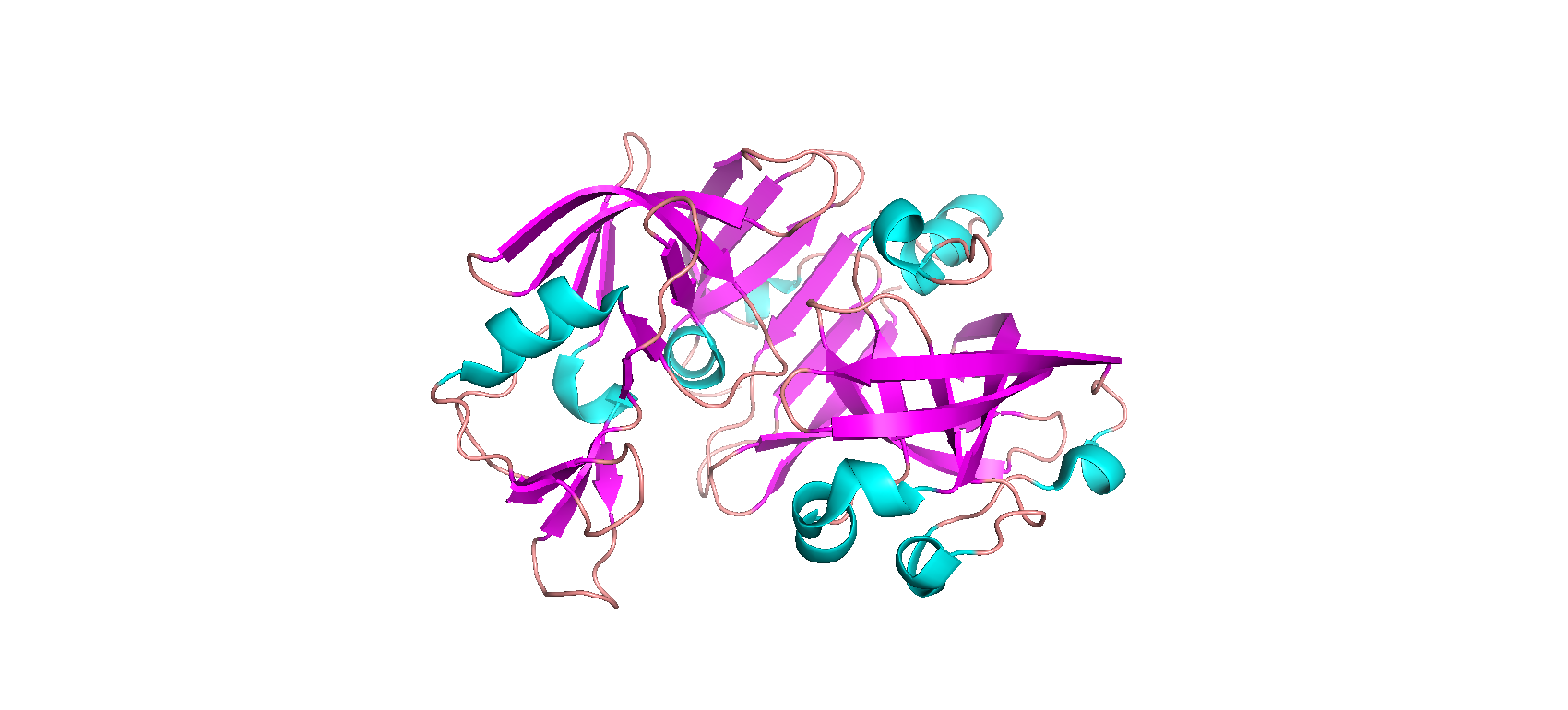
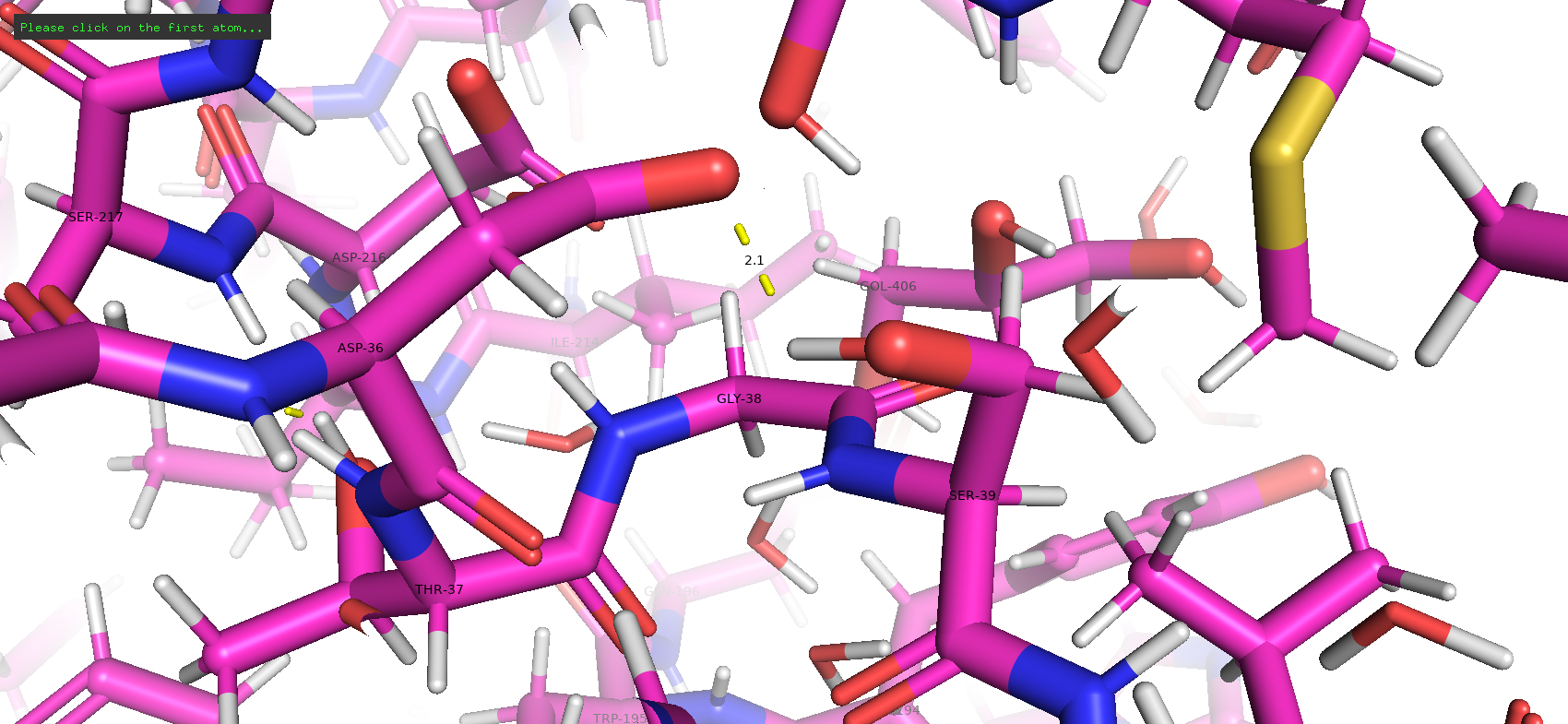
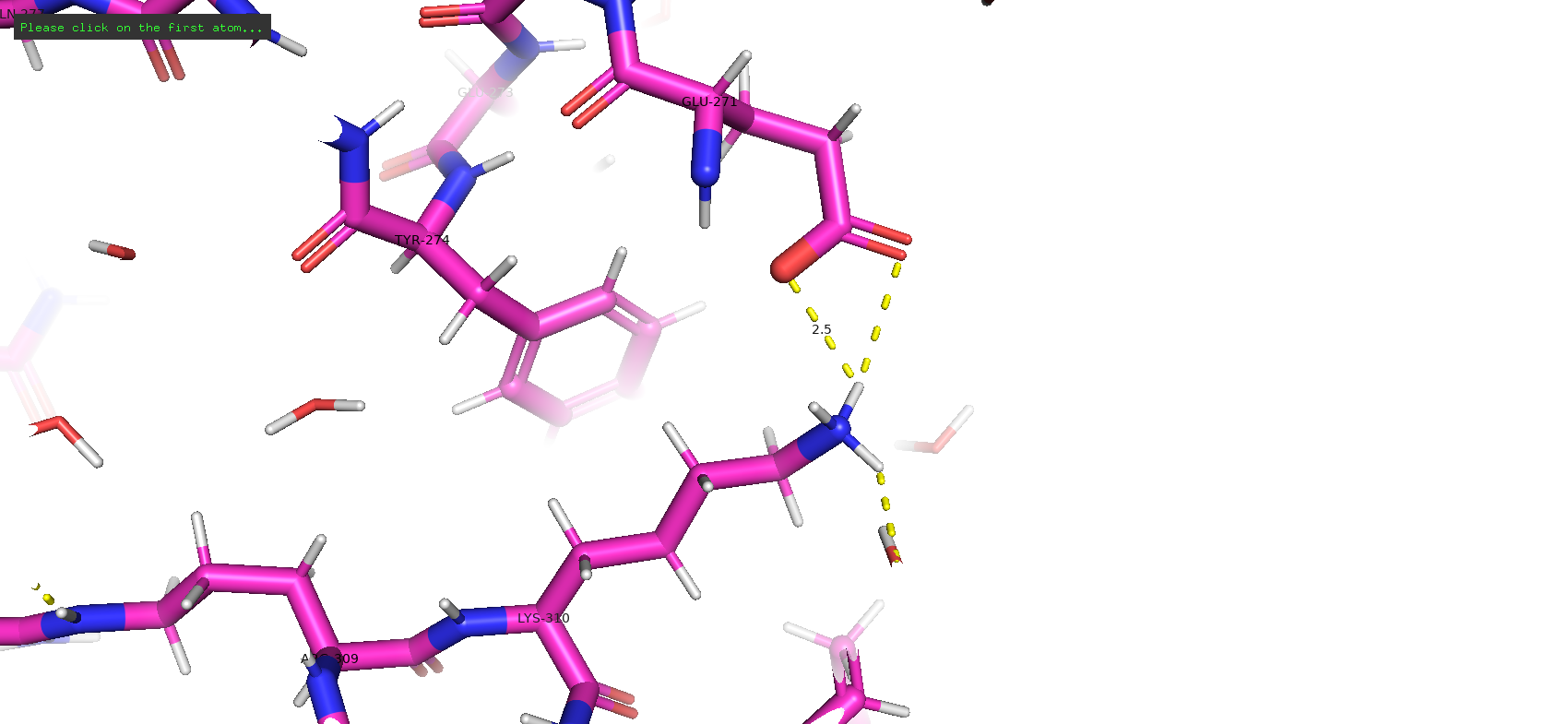
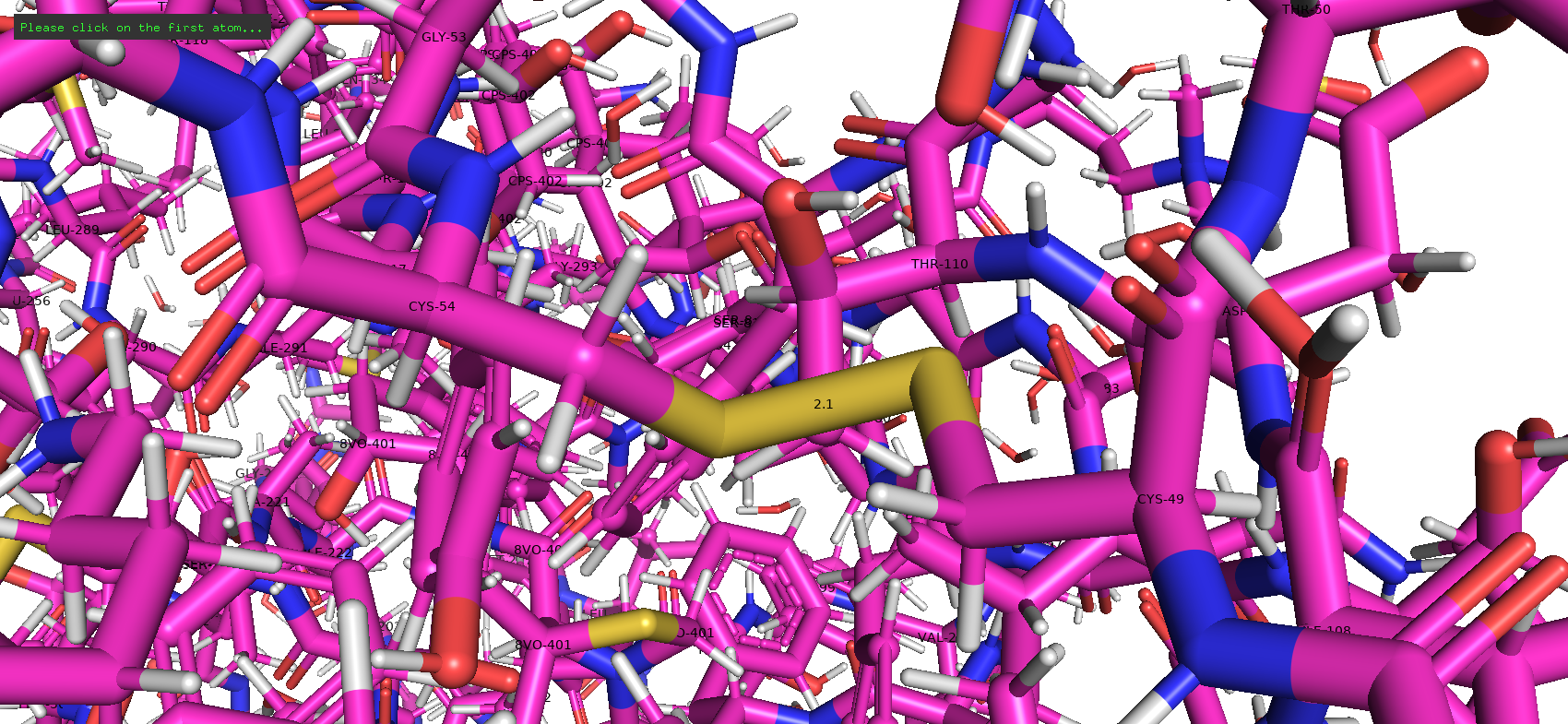
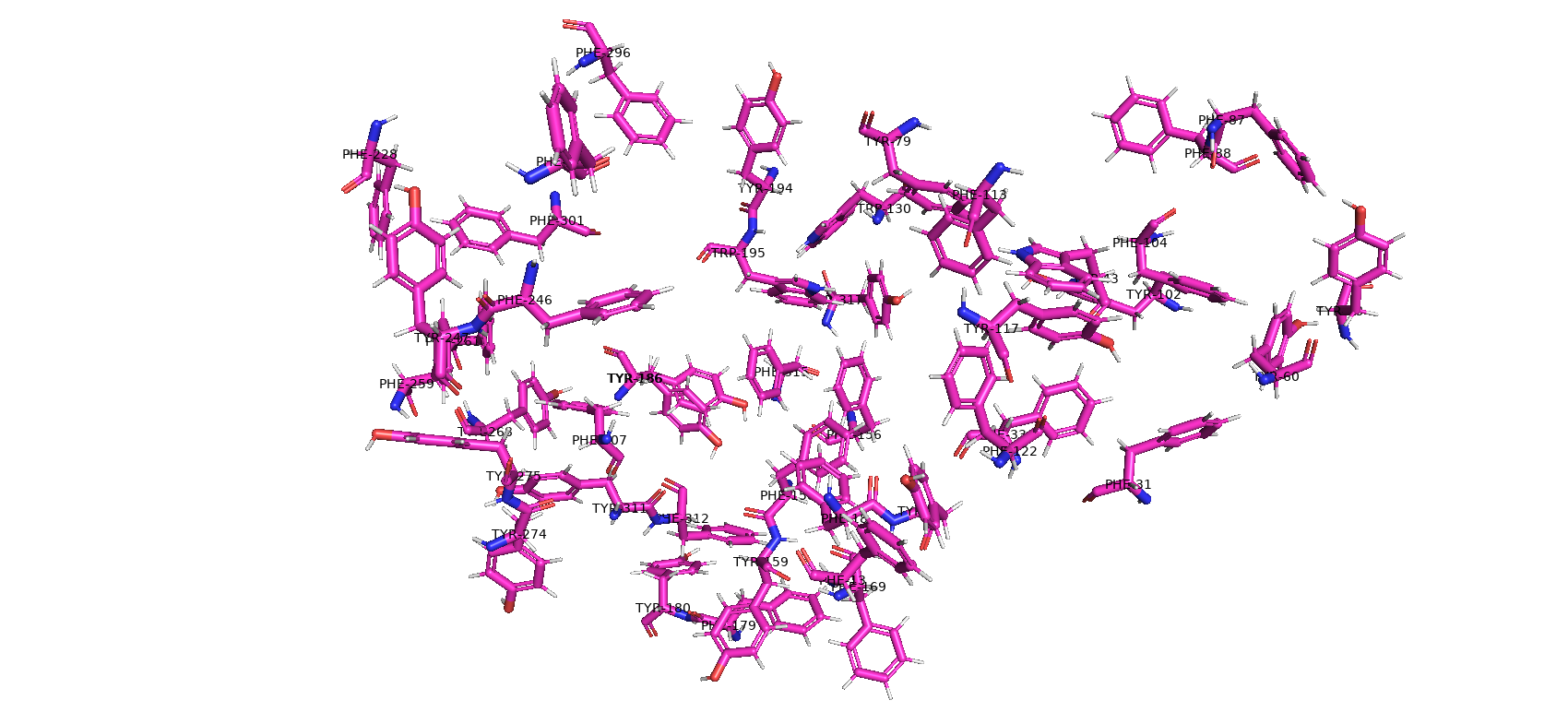
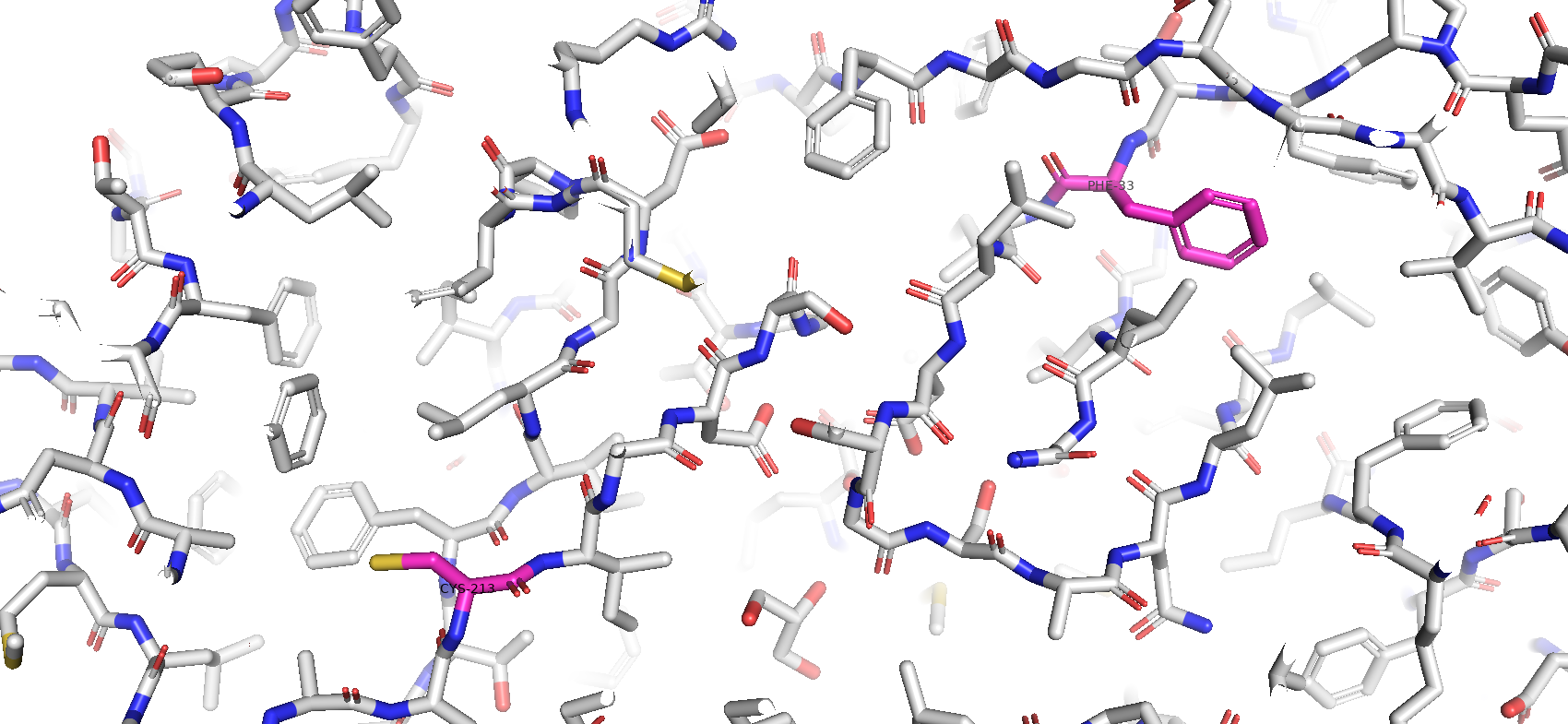
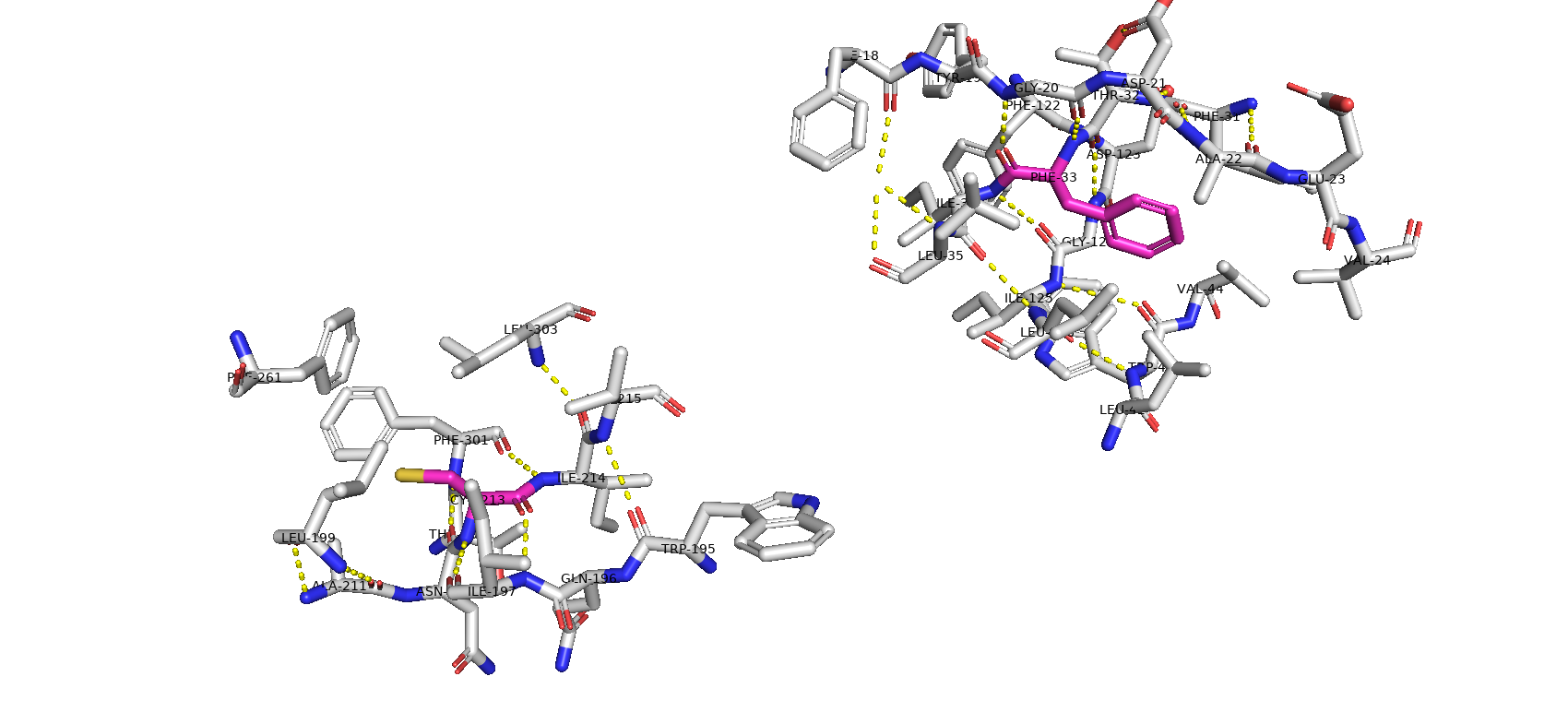
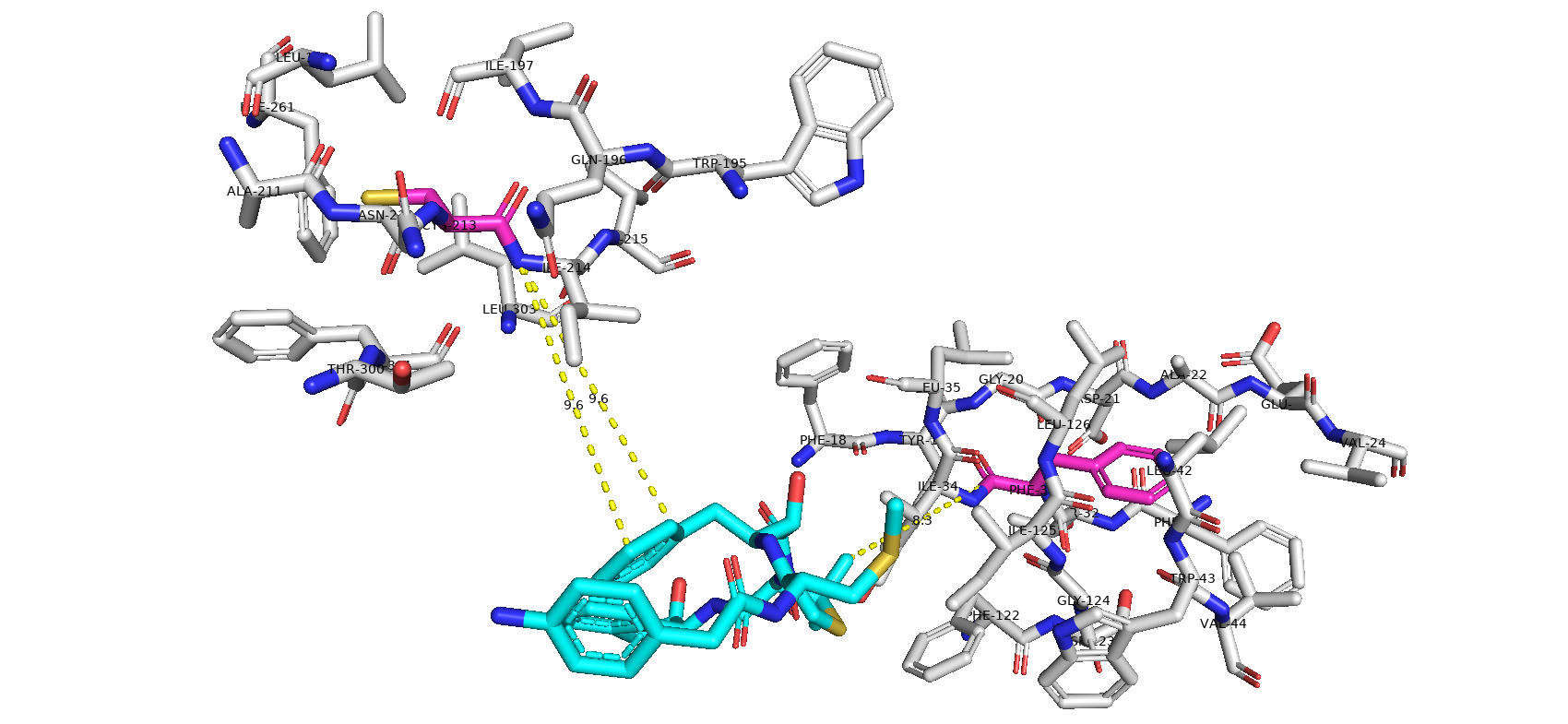
Тип макромолекулы – белок. Плазмепсин II – аспарагиновая протеаза одноклеточного эукариотического паразитического организма Plasmodium falciparum, являющегося возбудителем малярии. Плазмепсин II (PMII) способен расщеплять нативный гемоглобин, но более активен против денатурированного или фрагментированного глобина [1]. Белок состоит из 1 полимерной цепи. Асимметрическая единица совпадает с биологической [2].
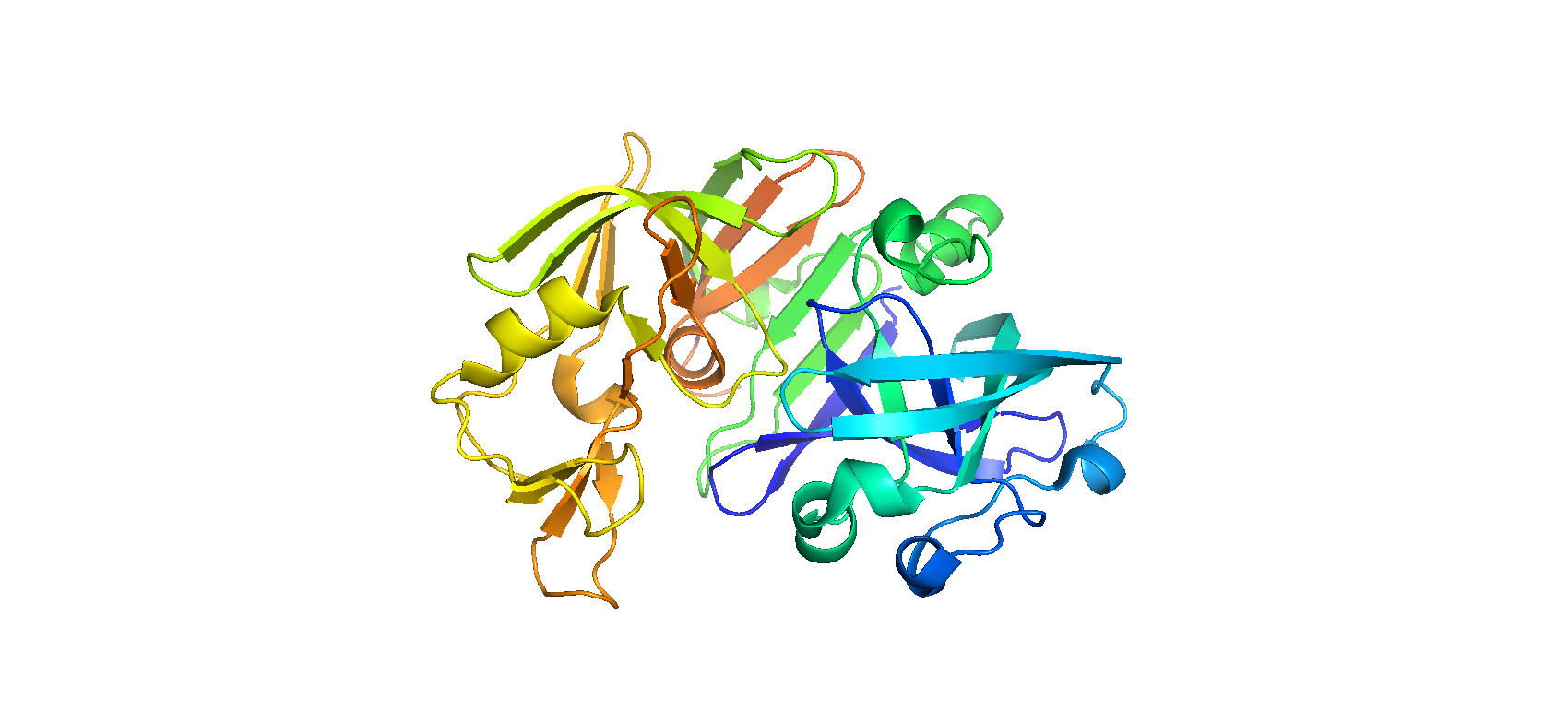
Рис. 1. Общий вид хода остова полимерных цепей