Для выполнения этого практикума я взяла ту же структуру что и в первом практикуме : 4IUL Длины векторов: a = 167.7Å; b = 56.7Å; c = 74.37Å.
Углы между векторами: α = 90.00°; β = 112.05°; γ = 90.00°.
Группа симметрии C121
Число молекул в элементарной ячейке - 2
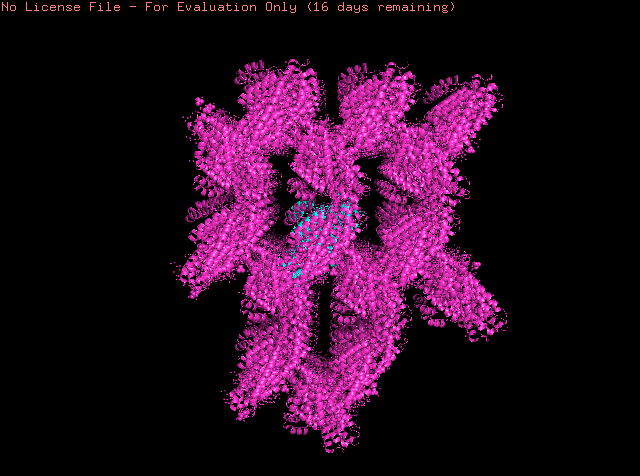
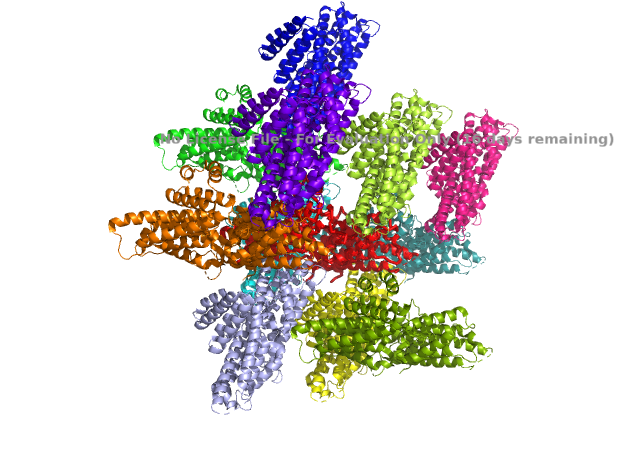
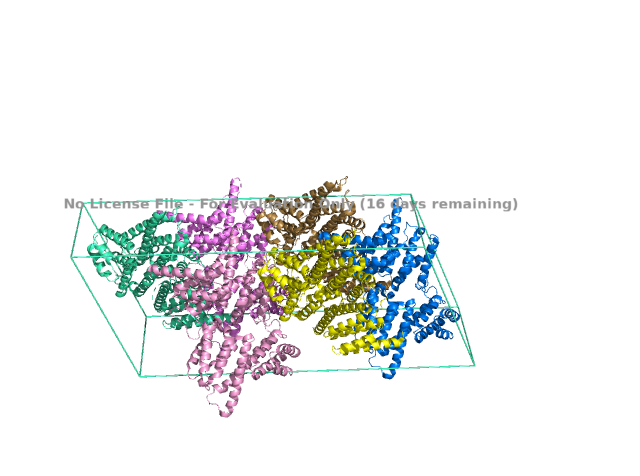
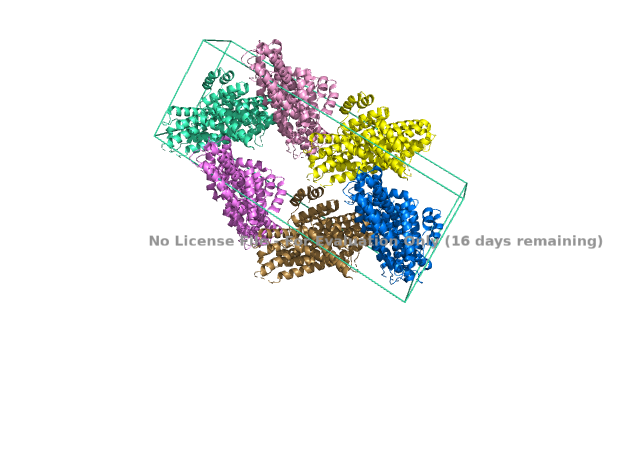
Исследуемый белок является димером. В условиях кристаллизации он может образовать водородные связи с соседними молекулами. Критерием водородной связи будем считать расположение доноров/акцепторов связи разных структур ближе чем 3Å.
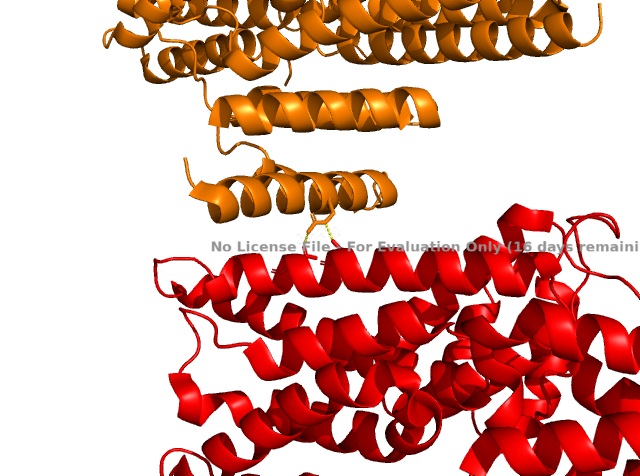
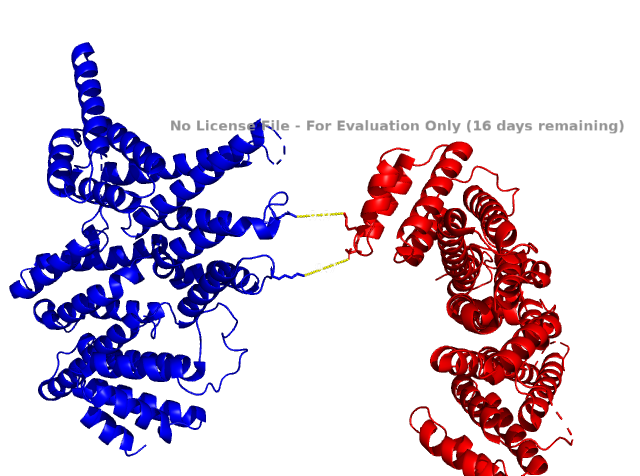
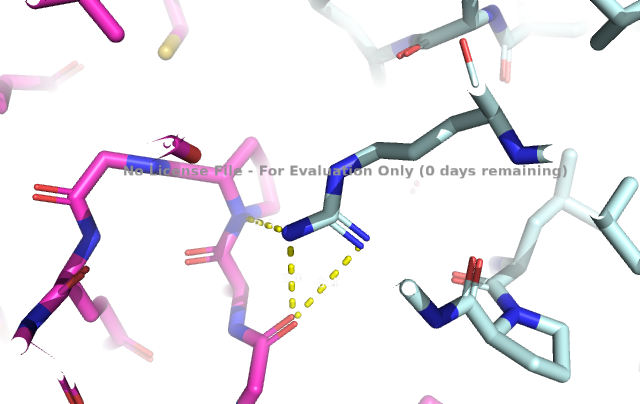
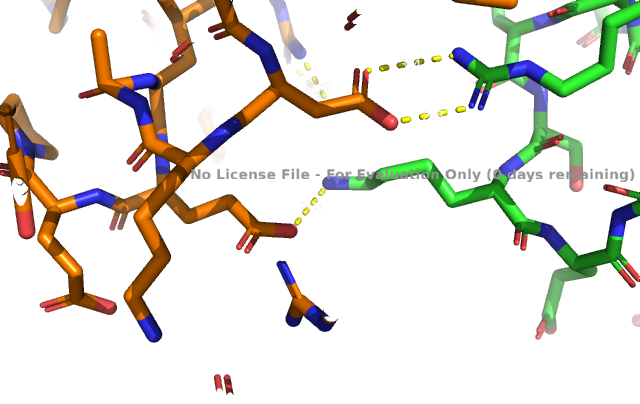
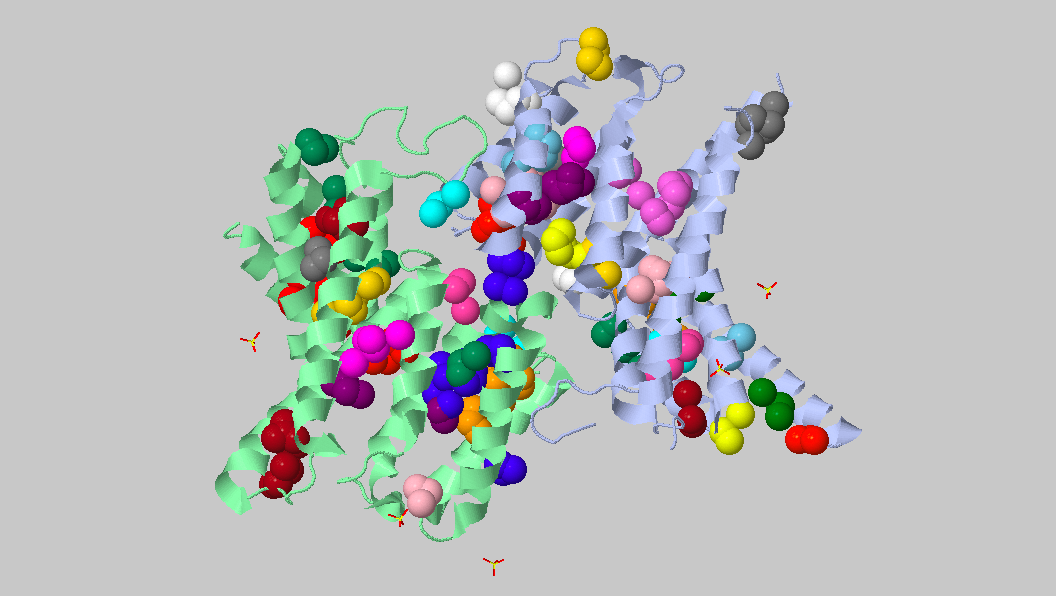
Выше показаны некоторые контакты с соседними молекулами. Помимо водородных связей были найдены солевые мостики. Из приведенных рисунков видно, что контактов между соседними молекулами не так уж много (хоть они и не все представлены на изображениях). К тому же, большинство из них возникают между остатками, экспонированными в растворитель. Скорее всего, они являются артефактом кристаллизации и не отражают природных взаимодействий белков при ди- или олигомеризации. Между молекулами белка могут существовать гидрофобные взаимодействия. Гидрофобные кластеры были идентифицированы в программе Clud. На рисунке 9 представлена их визуализация.
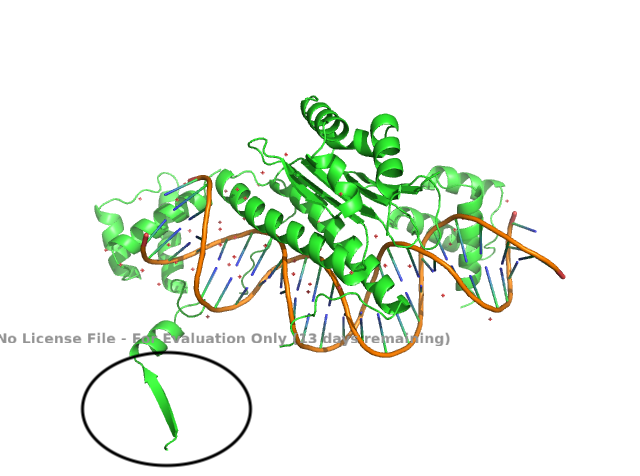
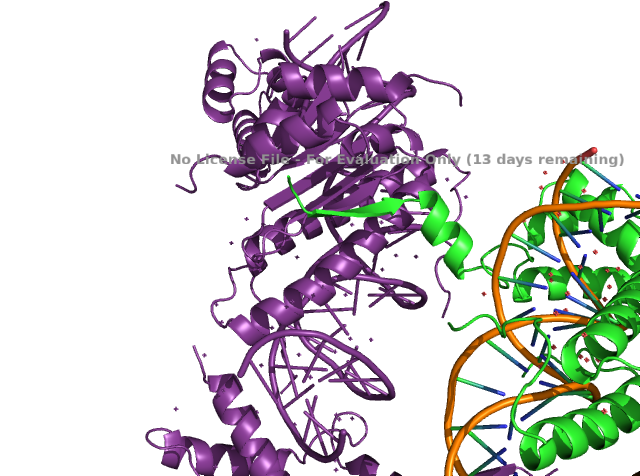
Для этого задания взяли структуру 1mnm (структура дрожжевого транскрипционного фактора). Разрешение 2.25Å. В ассиметрической ячейке содержится несколько цепей белка, связанных с цепочкой ДНК. При этом один β-стренд торчит в пустоту. Он обседен на рисунке 10. При восстановлении содержимого соседних ассиметрических ячеек становится понятно, что этот участок образует β-лист вместе с цепью из соседней ячейки (рисунок 9).