Выбранный путь: Benzoate degradation/Деградация бензоата
В метаболическом пути был выбран фермент EC 1.13.11.8 (protocatechuate 4,5-dioxygenase), который участвует в двух ортологических рядах: protocatechuate 4,5-dioxygenase, alpha chain, K04100 и protocatechuate 4,5-dioxygenase, beta chain и катализирует реакцию окисления кислородом протокатеховой кислоты до 4-карбокси-2-гидроксимуконатовый полуальдегид. Первый содержит 164 белковую последовательность, второй - 191.
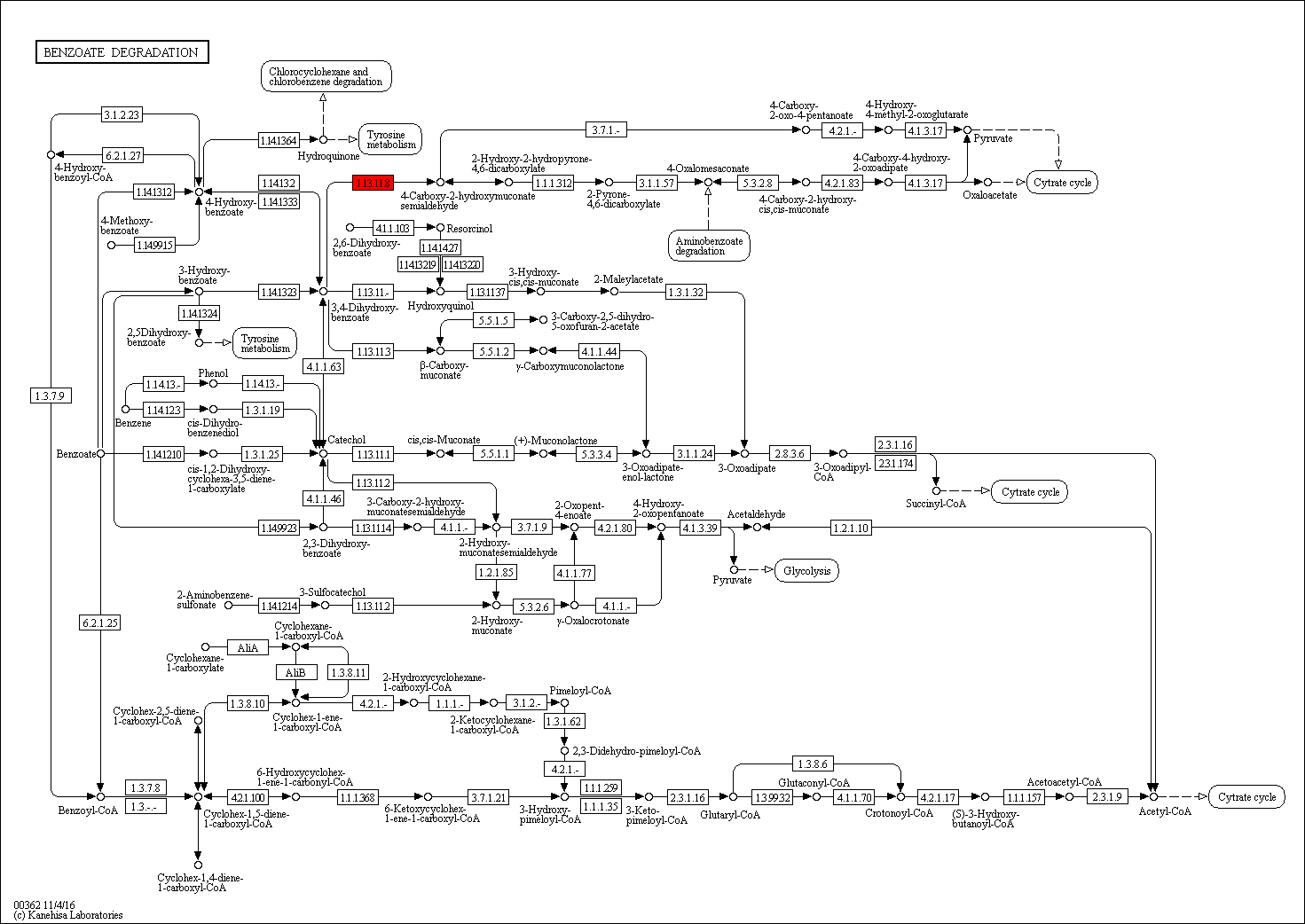 Рис.1. Карта метаболического пути деградации бензоата с отмеченным красным ферментом EC 1.13.11.8
Рис.1. Карта метаболического пути деградации бензоата с отмеченным красным ферментом EC 1.13.11.8
Ссылка на выравнивание в формате fasta
Ссылка на выравнивание в формате Jalview project
Проверка белков на гомологичность
В выравнивании были найдены белки (A0A127EVA9_9RHIZ, A0A0U5ME15_9PROT), плохо выравниваемые со всеми остальными (есть длинные невыровненные фрагменты последовательностей, которые не выравниваются ни с какими другими), а также белок A0A0P1D045_9NEIS, который имеет длинные гэпы на месте консервативных колонок выравнивания. Белки относятся к одному кластеру ортологичных генов K04101. Они удалены из выравнивания.
Получившееся выравнивание оказалось весьма неоднородным. Во-первых, явное разделение есть между рядами ортологичных генов по длине (длины последовательностей первого ортологичного ряда находятся, за единственным исключением, в диапазоне от 90 до 160, у второго - от 270 до 320). В целом, во всем выравнивании максимально общими являются колонки малых гидрофобных аминокислот (в раскраске ClustalX отмечены голубым цветов. Меньшим уровнем общности, но все равно распространенные у более чем половины белков, обладают колонки отрицательно заряженных аминокислот, а также колонки глицина. Перечисленные колонки могут задавать структуру олигомера за счет гидрофобных и электростатических взаимодействий, а также за счет изгиба остатком глицина.
MEGA Neighbour-Joining не может построить деревья, мотивируя это тем, что невозможно определить эволюционную дистанцию между некоторыми последовательностями, например, теми, которые находятся в разных кластерах. Это легко объяснить, так как реакция катализируется объединением альфа и бета цепей в олигомер, содержащих по 12 копий каждый. Таким образом, можно предположить, что обе цепи не являются гомологичными и формировались независимо.