Для выполнения задания снова была использована структура 1vi9 (два гомодимера в асимметрической ячейке).
Так как в структуре два одинаковых гомодимера логичнее будет выполнить задание для одного из гомодимеров (цепи А+В).
Меняя параметры порог расстояния и порог размера кластера, будем соответственно интерпретировать полученный результат.
Порог 5.4 Ангстрем, минимальное число атомов 3. Найденные кластеры: 1162+6+5+4+4+3 =>
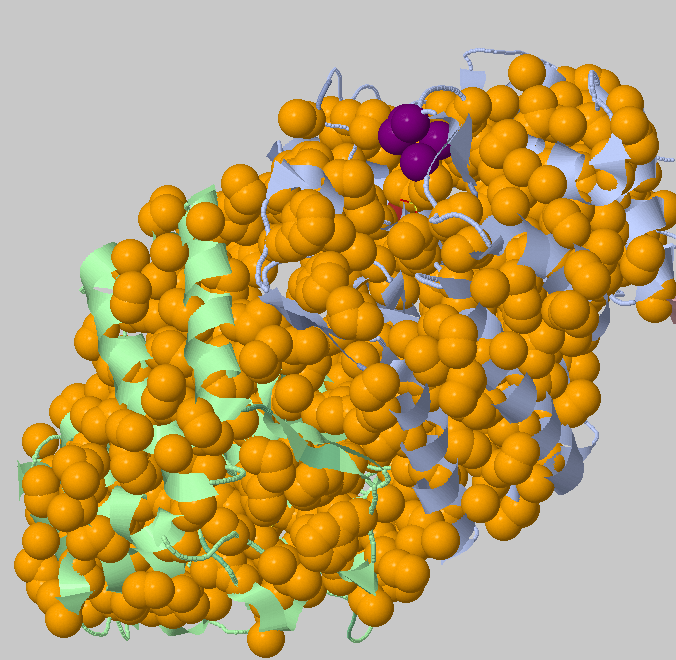
Предсказался один большой гидрофобный кластер на весь белок и несколько кластеров размером поменьше.
Фактически мы получили доказательство утверждения, что белок как правило удерживает свою укладку гидрофобными контактами.
Порог 4.4 Ангстрем, 10 атомов 10. Найденные кластеры: 212+204+93+48+47+34+30+29+15+13+12+12+10+10 =>
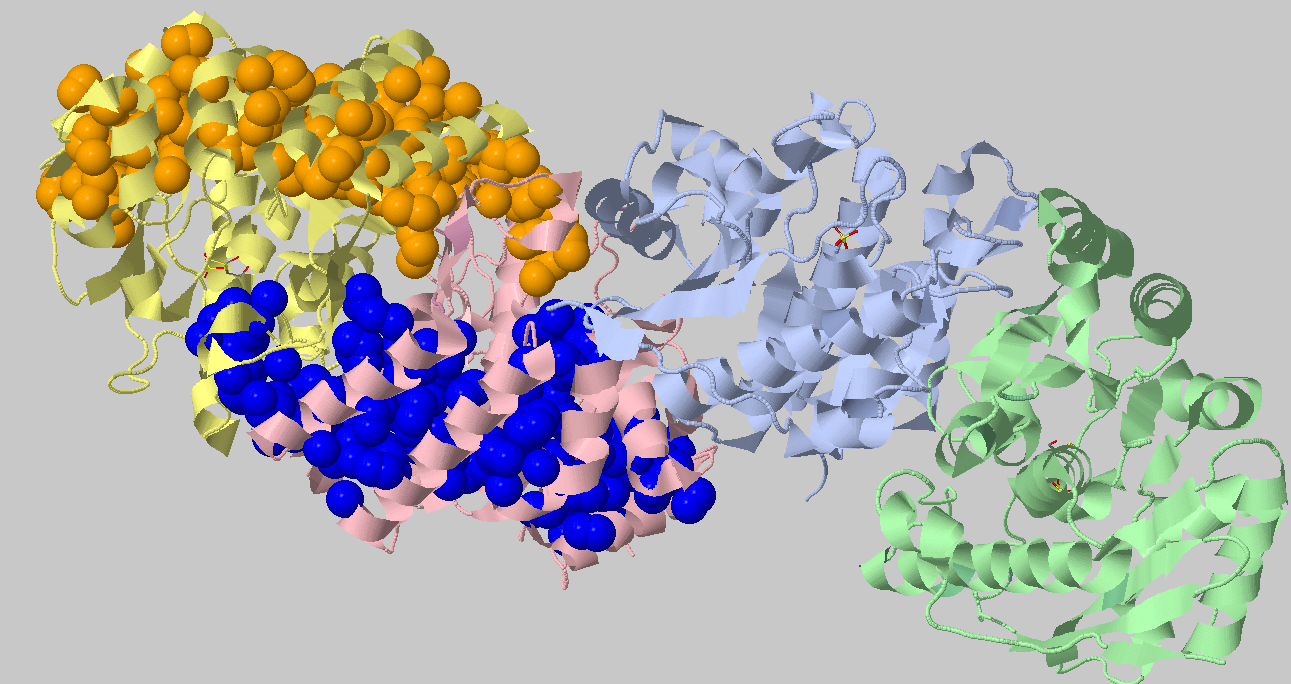
С такими порогами отыскались интересные крупные кластеры в каждой субъединице (синий и оранжевый) и кластеры более мелкого размера,
поддерживающие оставшиеся элементы третичной структуры. Это иллюстрирует утверждение, которое м знаем из механизмов ферментативной
кинетики, что фермент, как правило, имеет жесткую часть и более подвижные части для катализа.
Порог 4 Ангстрем, 10 атомов. Найденные кластеры: 25+16+15+15+14+13+13+13+10+10 =>
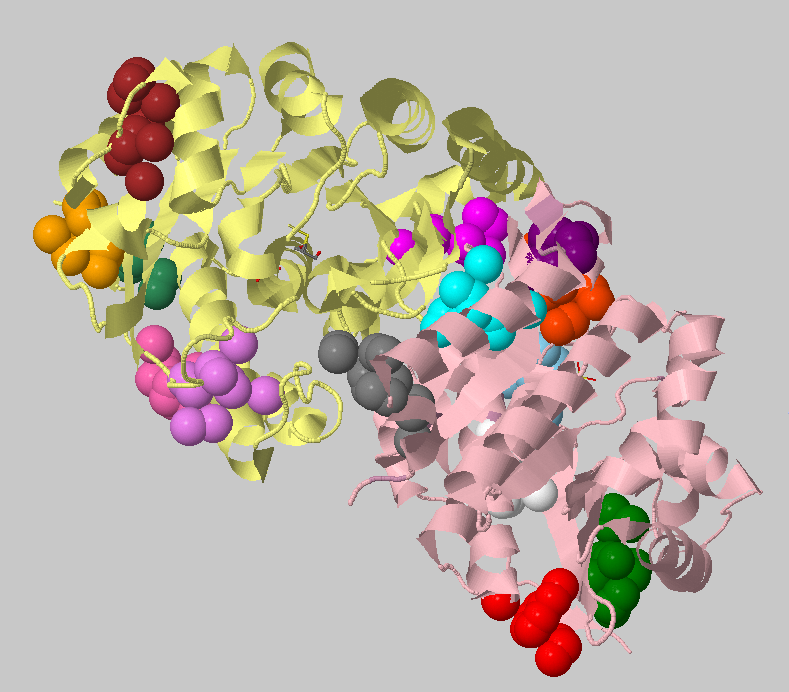
Можно заметить, что кластеры распределились по структуре неравномерно, причем самые крупные из них расположились близко к области контакта,
но все же между субъединицами контакт там не очень хорош.
Порог 3.5 Ангстрема, 3 атома. Найденные кластеры: 4+4+4+4+4+3+3+3 =>
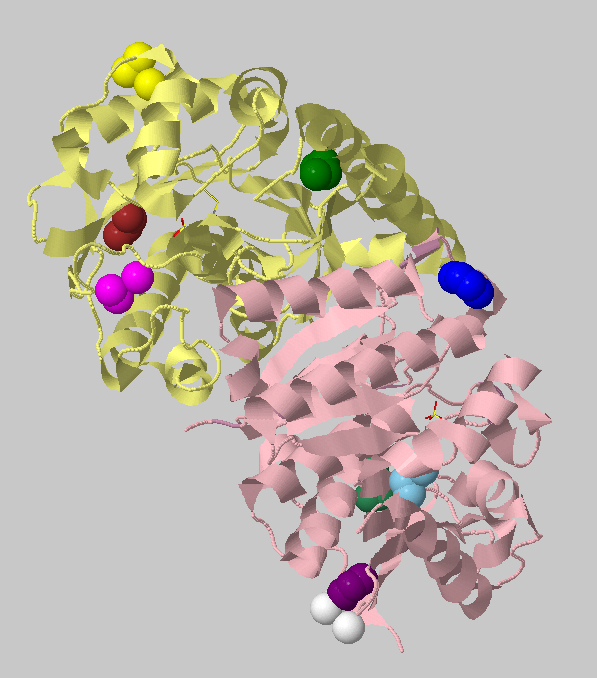
Исходя из полученных данных можем определить более прочные и более гидрофильные участки белка 1vi9, пиридоксаминкиназы.
Данный фермент взаимодействует с АТФ и пиридоксалем, причем именно с той стороны, где гидрофобный кластер менее прочный.
Кроме того можно предположить гидрофобный характер взаимодействий в области межсубъединичных контактов. Проверим это:
Порог 5.4 Ангстрема, минимальное число атомов 3. Найденные кластеры: 50+50+21+3+3 =>
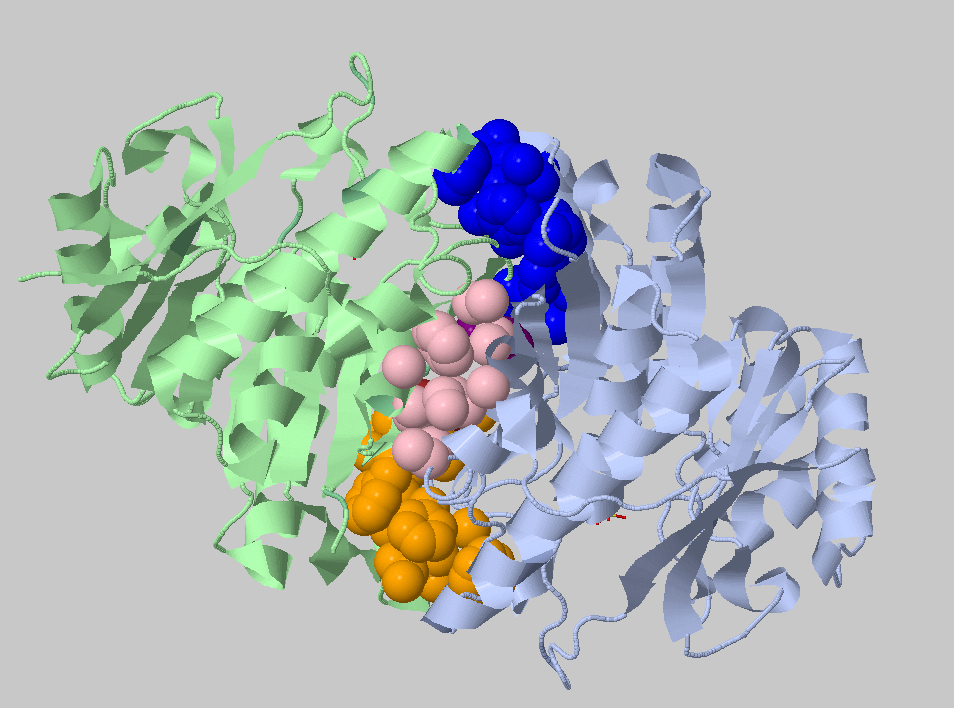
Видно, что есть крупные межсубъдничные гидрофобные контакты на периферии, в центре белка контакты поменьше.
Порог 4 Ангстрема, 3 атома. Найденные кластеры: 11+10+9+8+5+4+4+3=>

Самые прочные кластеры на периферии. При задании порога в 3.5 Ангстрем кластеров вообще нет, следовательно, контакты между субъединицами слабее контактов внутри них.
По итогам анализа межъсубединичных гидрофобных контактов белка 1vi9 предположили,
что гидрофобные контакты играют большую роль в связывании субъединиц.
При этом наиболее прочные контакты формируются по краям субъединиц, оставляя в центре место для довольно слабых взаимодействий.