Для работы из таблицы был выбран белок рибонуклеазы T1.
Он представляет собой мономер, длина белковой цепи 104 аминокислотных остатка. Характеристики:
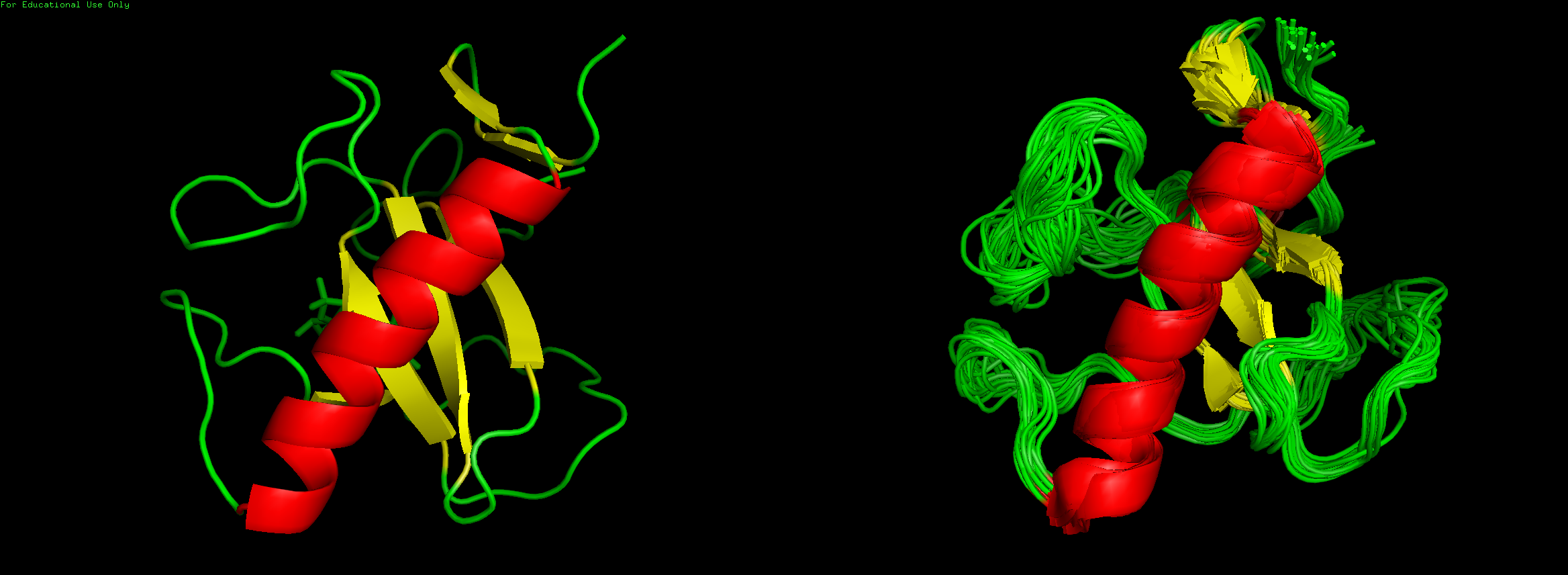
РСА-модель: PDB 1BU4 с разрешением в 1.9 ангрстем;
ЯМР-модель: 1IYY, число моделей 24.
Как видно из рисунка ниже, укладки структур крайне сходны:
Далее в структурах были выбраны три водородные связи:
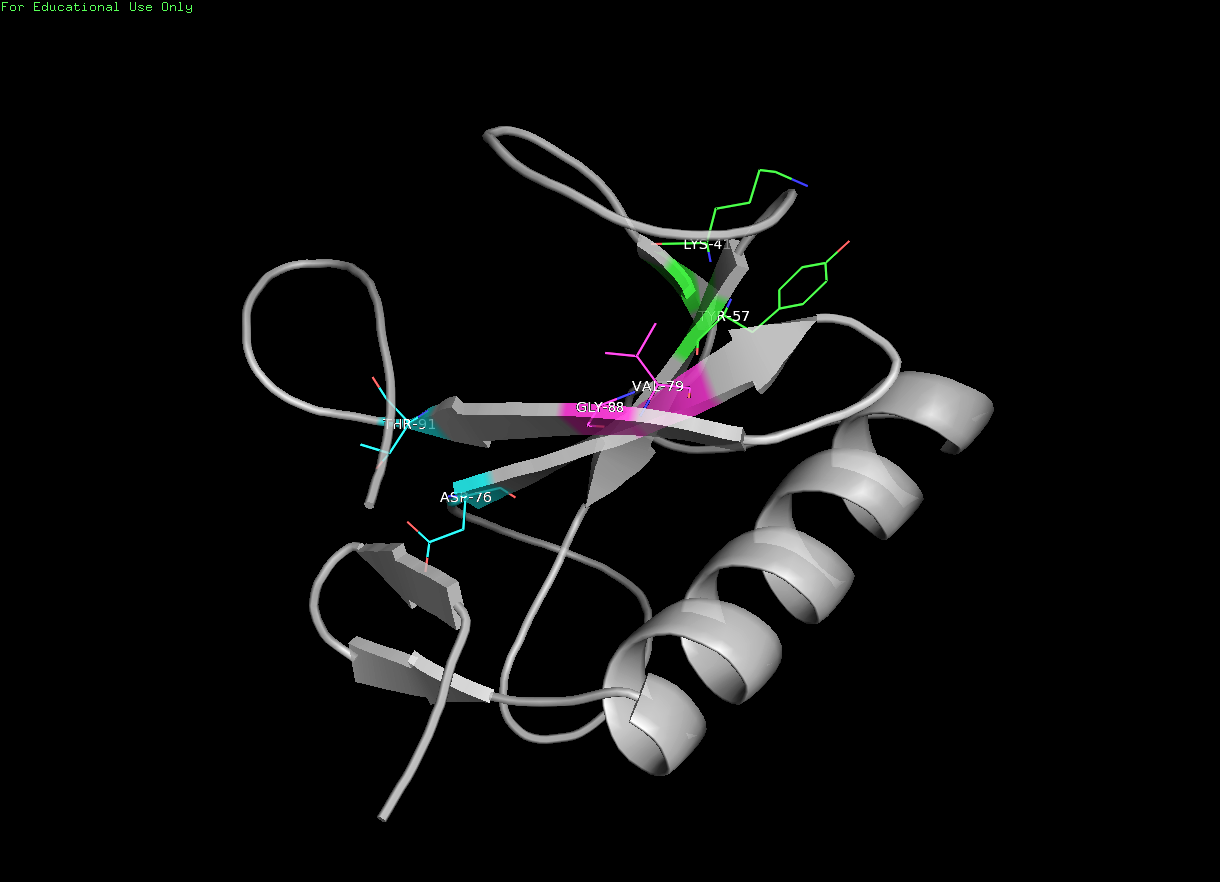
Остатки Lys41 и Tyr57 обозначены зеленым, Thr91 и Asp76 -голубым, а Val79 и Gly88 розовым.
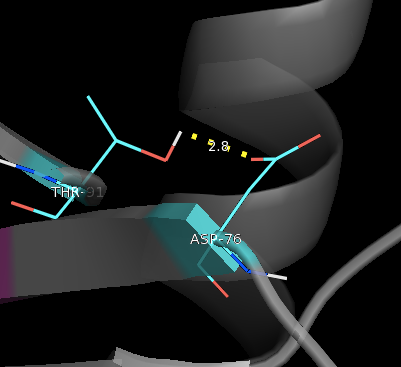
Водородная связь между боковыми цепями Thr91 и Asp76 образована атомом кислорода Asp76 и атомом водорода Thr91.
Оба остатка располагаются внутри глобулы белка на участках, обозначенных как участки без четкой вторичной структуры, сразу после бета-тяжей.
А водородная связь между Lys41 и Tyr57 образована одним из атомов водорода концевой групы лизина и атомом кислорода -OH группы боковой цепи тирозина.
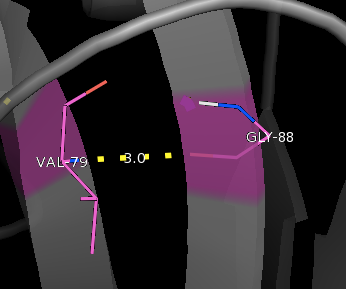
Остатки располагаются на поверхности глобулы на неструктурированных участках. Остатки Val79 и Gly88 находятся в бета-листе.
Кислород пептидной связи Gly88 образует характерную для бета-листа во-дородную связь с водородом -NH- Val79, который тоже участвует в образовании пептидной связи.
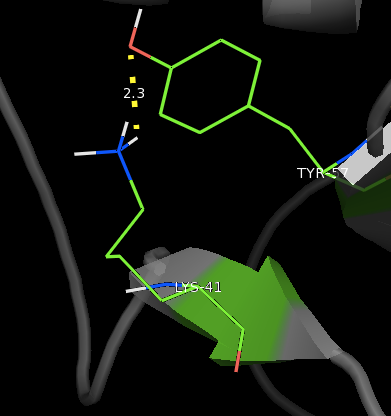
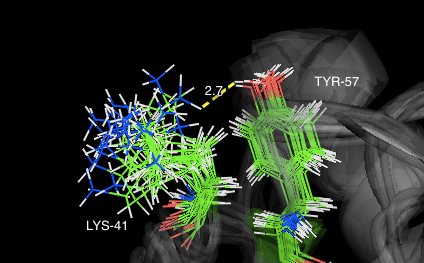
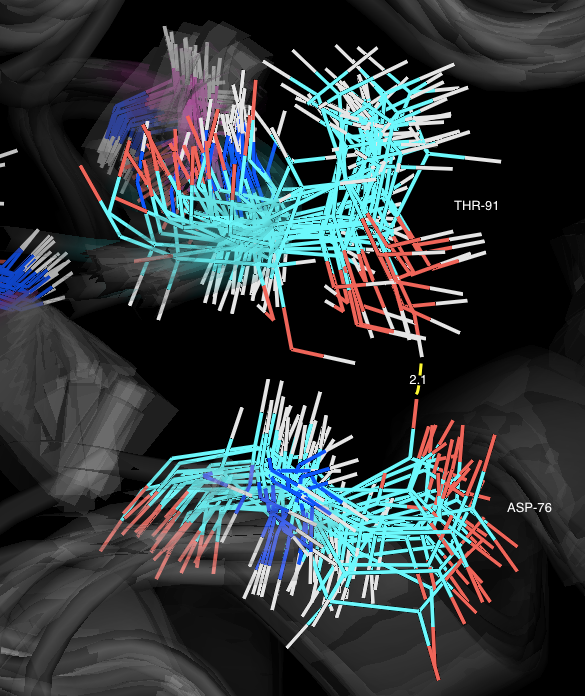
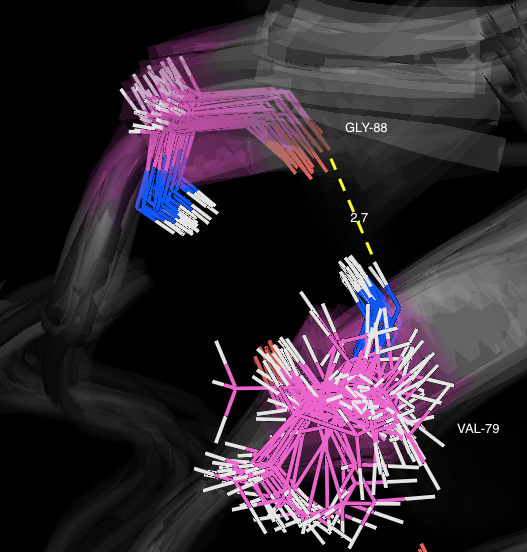
Ниже показаны связи между остатками в модели 1BU4, полученной методом РСА, и изображения для минимальных и максимальных значений длин этих связей в моделях
структуры 1IYY, полученной методом ЯМР, соответственно.
Lys41 и Tyr57:
Thr91 и Asp76:
Val79 и Gly88:
Итоговые результаты измерений приведены в табличке ниже:
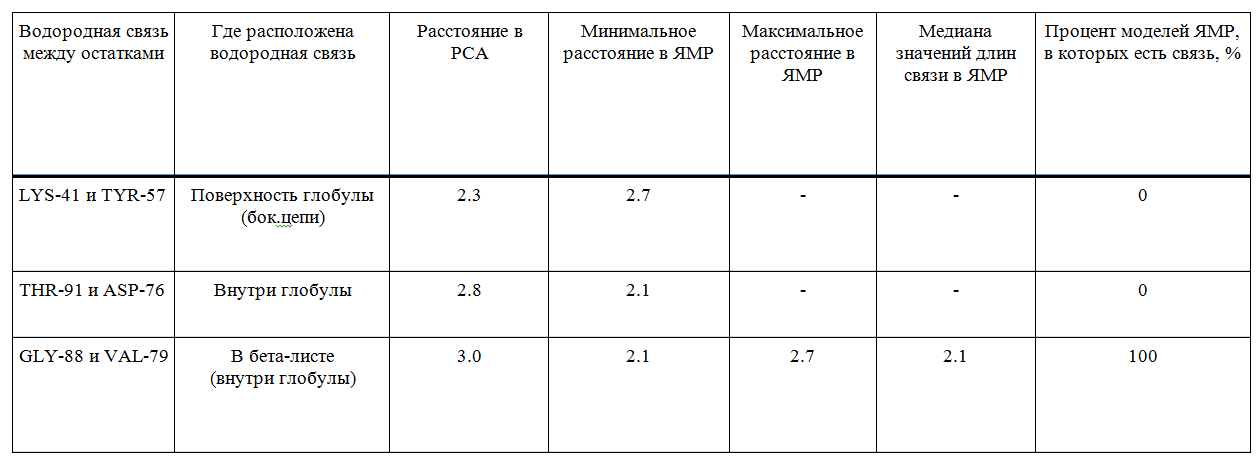
Водородная связь, обнаруженная на поверхности глобулы в структуре 1BU4, полученной методом РСА,
не сохраняется в растворе (в структуре 1IYY, полученной методом ЯМР). Возможно, это связано с тем,
что боковые радикалы и остов полипептидной цепи в растворе более подвижны и при кристаллизации белок принимает определенную структуру.
В свою очередь связь в бета-листе сохраняется во всех моделях, полученных методами и ЯМР и РСА.