Внутримолекулярные взаимодействия в структуре гипотетического белка (идентификатор 2cx1)
Остовные водородные связи
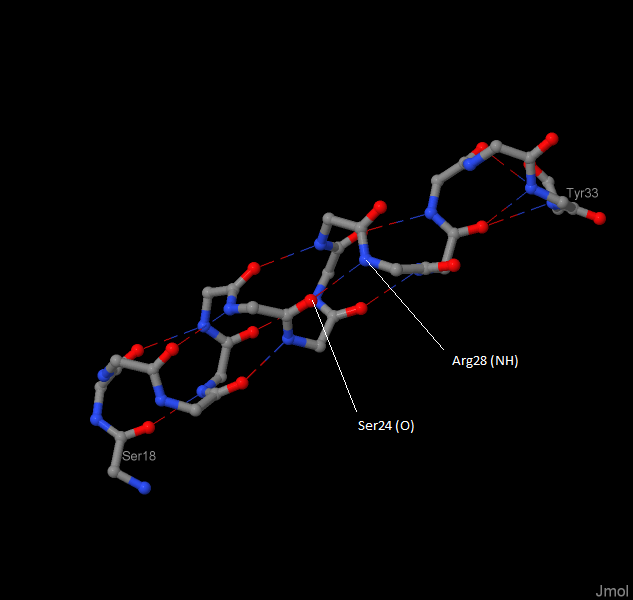
Рассмотрим α-спираль белка, концевые аминокислотные остатки которой — серин под номером 18 и тирозин 33. Такая спиральная вторичная структура белка держится засчет водородных связей. Их можно увидеть на рисунке 1. Такие связи образуются засчет того, что атом водорода обобществялется между двумя электроотрицательными элементами: азотом и кислородом главной (остовной) цепи. В рассмотренном случае донор — атом N аргинина 28, акцептор — атом О серина 24.
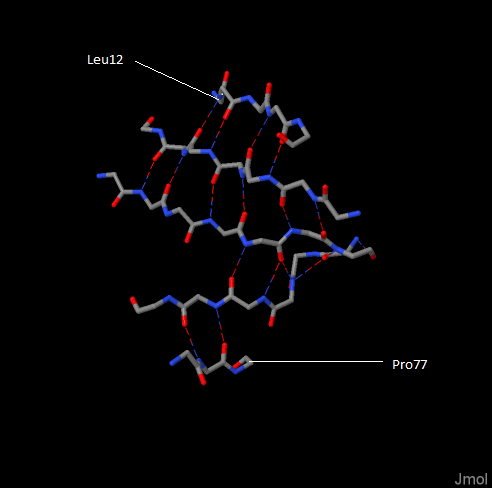
Конформация β-листов также поддерживается водородными связями: они связывают тяжи структуры. На примере, рассмотренном на рисунке 2, пять тяжей, которые слегка закручены. Полипептидные цепи в составе β-листов здесь направлены N-концами в противоположные стороны (антипараллельная β-структура). Водородная связь образуется аналогично между карбонильной и аминогруппой двух аминокислотных остатков.
Шаг α-спирали Ser18 — Tyr33
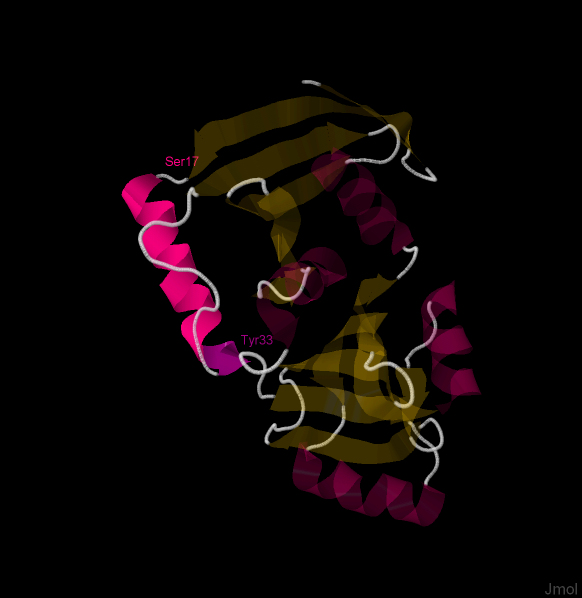
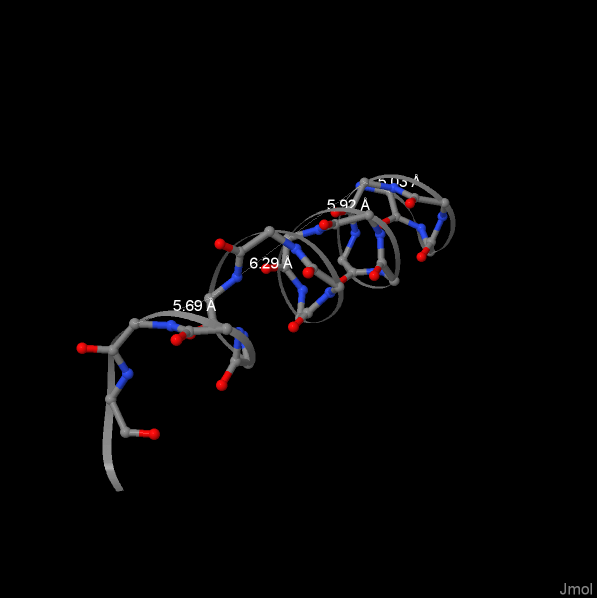
Рассмотрим α-спираль Ser18 — Tyr33. Она ярко выделена в целой структуре на рисунке 3. Чтобы найти шаг спирали, следует провести параллельную оси спирали прямую (или несколько прямых) через атомы, положение которых примерно совпадает при повороте на 360°. На рисунке 4 показаны остовные атомы спирали; она состоит из четырех витков. Шаг спирали (5.69+6.29+5.92+6.03)/4 = 6 ангстрем. Число остатков на один виток (4+5+5+4)/4 = 4.5.
Внутримолекулярные взаимодействия боковых цепей
Рассмотрим взаимодействия между боковыми цепями, то есть радикалами аминокислотных остатков в составе белка.
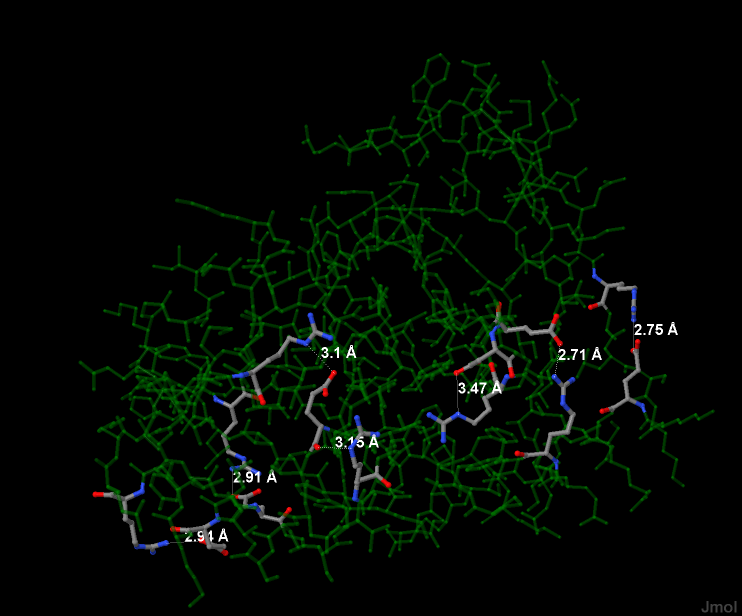
Солевые мостики — полярная донорно-акцепторная связь между карбоксильной и аминогруппой, также отвечающая за конформационную устойчивость белка. На рисунке 5 показаны все мостики; их семь. Для их выделения использована команда Jmol:
select within (GROUP, within (3.5, hbpositive) and hbnegative) or within (GROUP, within (3.5, hbnegative) and hbpositive)
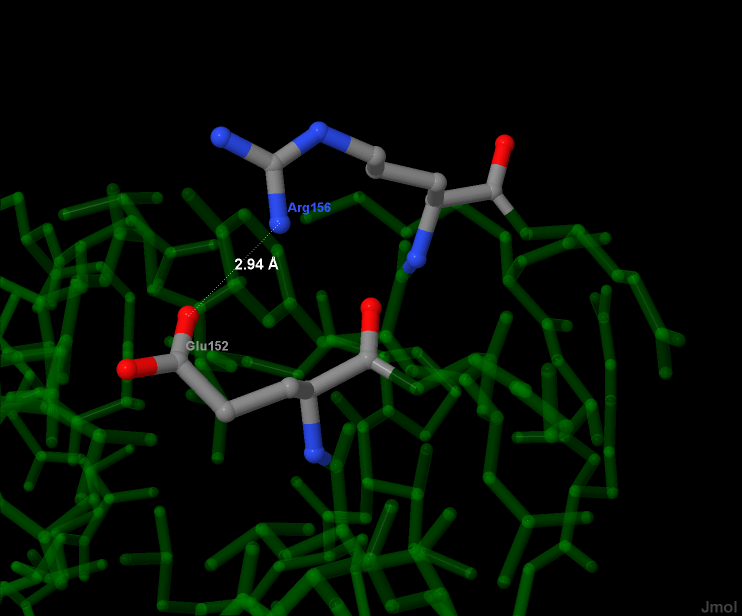
hbpositive и hbnegative — множества положительно и отрицательно заряженных радикалов соотвественно, которые заданы в скрипте atom-types.spt. Один солевой мостик между аргинином и глутаматом продемонстрирован на рисунке 6. Расстояние между донором и акцептором водорода — 2,94 ангстрем.
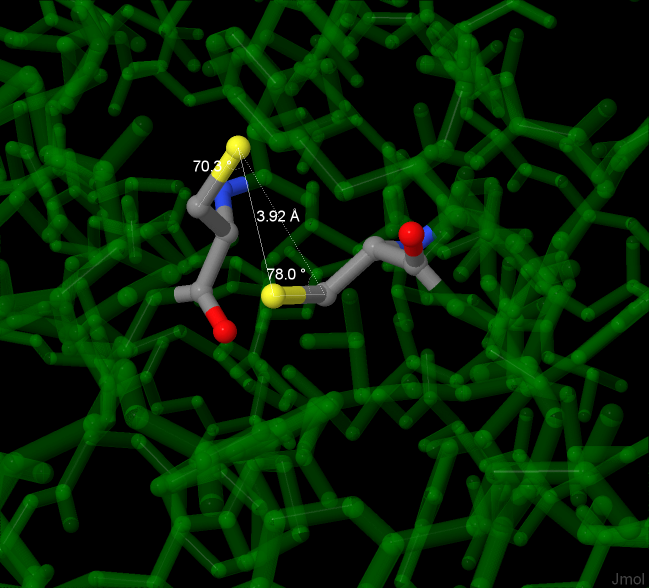
В структуре есть один дисульфидный мостик — связь между атомами серы в двух цистеинах. На рисунке 7 представлено такое S-S взаимодействие, обозначена длина и углы, характеризующие связь.
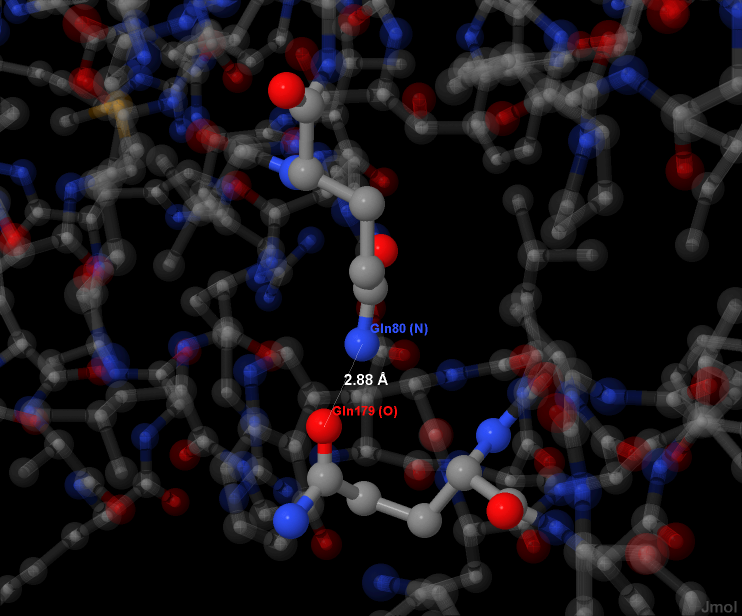
Водородная связь, не являющаяся солевым мостиком, представлена на рисунке 8. Взаимодействуют концевые атомы двух глутаминов; донор водорода — NH (NH2) группа, акцептор — кислород.
Гидрофобные взаимодействия в белке
S и C атомы гидрофобных остатков (такие как Phe, Trp, Ala и другие), не связанные с полярными группами, выделены на рисунке 9. Засчет взаимного отталкивания групп также поддерживается конформация белка. Отдельных кластеров выделить не удалось.
