Мембранные белки
Анализ множественного выравнивания
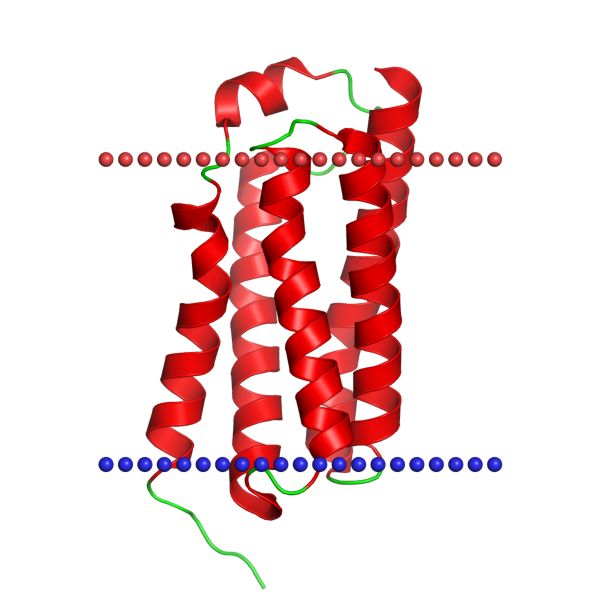
В этом практикуме рассматривали белок с идентификатором в PDB 4rym. Это белок-транслокатор бактерии Bacillus cereus штамма ATCC 14579.
Для множественного выравнивания выбрали с помощью BLAST 22 белка: 10 из бактерий, 6 из архей, 6 из эукариот. Выровняли последовательности алгоритмом Muscle. Файл с выравниванием
Результаты работы TMHMM для одного из гомологов белка 4rym:
# gi|564799100|ref|WP_023858526.1| Length: 132 # gi|564799100|ref|WP_023858526.1| Number of predicted TMHs: 4 # gi|564799100|ref|WP_023858526.1| Exp number of AAs in TMHs: 88.98864 # gi|564799100|ref|WP_023858526.1| Exp number, first 60 AAs: 31.86578 # gi|564799100|ref|WP_023858526.1| Total prob of N-in: 0.06387 # gi|564799100|ref|WP_023858526.1| POSSIBLE N-term signal sequence gi|564799100|ref|WP_023858526.1| TMHMM2.0 outside 1 22 gi|564799100|ref|WP_023858526.1| TMHMM2.0 TMhelix 23 45 gi|564799100|ref|WP_023858526.1| TMHMM2.0 inside 46 51 gi|564799100|ref|WP_023858526.1| TMHMM2.0 TMhelix 52 74 gi|564799100|ref|WP_023858526.1| TMHMM2.0 outside 75 78 gi|564799100|ref|WP_023858526.1| TMHMM2.0 TMhelix 79 101 gi|564799100|ref|WP_023858526.1| TMHMM2.0 inside 102 107 gi|564799100|ref|WP_023858526.1| TMHMM2.0 TMhelix 108 130 gi|564799100|ref|WP_023858526.1| TMHMM2.0 outside 131 132
Белок раскрасили по гидрофобности (рис. 3). Проект в Jalview, где выравнивание соотнесено с реальной структурой (TM_REAL) и предсказанной (TM_PREDICTED), доступен по ссылке.
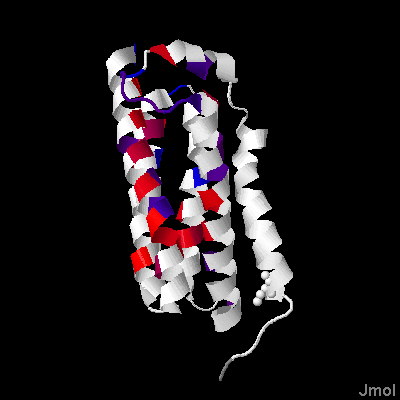
Участки трансмембранных доменов достаточно консервативны среди белков из выборки гомологов. Только один трансмембранный альфа-спиральный участок имеется только в белке 4rym — этот белок длиннее своих гомологов. В этих участках встречаются гидрофобные аминокислоты: много триптофана, лейцина, пролина, фенилаланина. Участки между спиралями имеют меньшую консервативность. В них присутствует довольно много аргинина, лизина и гистидина - положительно заряженных аминокислот.
Предсказание TMHMM и трансмембранные участки из базы OPM в основном совпадают (с точностью в 2-3 аминокислоты). Но есть и расхождения. Во-первых, в реальной структуре есть две трансмембранные спирали в начале последовательности, которых не предсказал TMHMM. Это произошло опять же из-за того, что 4rym длиннее своих гомологов. Во-вторых, предсказан один участок, которого нет в OPM. Он консервативный и гидрофобный, вполне похож на трансмембранную спираль (рис. 4, 5).