Интерпретация ЯМР структуры
Сокращения:
РСА — ренген-структурный анализ
ЯМР — ядерный магнитный резонанс
Крупные белки мочи (major mouse urinary proteins) экспрессируются и секретируются только у созревших мышей мужского пола и играют роль в репродуктивном цикле мышей, действуя как феромоны (PMID: 10583419).
1JV4 — структура, расшифрованная методом РСА, с разрешением 1.75 Å.
1DF3 — структура того же белка, полученная методом ЯМР. Имеет 10 моделей.
Рассмотрели три водородные связи разного характера в ЯМР- и РСА-структуре. Длину водородной связи считали меньше 3.5 Å, также проверяли, что водород лежит на прямой между донором или акцептором с отклонением 70 градусов. Результаты описаны в таблице 1. В последних трех столбцах указаны соответствующие значения в 10 моделях ЯМР-структуры.
Таблица 1. Сравнение нескольких водородных связей в 1JV4 и 1DF3.
| Связь (характер остатков) | РСА (Å) | ЯМР (Å) | min(ЯМР) (Å) | maх(ЯМР) (Å) | медиана(ЯМР) (Å) |
|---|---|---|---|---|---|
| Ala103/O-Gly118/N (внутри, бета-лист) | 3,0 | 100% | 3,0 | 3,2 | 3,1 |
| Asn88/OD1-Asn107/ND2 (внутри, бета-лист) | 2,9 | 30% | 3,0 | 5,8 | 4,5 |
| Ser4/OG-Thr6/N (снаружи, петля) | 3,4 | 0% | 5,7 | 6,5 | 6,3 |
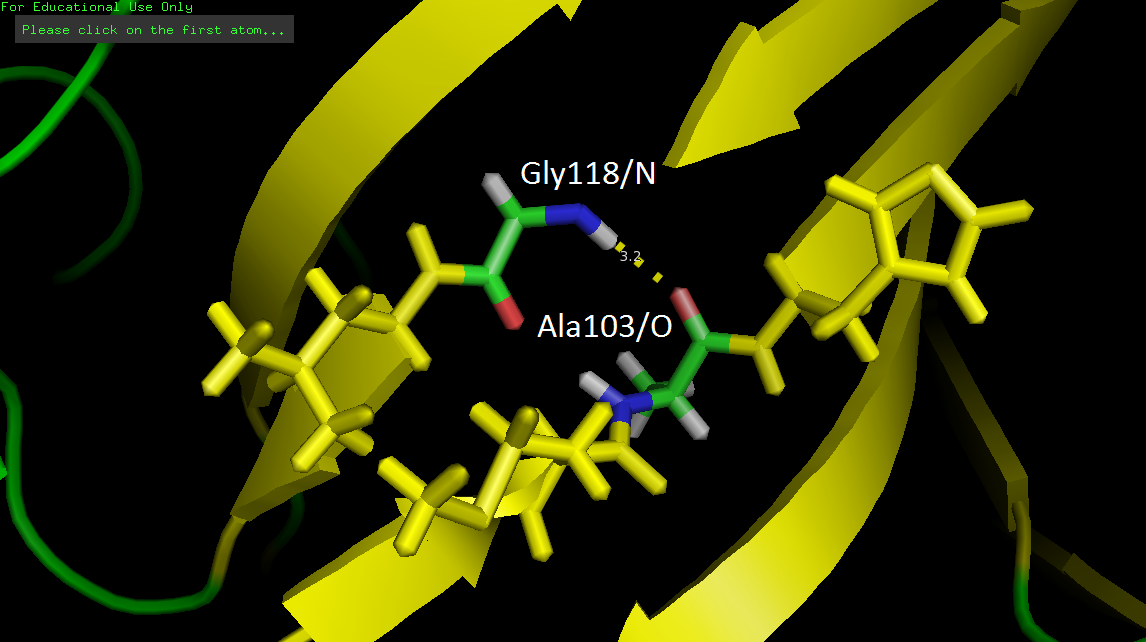
Водородная связь остова Ala103/O-Gly118/N
Водородная связь Ala103/O-Gly118/N в ядре белка — одна из формирующих бета-лист. Она обнаружена во всех ЯМР моделях с незначительным разбросом длины (3.0-3.2Å). На рис.1 изображена эта связь в 9 модели.
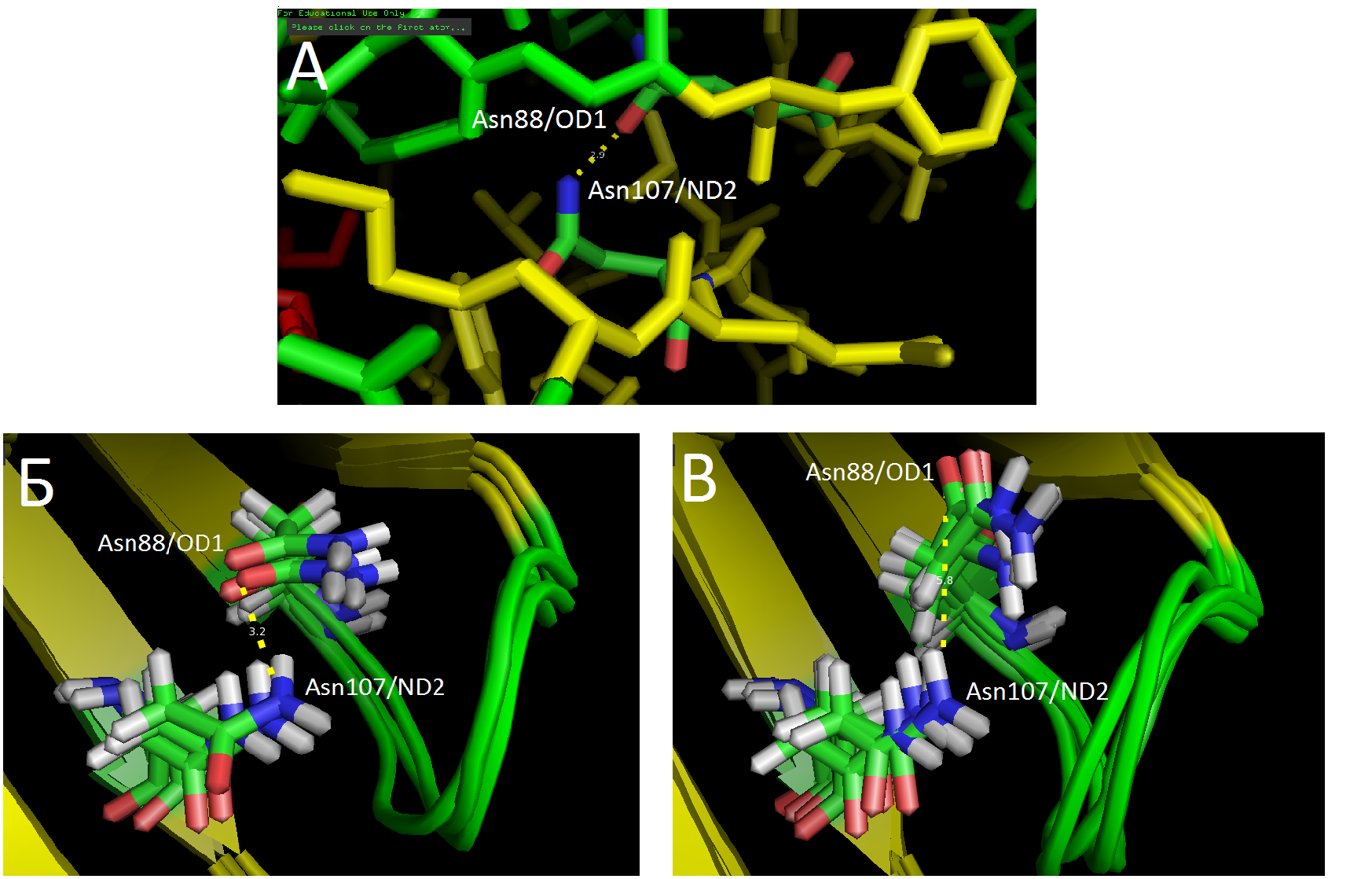
Водородная связь боковых цепей Asn88/OD1-Asn107/ND2
Остатки со связью между боковыми группами Asn88/OD1 и Asn107/ND2 лежат в соседних бета-цепях в ядре белка (рис. 2А). Среди ЯМР-моделей оказался большой разброс в расстояниях между этими атомами. Выделяются две группы моделей: (1) расстояние между донором и акцептором — 3.0-3.2Å; (2) 5.6-5.8Å. Можно заметить, что конформации боковых цепей (особенно Asn88) имеют сходство в каждой группе. Может быть, существуют две "удобные" конформации боковых цепей, которые мы и видим на рис. 2БВ. В любом случае, понятно, что водородные связи, сформированные атомами боковых групп в ядре белка, имеют бОльшую вариабельность по длине и вообще по присутствию связи.
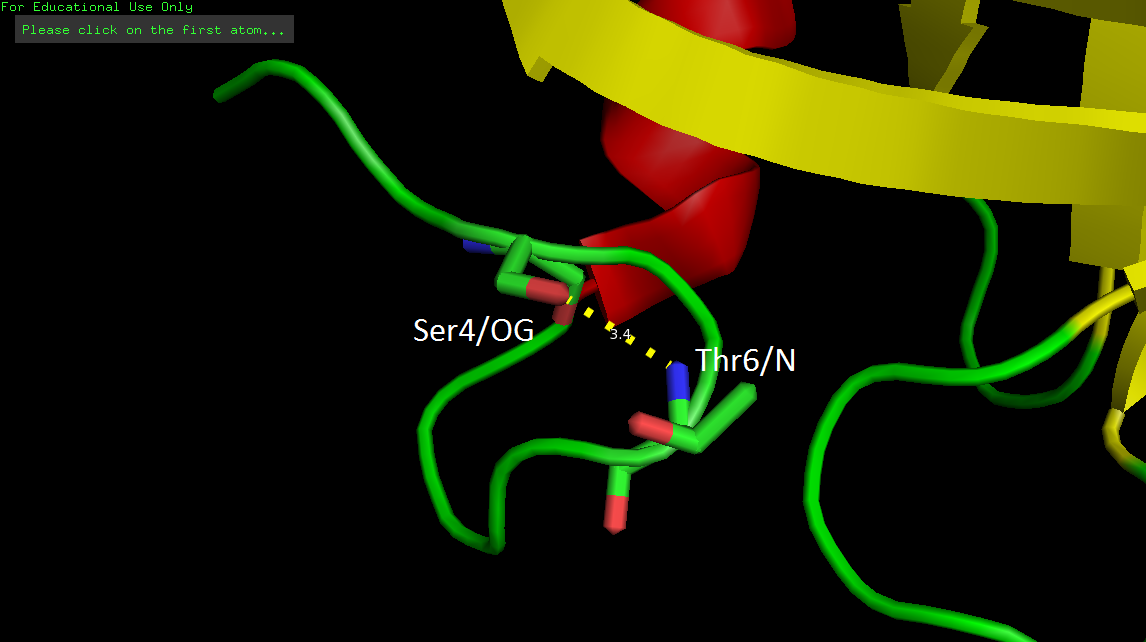
Водородная связь в петле Ser4/OG-Thr6/N
Атомы Ser4/OG и Thr6/N принадлежат петле, которая находится на поверхности глобулы и образуют водородную связь (рис. 3). Водородной связи между ними не оказалось ни в одной модели ЯМР: расстояние не меньше 5.7 Å. Видимо, в петлях на поверхности белка водородные связи еще более вариабельны.
Результат "0%" моделей со связью Ser4/OG-Thr6/N в петле не очень устроил, поэтому было решено еще поискать аналогичные связи.
Спираль в РСА, но петля в ЯМР
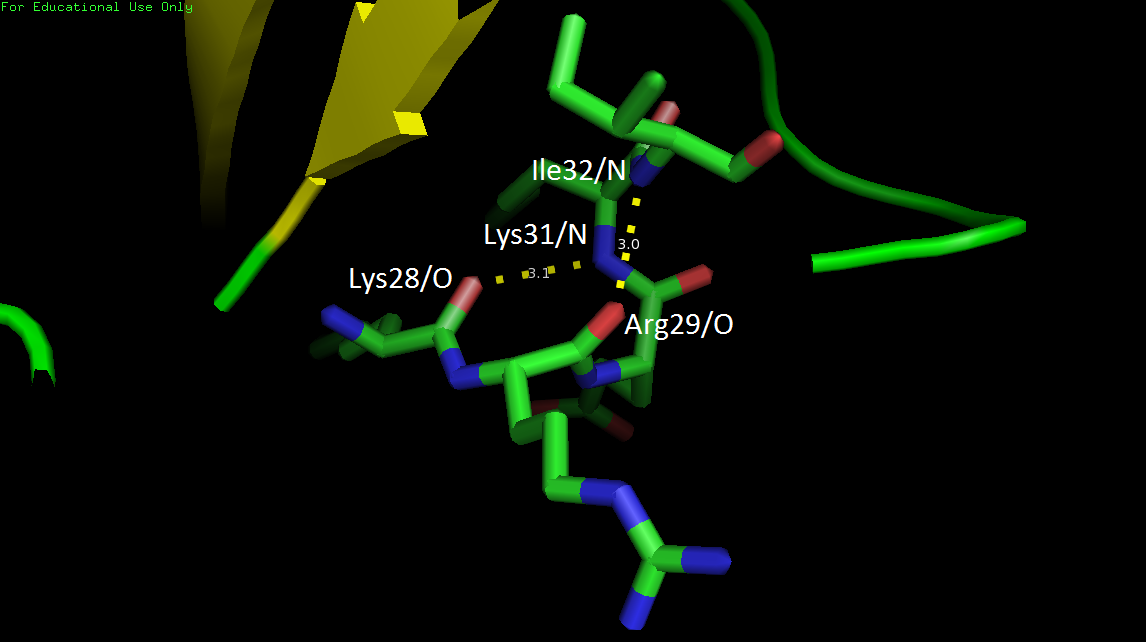
При просмотре двух структур сразу заметно, что в РСА-модели есть спираль Lys28-Ile32 на поверхности глобулы, которой нет в ЯМР-модели белка. В ЯМР эти остатки образовали петлю, а не спираль (рис. 4).
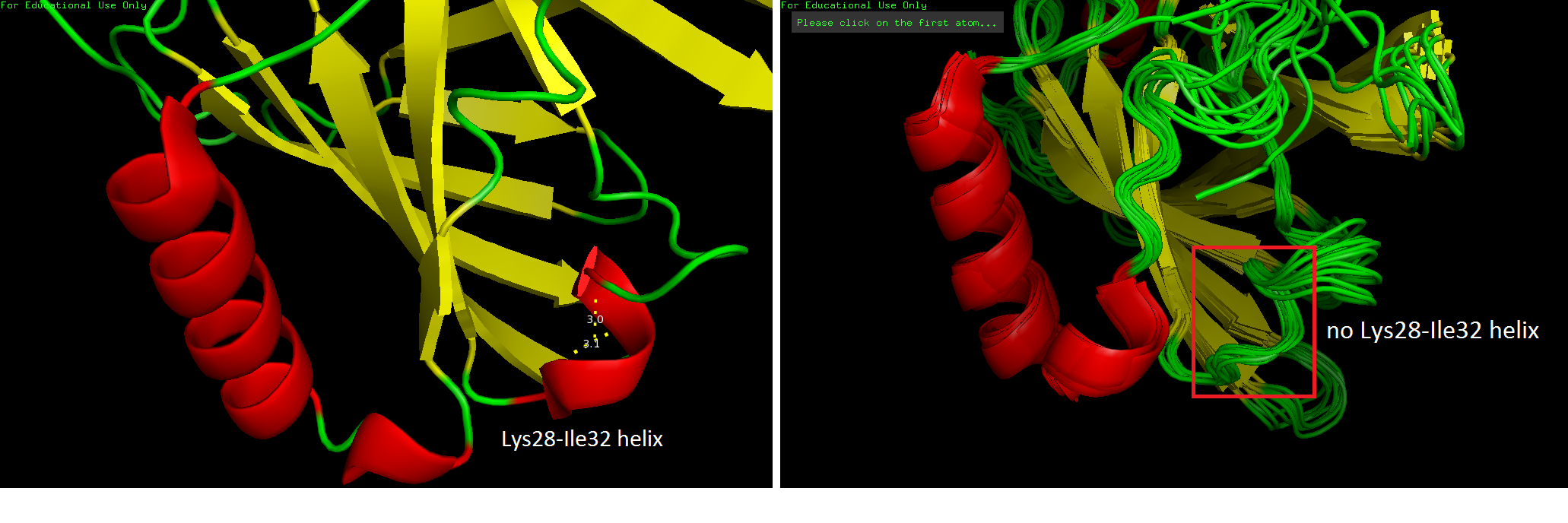
В структуре, полученной РСА, спираль формируется за счет двух водородных связей остова: Lys28/O-Lys31/N и Arg29/O-Ile32/N (рис.5).
Но в ЯМР-моделях на участке 28-32 есть только одна из этих водородных связей: Arg29/O-Ile32/N. Кроме нее есть еще одна связь в остове (Lys28/O-Glu30/N) (рис. 6), но, видимо, такими водородными связями стерически сложно образовать спираль.
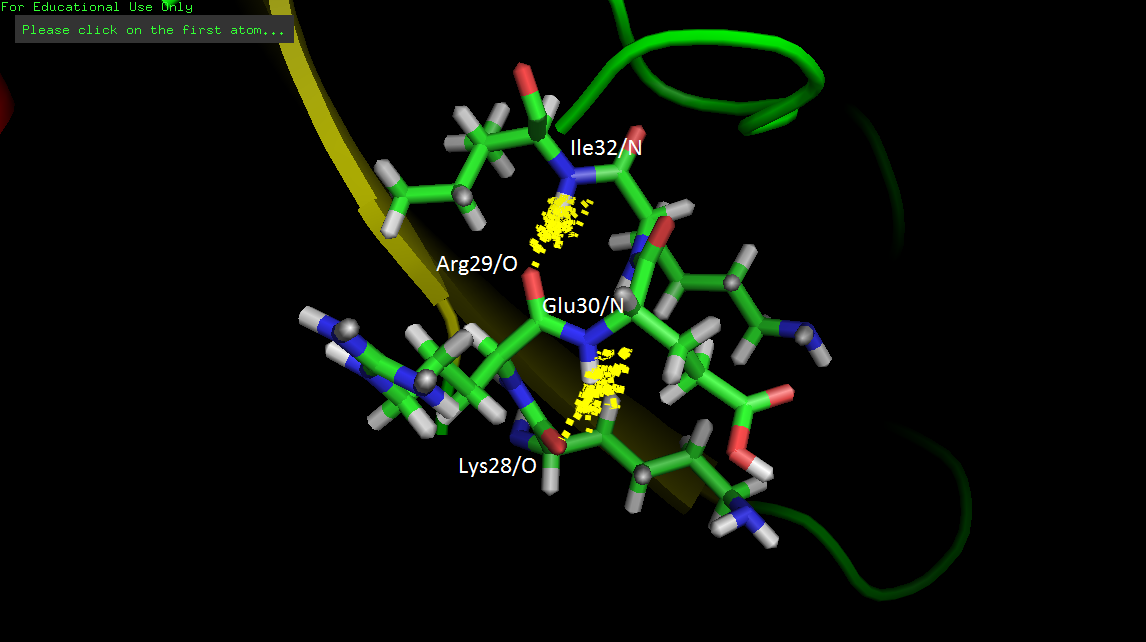
Получается, что рассмотрели еще один пример вариабельности водородных связей в петле снаружи глобулы.
Вывод
Видимо, внутри глобулы конформация остатков, а значит и присутствие или длина остовных водородных связей, более консервативна. Такие водородные связи обеспечивают формирование вторичной структуры ядра белка. Водородные связи между боковыми цепями остатков внутри глобулы более вариабельны. И самая большая варибельность водородных связей между остатками в петлях на поверхности глобулы. Наверное, потому, что они имеют наибольший контакт с растворителем, положение молекул которого все время различается и образуются разные водородные связи. К тому же в петлях не нужно такое постоянство вторичной структуры, как в ядре белка, где может находиться активный центр. Получается, что ЯМР позволяет понять, какие остатки наиболее вариабельны своей пространственной структурой в растворе, а какие — наоборот. А РСА дает понять, какие части структуры более-менее постоянны в кристалле.