Совмещение структур
Поиск структурных гомологов ACVR1 киназы человека 4BGG
С помощью сервиса PDBeFold отобрали 4 структурных гомолога 4BGG (табл. 1).
Таблица 1. Некоторые структурные гомологи белка 4BGG.
| Название структуры и цепь | Название белка | RMSD | Длина выравнивания в % от длины 4bgg |
|---|---|---|---|
| 4bgg:A | ACVR1 KINASE DOMAIN IN COMPLEX WITH LDN- 193189 | 0.00 | 100 |
| 3my0:K | ACVRL1 (ALK1) KINASE DOMAIN BOUND TO LDN- 193189 | 1.21 | 79 |
| 5e8z:A | TGF-BETA RECEPTOR TYPE 1 KINASE DOMAIN (T204D) | 1.30 | 70 |
| 1vjy:A | CRYSTAL STRUCTURE OF THE CYTOPLASMIC DOMAIN OF THE BONE MORPHOGENETIC PROTEIN RECEPTOR TYPE-1B | 1.16 | 69 |
| 3kcf:D | CRYSTAL STRUCTURE OF TGFBRI COMPLEXED WITH A PYRAZOLONE INHIBITOR | 0.9 | 69 |
Выравнивание 4BGG с гомологами
Сервис PDBeFold сделал структурное выравнивание (рис.1). Видно, что есть невыровненные участки (обозначены серым цветом), но они находятся скорее на поверхности белковой глобулы. В ядре белка структуры хорошо выровнялись.
Далее сделали множественное выравнивание этих же последовательностей алгоритмом Muscle. Сравнили его со структурным выравниванием в fasta-формате. Все полностью консервативные колонки (то есть выровненные остатки), найденные PDBeFold, были и в Muscle-выравнивании. Между двумя выравниваниями было только одно отличие. Два серина в 232-233 позициях выровнялись тривиально в Muscle (рис. 2, снизу). А в 3D-выравнивании эти десять аминокислот выровнялись как бы по трем группам (рис. 2, сверху). Посмотрим, какой вариант больше похож на правду.
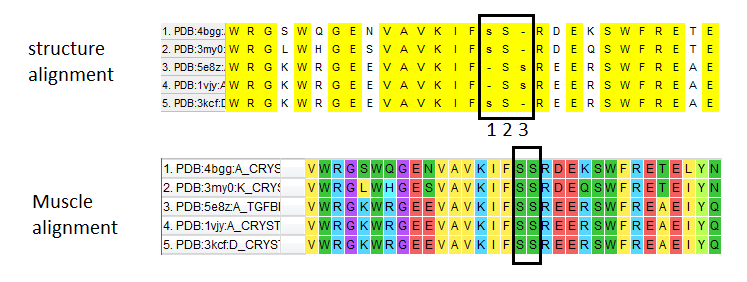
Три группы, которые образовали выровненные остатки в PDBeFold, показаны на рис.3. На рис.4 показано выраванивание Muscle: первая колонка и вторая.
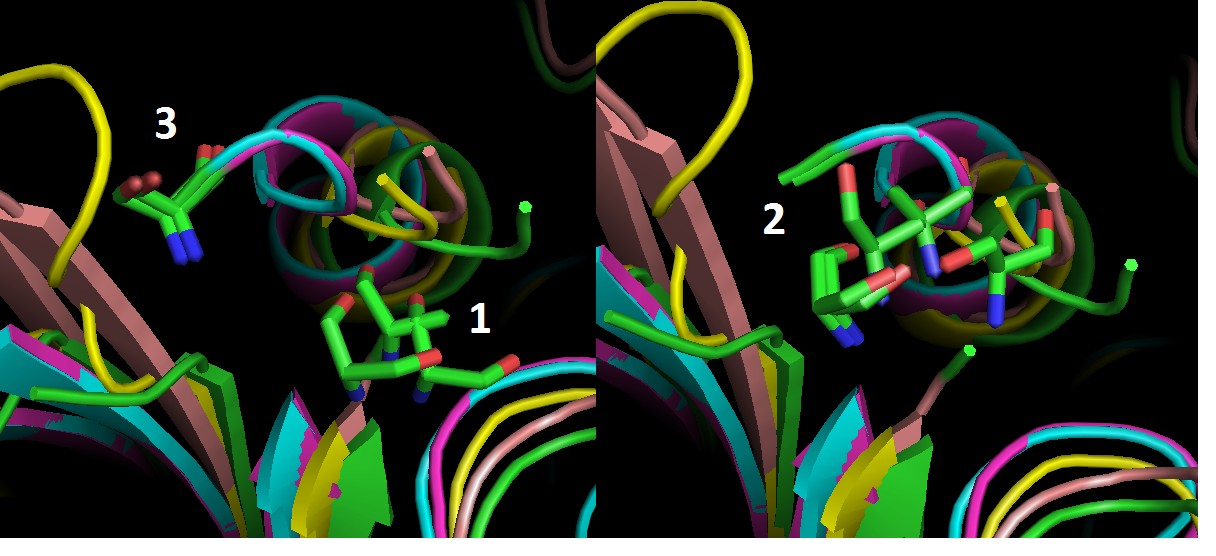
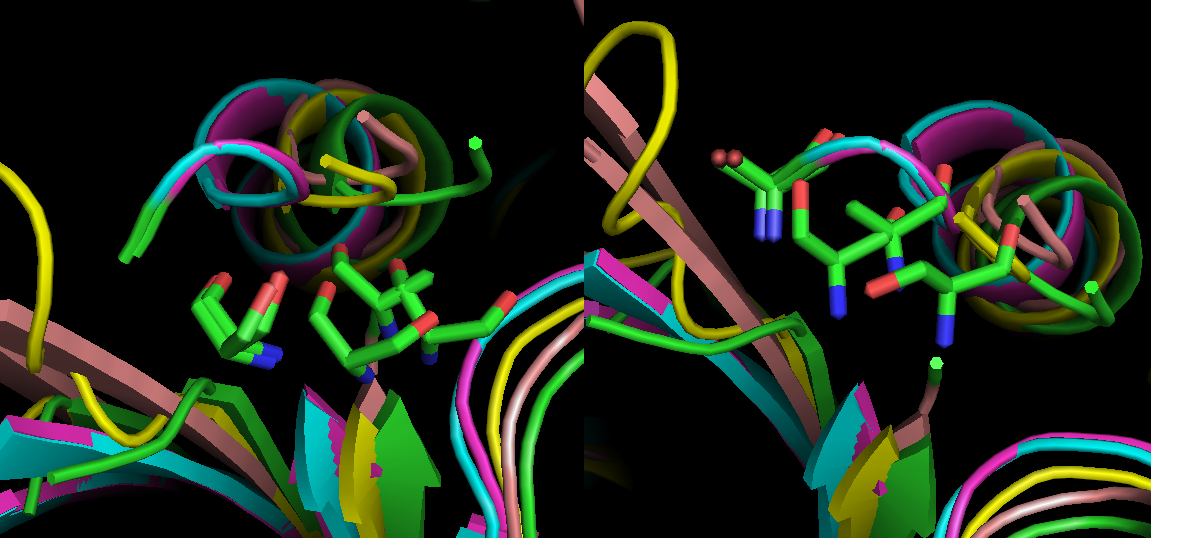
Остатки во второй группе 3D-выравнивания выровнены плохо (рис.3). Думаю, на этом участке скорее верно выраванивание Muscle.
Пример гибкого и жесткого структурного выравнивания
На сайте сервиса POSA (делает множественное гибкое структурное выравнивание) есть примеры, сделанные авторами сайта. POSA позволяет делать и жесткое, и гибкое выравнивание (возможность вненсения твиста в структуры). На рис. 5 показаны оба варианта выравнивания нескольких кальмодулин-содержащих белков. Когда программа внесла в структуры зеленого и красного белков твист, то "общее ядро" у всех структур увеличилось почти в два раза. Это хорошо потому, что, чем больше остатков выравнивается, тем лучше мы можем сравнить структуры. И вообще, в естественных условиях белки имеют гибкость структуры.