Каталитическая активность 5N3Y
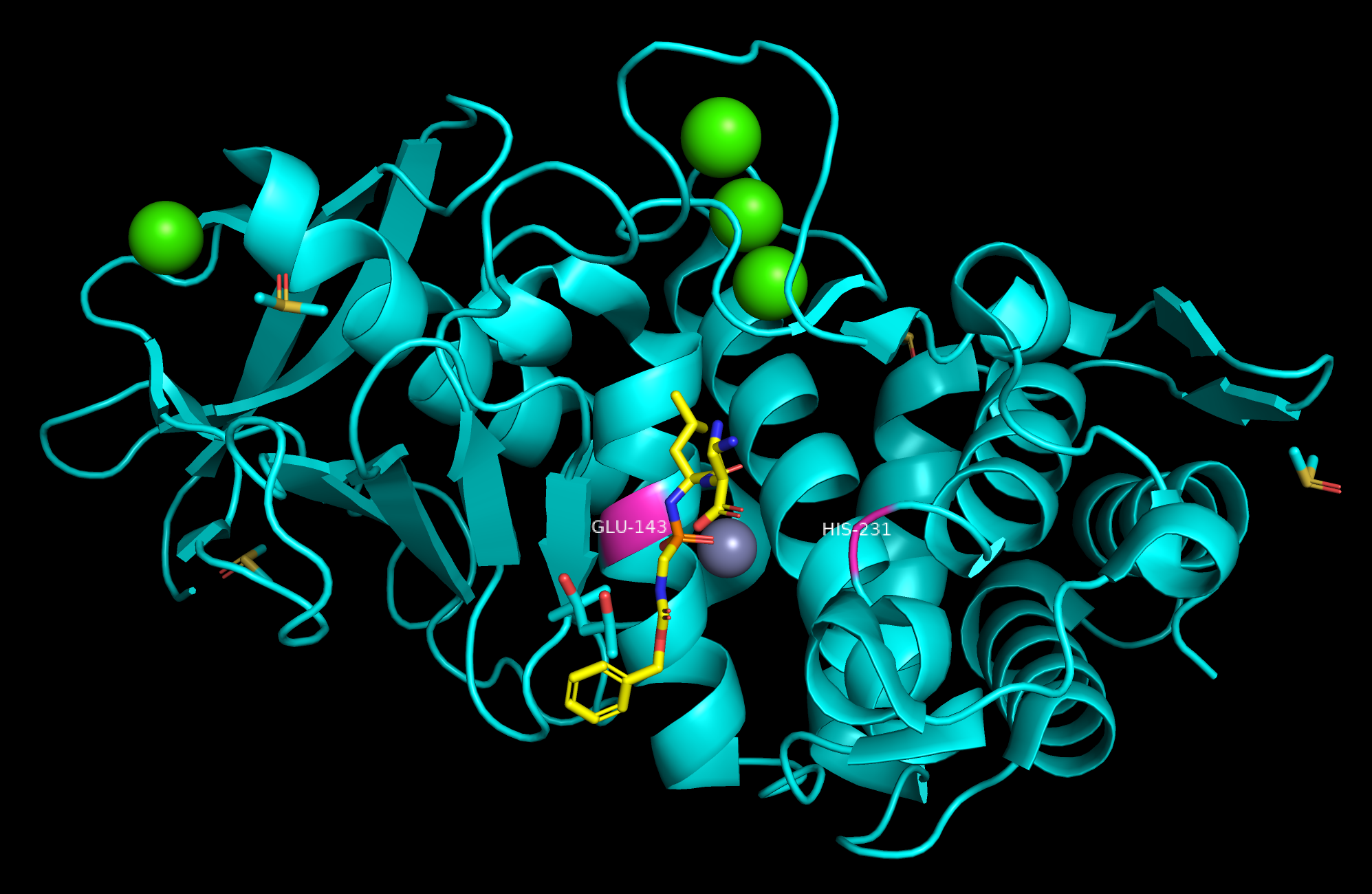
5N3Y – термолизин (или Bacillus thermoproteolyticus neutral proteinase) - это термостабильная внеклеточная металлоэндопептидаза, содержащая четыре иона кальция (EC 3.4.24.27). Катализирует реакцию гидролиза пептидной связи между лейцином и фениаланином.
В состав каталитического центра входят 2 аминокислоты: глутаминовая кислота (Glu-143) и гистидин (His-231); напрямую они не взаимодействуют.
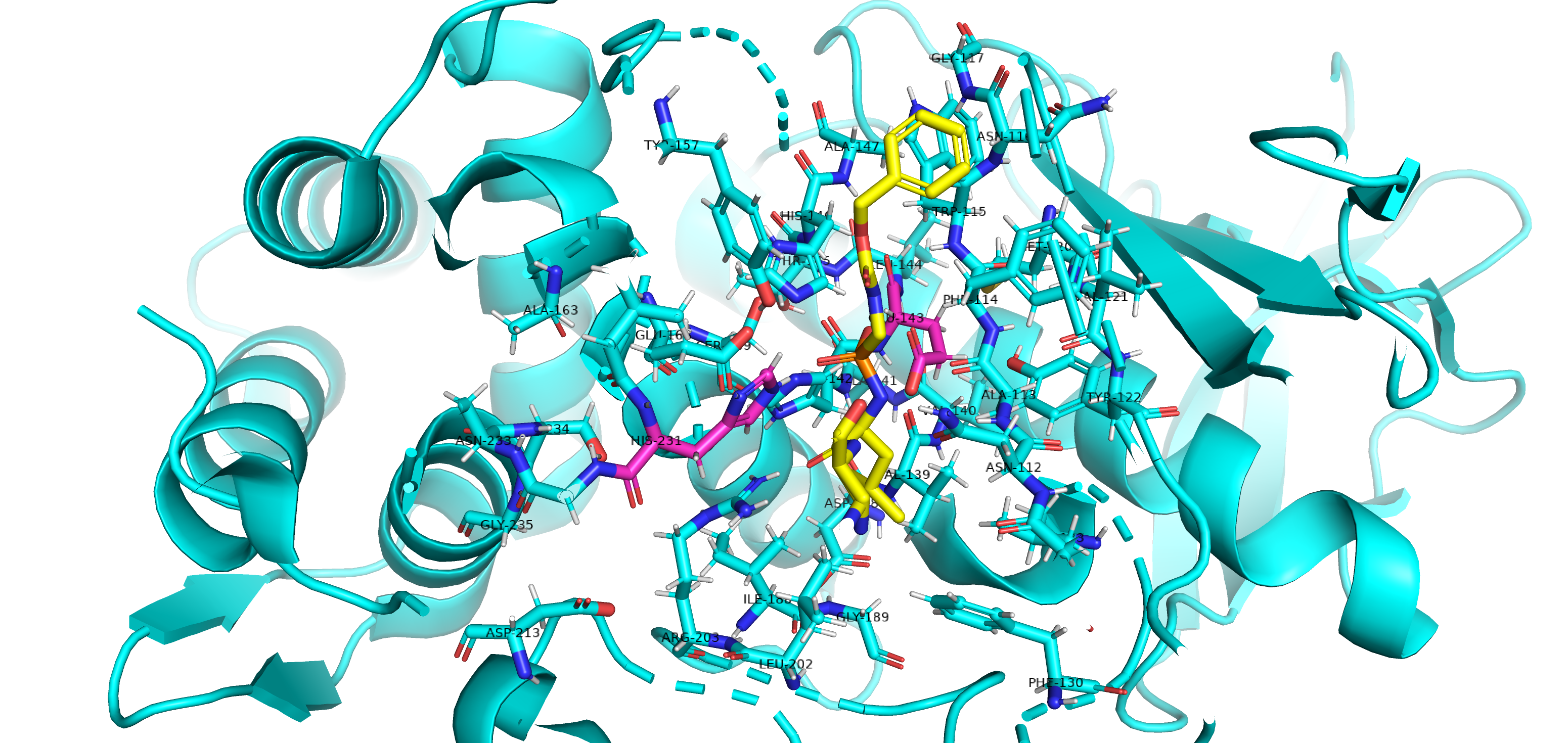
Гистидин вступает во взаимодействие с аспартатом своим боковым радикалом. Глутамин взаимодействует с окружающими аминокислотами только карбоксильной и аминогруппой, которые образуют пептидные связи (см. рис.3).
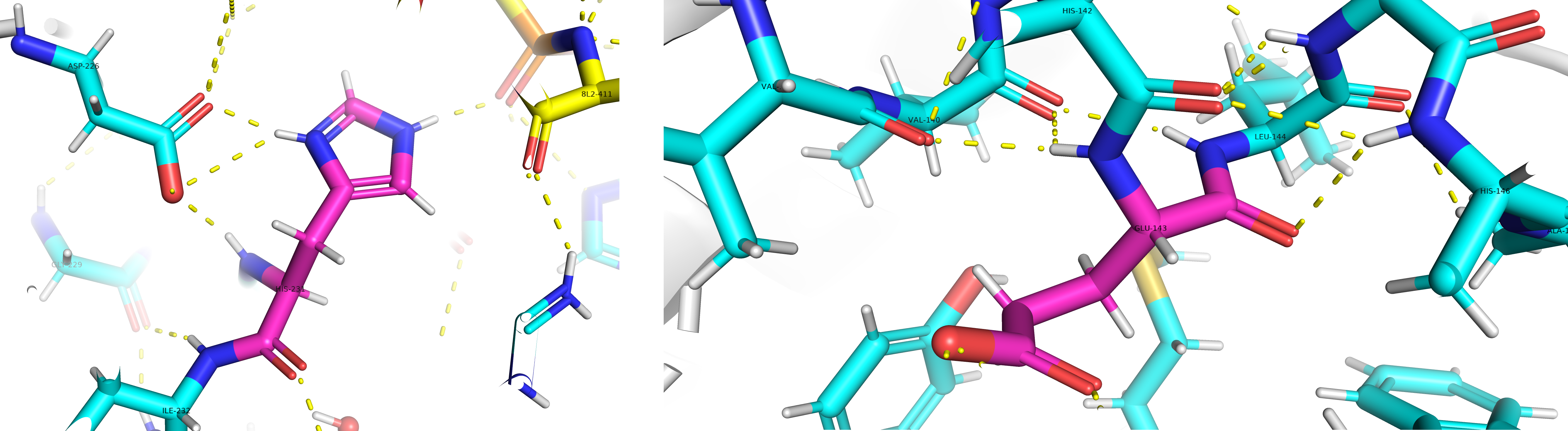
Связывание низкомолекулярного ингибитора
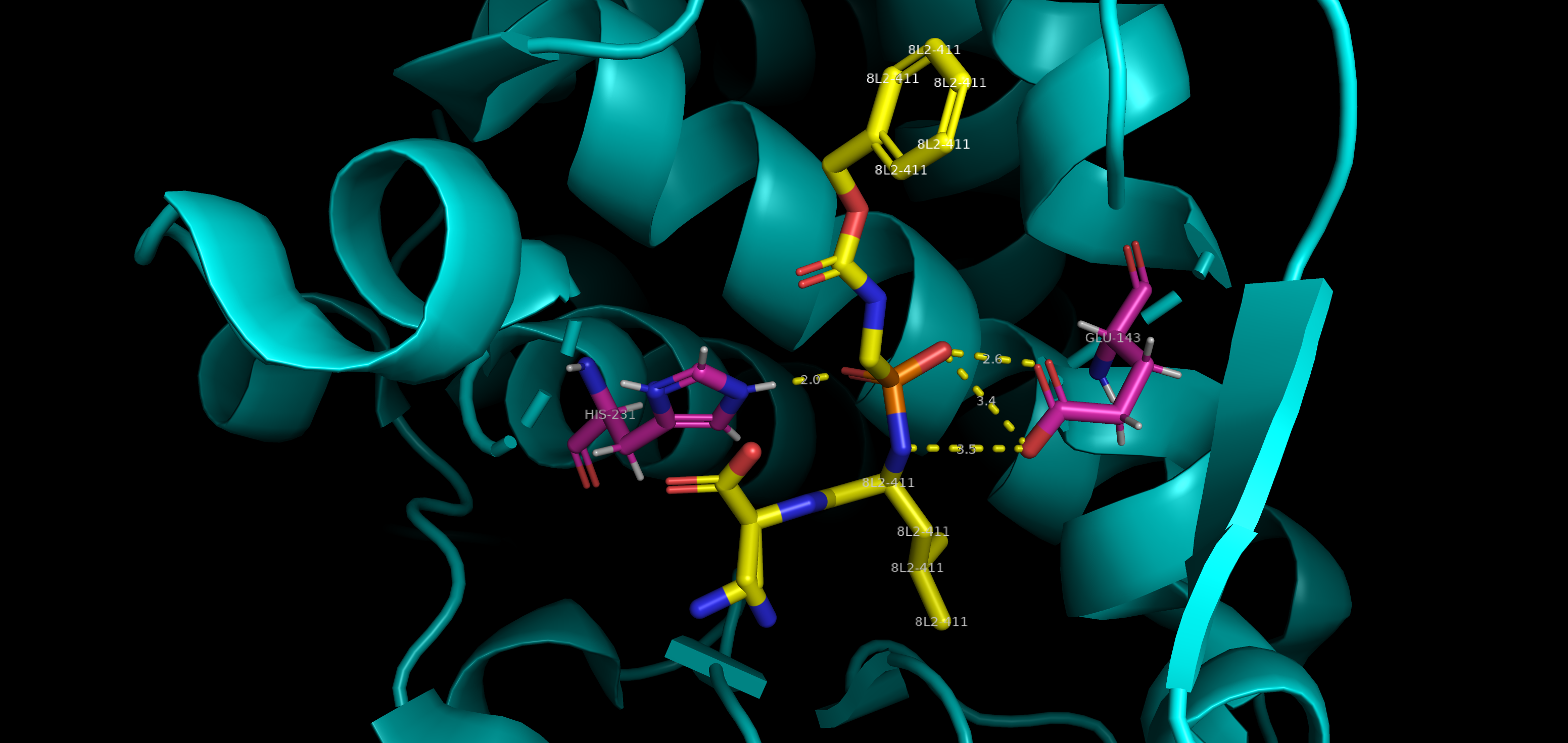
Механизм ингибирования:
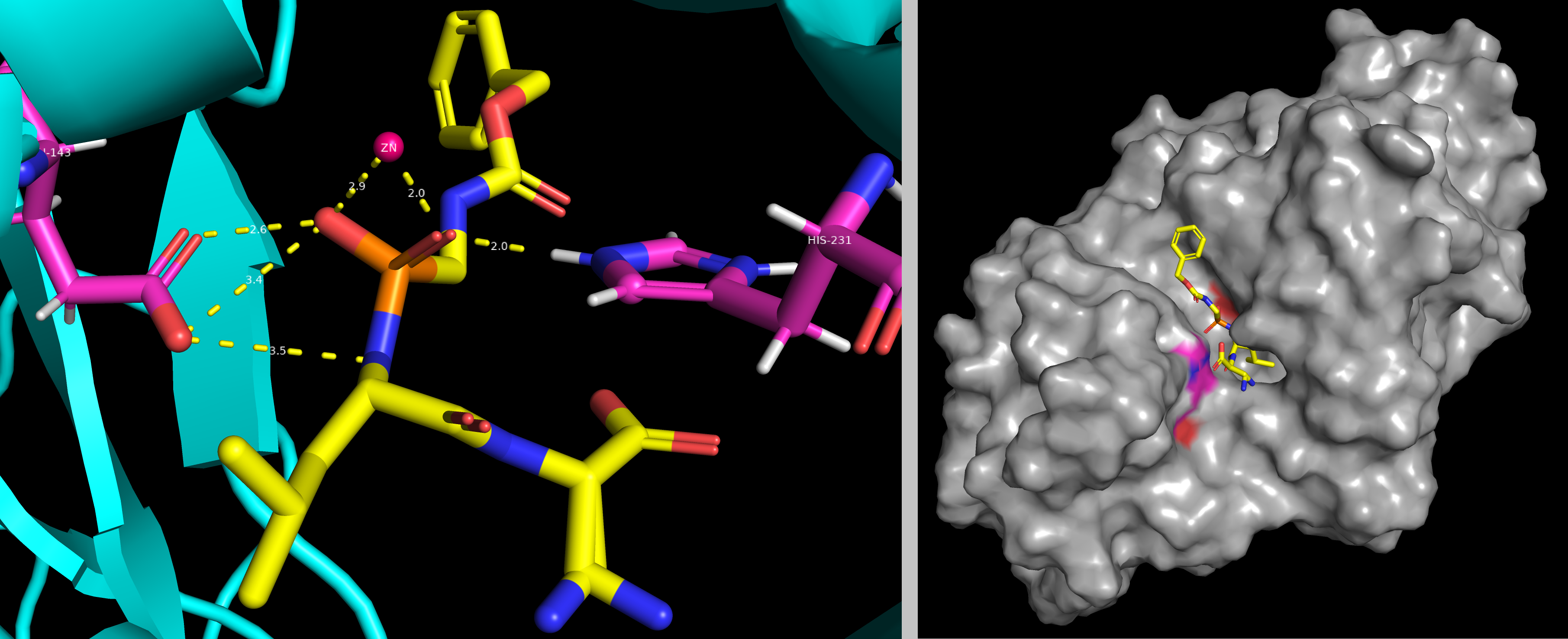
Цинкзависимый протеолиз требует наличия кислотной группы (глутаминовой кислоты), действующей в качестве основания, в сочетании с электрофильным ионом цинка для ускорения гидролиза связей. Ингибитор 8L2 относится к гидроксамовым кислотам, поэтому является идеальным бидентантным лигандом для иона цинка, а также образует водородные связи и электростатические взаимодействия с аминокислотными остатками каталитического центра фермента (см. рис. 5). Следовательно, связывание 8L2 останавливает каталитическую активность 5N3Y. [1]
Литература
1. Browner M. F., Smith W. W., Castelhano A. L. Matrilysin-inhibitor complexes: common themes among metalloproteases //Biochemistry. – 1995. – Т. 34. – №. 20. – С. 6602-6610.