Описание структуры 5N3Y
Структура в целом
Представленная макромолекула является белком. Thermolysin in complex with inhibitor JC267 (5N3Y) – фермент из класса гидролаз. В структуре присутствует одна полимерная цепь. Биологическая единица не отличается от асимметрической.
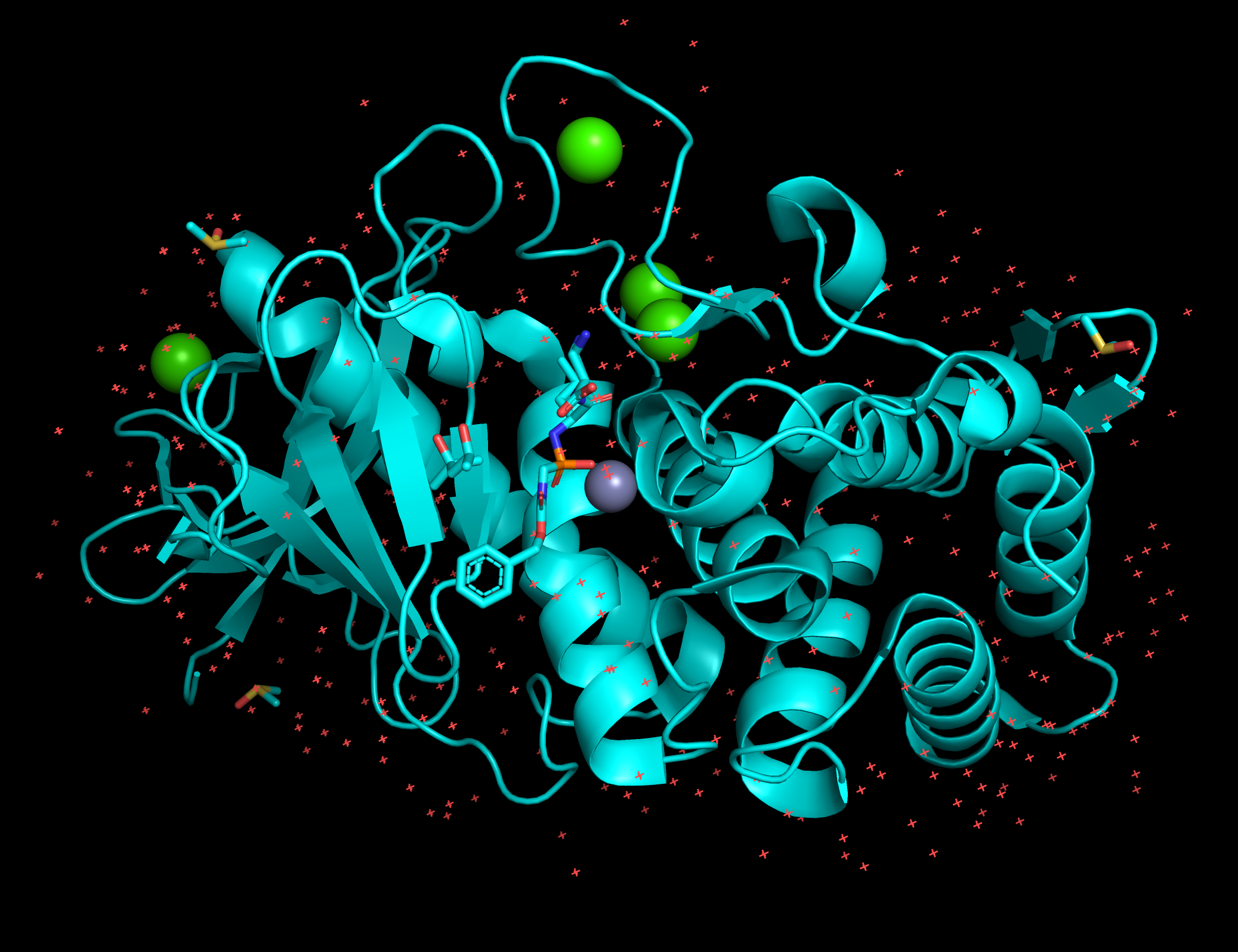
Отдельные цепи
Данные UniProt:
Данная макромолекула относится к бактерии Bacillus thermoproteolyticus.
uniprot_id: P00800
Название: Thermolysin
Функция: Extracellular zinc metalloprotease (данный фермент цинк-зависимый, способен разрушать все типы белков внеклеточного матрикса).
Мутаций относительно референса из UniProt нет. Модифицированные аминокислотные остатки отсутствуют.
Малые молекулы
В записи присутствуют:
C18H29N4O7P - 8L2 ((2~{S})-3-azanyl-2-[[(2~{S})-4-methyl-2-[[oxidanyl(phenylmethoxycarbonylaminomethyl)phosphoryl]amino]pentanoyl]amino]propanoic acid)
C6H14O2 – MPD ((4S)-2-METHYL-2,4-PENTANEDIOL)
C2H6OS – DMS (DIMETHYL SULFOXIDE)
Zn2+ - ZN (ZINC ION)
Ca2+ - CA (CALCIUM ION)
H2O - HOH (Water)
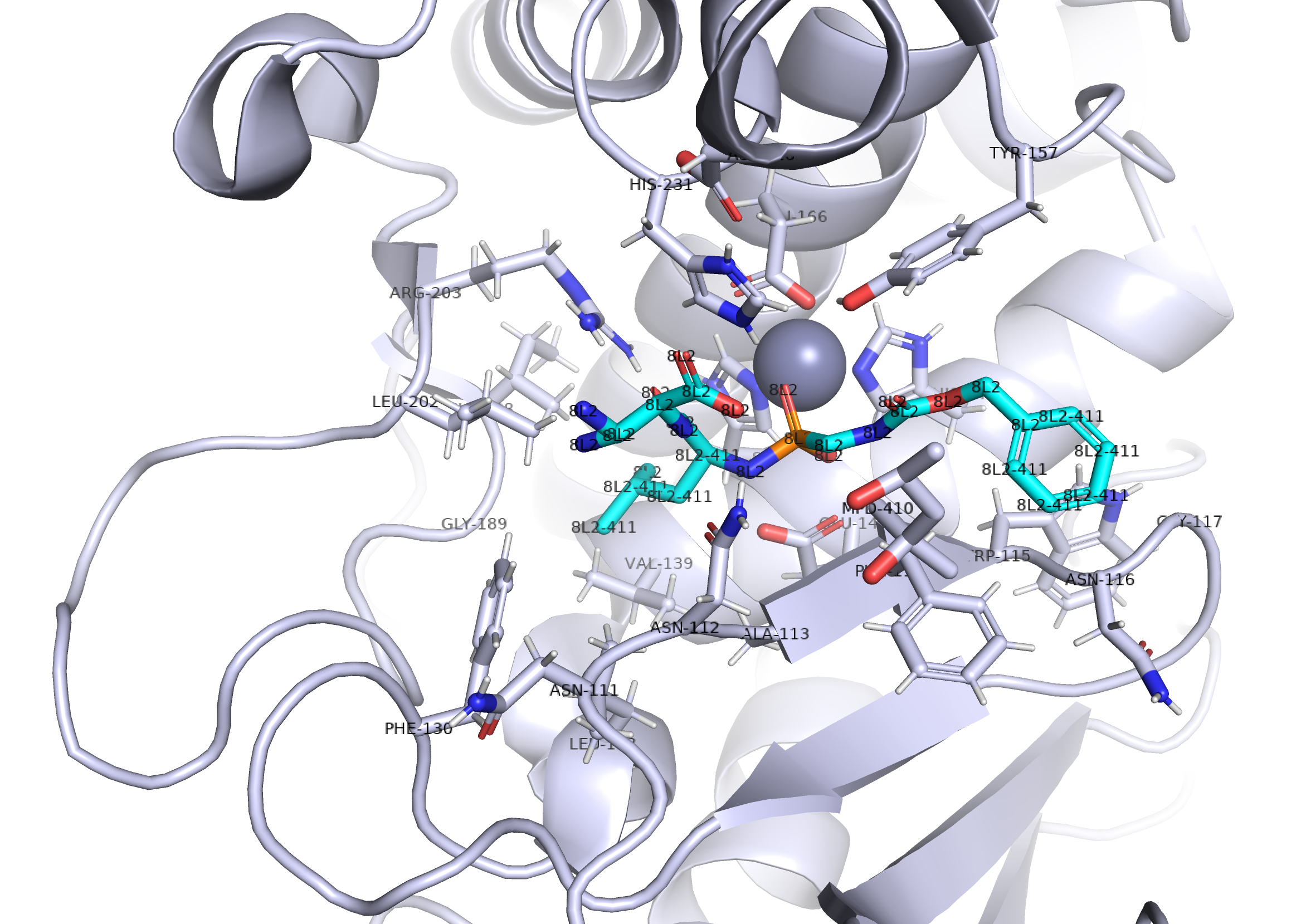
Данный комплекс был синтезирован для изучения термодинамических характеристик взаимодействия ингибиторов термолизина с концевыми заряженными аммониевыми группами. 8L2 – ингибитор термолизина, а ион цинка находится в активном центре, так как необходим для функционирования фермента. [1]
Литература
1. Cramer J. et al. Paying the price of desolvation in solvent-exposed protein pockets: Impact of distal solubilizing groups on affinity and binding thermodynamics in a series of thermolysin inhibitors //Journal of Medicinal Chemistry. – 2017. – Т. 60. – №. 13. – С. 5791-5799.