Учебный сайт Валяевой Анны
Интерпретация ЯМР структуры
Для сравнения структур, полученных с помощью методов ЯМР и РСА, был выбран LFA-1 домен (PDB ID: 1DGQ и 4IXD, соответственно). Для ЯМР-структуры представлено 22 модели, разрешение РСА-структуры 1.8Å. Укладки обеих структур похожи (рис. 1).
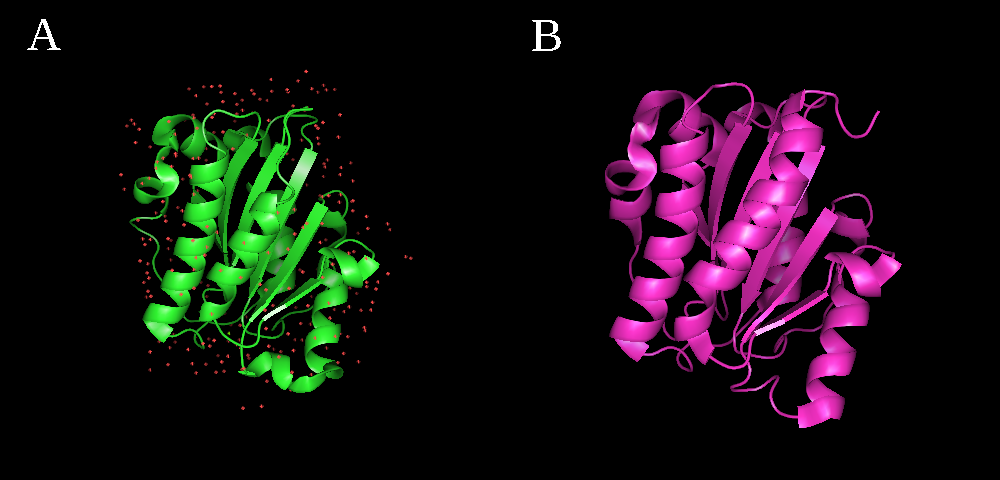
Рис. 1. (А) Структура LFA-1 домена, разрешенная методом РСА; (В) структура LFA-1 домена, разрешенная ЯМР.
Далее были выбраны три водородные связи в структуре, полученной методом РСА, для сравнения со структурой ЯМР (рис. 2):
а) связь между O и NH остова PHE134 и VAL171, соответственно, в β-листе в ядре белка;
b) связь между O и NH радикалов GLU180 и GLN172, соответственно, в ядре белка;
c) связь между остовным O и NH в радикале SER165 и ARG227, соответственно, в петле на поверхности глобулы белка.
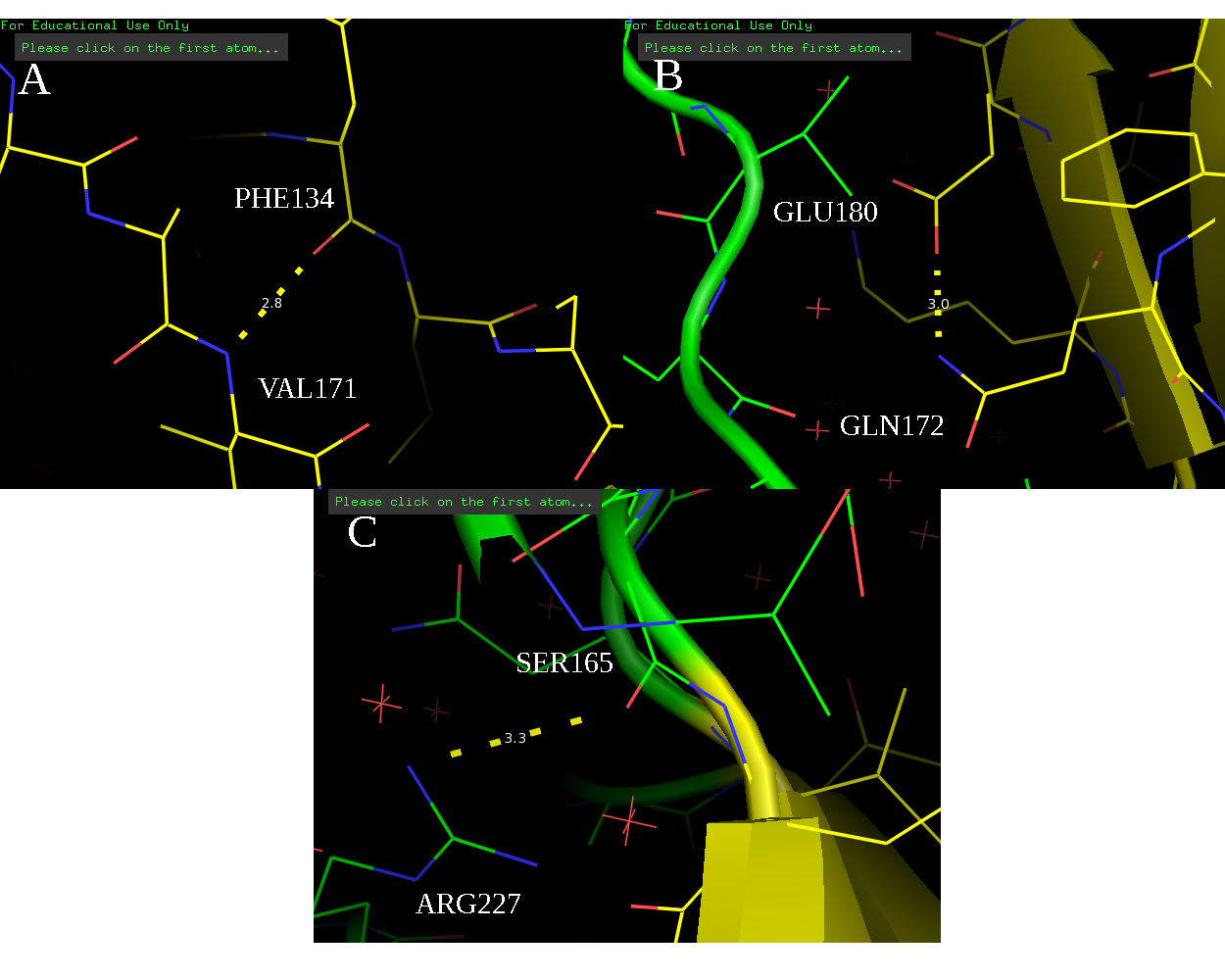
Рис. 2. Выбранные водородные связи.
В таблице 1 представлены данные по выбранным водородным связям в структуре, расшифрованной с помощью ЯМР, и сравнение со структурой РСА. Как видно из таблицы, ЯМР и РСА-структуры хорошо согласуются по остовным водородным связям во вторичных структурах, а по водородным связям между радикалами и на поверхности глобулы плохо. Видимо, остовные связи более фиксированы и сохраняются, как в кристалле, так и в нативной структуре в растворе. В то время как другие рассмотренные водородные связи могут и не образовываться в нативных условиях.
Таблица 1. Данные о трех рассматриваемых водородных связях в структуре ЯМР.
| Водородная связь | Положение связи | Длина в РСА, Å | Процент структур ЯМР | Минимальная длина в ЯМР, Å | Максимальная длина в ЯМР, Å | Медиана длины в ЯМР, Å |
| PHE134---VAL171 | остовная в β-листе | 2.8 | 100 | 2.8 | 2.9 | 2.8 |
| GLU180---GLN172 | между боковыми радикалами в β-листе | 3.0 | 0 | 4.7 | 6.5 | 4.8 |
| SER165---ARG227 | в петле на поверхности глобулы | 3.3 | 0 | 5.0 | 6.8 | 6.0 |
Дата последнего обновления: 25.12.16
©Валяева Анна